Анилин какими свойствами обладает
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
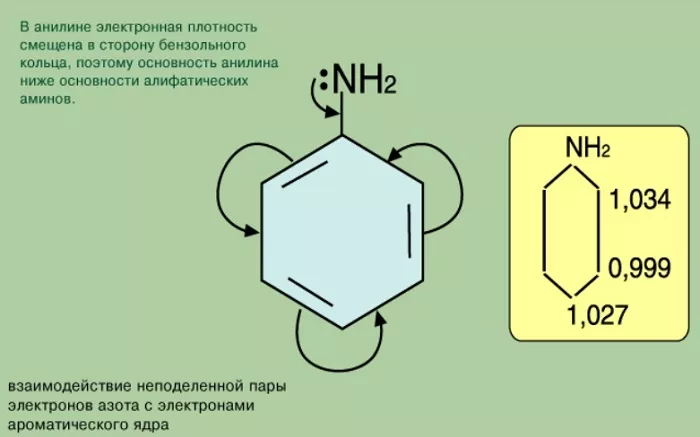
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
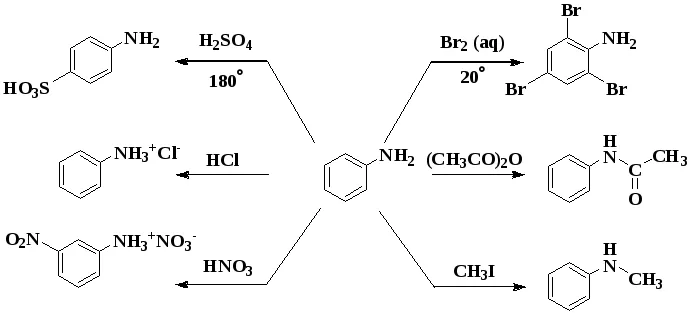
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях: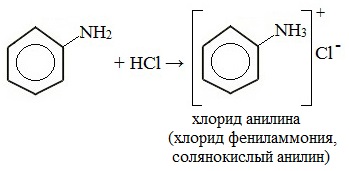
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
![]()
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
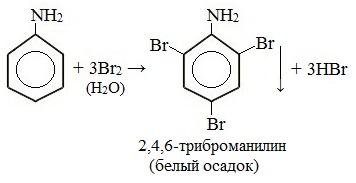
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
2. Сульфирование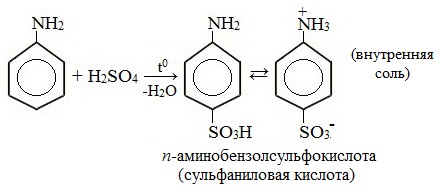
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
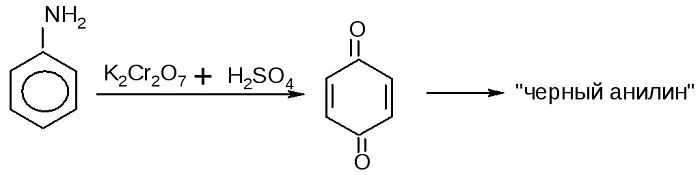
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.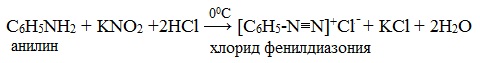
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
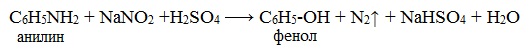
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Анилин
Источник
Анилин – это соединение, которое относят к органическим веществам. Принадлежит к классу аминов. Чтобы понять, что такое амины, можно представить формулу аммиака, затем один атом водорода или все заменить углеводородным радикалом.
Анилин (фениламин) — понятие, строение, физические свойства
Если в формуле аммиака только один водородный атом заменить фенил радикалом, получится анилин (фениламин). Поэтому его можно считать производным аммиака. Вещество называют также аминобензол.
Можно иначе представить это соединение. Если в формуле бензола вместо одного водорода поставить аминогруппу, получается анилин. Значит это производная бензола, где атом водорода замещается на аминогруппу.
Эмпирическая (молекулярная) формула фениламина C6H5 NH2. Его записывают с помощью структурной формулы:
Аминобензол содержит две группы атомов: аминогруппу и фенил радикал. Они оказывают влияние на свойства вещества.
Аминогруппа NH2– состоит из атома азота и двух атомов водорода. У азота на внешнем энергетическом уровне содержится 5 электронов. Два электрона образуют химическую связь с атомами углерода, один электрон образует связь с углеродом фенил радикала. У него еще остаётся два электрона. Они образуют свободную пару электронов.
Аминогруппа в составе анилина может присоединять протон водорода. Поэтому соединение проявляет свойства оснований. Так как по определению, вещества, присоединяющие протон водорода, принято считать основаниями.
Фенил радикал C6H5
– имеет в своём составе бензольное кольцо. Благодаря этому фениламин должен вступать в реакции, характерные для бензола.
Так как 2 группы атомов находятся в одном соединении, они оказывают влияние друг на друга.
Фенил радикал, влияя на функциональную группу, вовлекает свободную пару электронов в π – электронную систему. Такое смещение плотности влияет на проявление свойств соединения как основания. В результате фениламин не вступает во взаимодействие с водой. Аммиак, таким образом, более сильное основание.
Функциональная группа влияет на π – систему. Нарушается равномерное распределение электронной плотности. Она повышается у атомов 2,4,6 (в орто – и пара – положениях). Именно здесь будет идти замена водорода на другие атомы в химических реакциях.
Фениламин – это жидкость, маслянистая и ограниченно растворяющаяся в воде. Растворяется в органических соединениях.

Кипит при температуре 1840С, замерзает при температуре –60С. При окислении окрашивается в красно-бурый цвет. Молярная масса 93 г/моль. Плотность вещества при 200С составляет 1,02173 г/см3.
Вещество ядовито. Его относят ко второму классу опасности. При контакте с кожей может вызвать аллергию. При попадании в организм вызывает отравление. Есть информация о том, что оно может вызвать генетические мутации, возникает риск возникновения раковых заболеваний. Его называют ядом крови, так как вызывает кислородное голодание.
Получение анилина
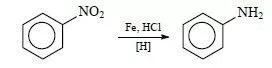
Фениламин получают из нитробензола. Данный способ был предложен русским учёным Н. Н. Зининым. Поэтому получил название «реакция Зинина».

Проводят взаимодействие железа с нитробензолом в присутствии соляной кислоты.
Идёт восстановление нитробензола до анилина. Синтез можно представить уравнениями реакций:
Fe + 2HCl = FeCl2 + 2H
С6Н5NO2
+ 6H = C6H5 NH2 + 2H2O
При взаимодействии анилина с галогеналканами и спиртами получают смесь вторичных, а также третичных аминов. Такое превращение носит название алкилирование.
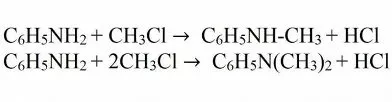
Химические свойства анилина
Для вещества характерны две группы свойств.
Реакции, идущие за счет функциональной группы.
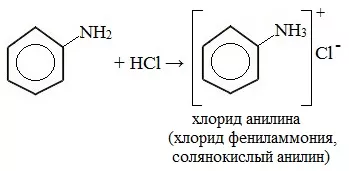
Фениламин взаимодействует с кислотами. В результате образуются соли. При взаимодействии анилина с хлороводородной кислотой получается хлорид фениламмония, или анилин солянокислый:
C6H5 NH2 + HCl = (C6H5 NH3)+Cl-
Свойства, идущие за счёт фенил радикала.
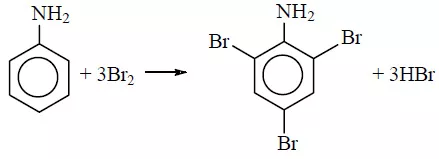
Для фениламина характерна реакция замещения, например бромирование. В результате получают 2,4,6 триброманилин. Образуется осадок белого цвета, поэтому реакцию считают качественной на обнаружение данного вещества.
Уравнение реакции с бромом выглядит следующим образом:
C6H5 NH2 +3 Br2
= C6H2Br3 NH2 + 3HBr
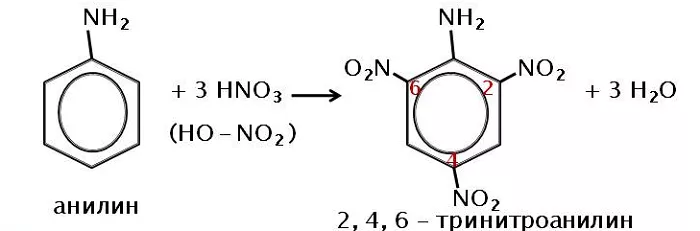
Нитрование, при котором происходит замещение в кольце ароматических аминов:
Вступает во взаимодействие с азотной кислотой, образуя тринитроанилин.
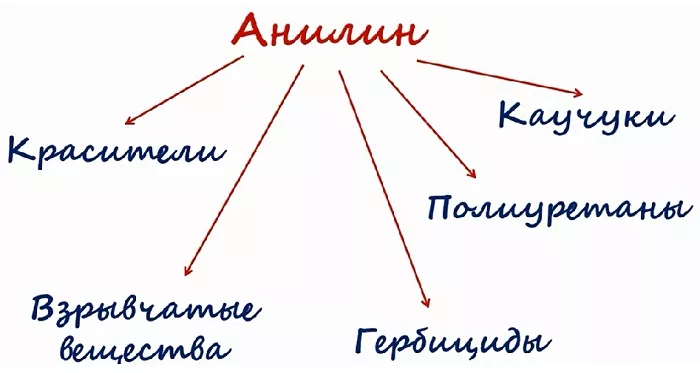
Применение анилина
Большая часть фениламина идёт для синтеза красителей. Его используют в получении типографской краски и синтетических красителей для текстильной промышленности.
Так в кислой среде анилин окисляется дихроматом калия, в результате получается чёрный краситель. Эта реакция также рассматривается как качественная на фениламин:
6 C6H5 NH2 + 4K2Cr2O7
+ 19H2SO4
= 6C6H4O2
+ 4K2SO4
+ 4Cr2(SO4)3
+ 3(NH4)2SO4
+ 16H2O
Вещество является исходным для получения лекарственных препаратов. Сульфаниламидные соединения, получаемые на основе анилина, используют в медицине в качестве лекарств. Это производные анилина. К ним относятся: парацетамол, фенацетин и другие.
Также на основе соединения производят химические средства защиты растений, различные смолы, крем для обуви, взрывчатые вещества.
Источник
Анилин — это органическое соединение, содержащее ароматическое ядро и аминогруппу, соединенную с ним. Его также иногда называют фениламином или аминобензолом. Представляет собой маслянистую жидкость, не имеющую цвета, но с характерным запахом. Сильно ядовит.
Получение
Анилин — очень полезное промежуточное вещество, поэтому производится он в относительно больших масштабах. Промышленный синтез начинается с бензола. Его нитруют при температуре 60 °C смесью концентрированных серной и азотной кислот. Далее полученный нитробензол восстанавливают водородом при температуре около 250 °C, используя катализаторы. Также может применяться повышенное давление.

В лаборатории восстановление может производится водородом в момент его выделения. Для этого в реакционной смеси проводят взаимодействие металлического цинка или железа с кислотой. Полученный атомарный водород вступает во взаимодействие с нитробензолом.
Получать анилин можно в одну стадию, если проводить взаимодействие бензола со смесью азида натрия и хлорида алюминия. Реакция длится 12 часов. Выход такой реакции составляет 63 %.
Физические свойства
Как уже было отмечено выше, анилин — это бесцветная маслянистая жидкость. При температуре -5,9 °C он замерзает. Кипит при 184,4 °C. Плотность почти как у воды (1,02 г/см3). Анилин растворим в воде, хотя довольно слабо. Зато он смешивается в любых соотношениях с различными органическими растворителями: бензолом, толуолом, ацетоном, диэтиловым эфиром, этанолом и многими другими.
Химические свойства
Химические свойства анилина довольно разнообразны. Например, он проявляет как кислотные, так и основные свойства. Последние обусловлены тем, что аминогруппа может присоединять к себе ион водорода (протон). Отсюда и название этого процесса — протонирование. Благодаря этому анилин может взаимодействовать с кислотами, образуя соли:
C6H5NH2 + HCl → [C6H5NH3]+Cl-
Кислотные свойства объясняются тем, что атомы водорода в аминогруппе легко отщепляются и замещаются другими атомами. Так, анилин может взаимодействовать со щелочными металлами. Реакция с калием идет без катализаторов, с натрием необходимо присутствие катализаторов: меди, никеля, кобальта или солей этих металлов. Идти эта реакция может и с кальцием, но в этом случае необходимо нагревание до 200 °C.

Замещается водород и радикалами. Это происходит при взаимодействии анилина со спиртами. Реакция проводится в кислой среде, так как необходимо протонирование аминогруппы. Температура реакционной смеси должна поддерживаться около 220 °C. Иногда применяется повышенное давление. Конечный продукт содержит моно-, ди- и тризамещенные производные анилина. Поэтому для получения чистого вещества необходимо использовать очистку, например перегонку.

Алкилирование можно также проводить, используя алкилгалогениды. Здесь также может быть получены несколько продуктов.

Анилин может вступать в реакции и по ароматическому ядру. Обычно это реакции электрофильного замещения (нитрование, сульфирование, алкилирование, ацилирование). Аминогруппа активирует бензольное ядро, поэтому новые группы встают в пара-положение. Галогенирование происходит очень легко. В данном случае замещаются все атомы водорода в ядре.
Как видно из уравнений реакций, химические свойства анилина довольно разнообразные. Здесь указаны далеко не все.
Применение
Из-за своих физических и химических свойств, анилин в чистом виде применяется только в лабораториях, как реагент или органический растворитель. В промышленности весь анилин уходит на синтез более сложных и полезных соединений. Например, фосфат анилина применяется как ингибитор (замедлитель) коррозии углеродистых сталей.
Большая доля анилина идет на производство полиизоцианатов, из которых, в свою очередь, получают полиуретаны. Это органический полимер, который используют во многих отраслях промышленности для изготовления эластичных форм, защитных покрытий, лаков, герметиков.
7 % анилина применяется в качестве добавки для полимеров. Это может быть как чистый анилин, так и соединения, полученные из него. Они оказывают роль инициаторов, стабилизаторов, пластификаторов, порообразователей, вулканизаторов или ускорителей полимеризации. Такое разнообразие достигается благодаря специфичным химическим свойствам анилина.
Азотсодержащие органические вещества часто применяют в производстве красителей. Анилин не стал исключением. Из него напрямую синтезируют более 150 различных красителей, еще больше — из его производных. Самые важные из них — это анилиновый черный, пигмент глубоко-черный, нигрозины, индулины и азокрасители.
Токсичность
Анилин — токсичное вещество. Попадая в кровь, он образует соединения, которые вызывают кислородное голодание. Проникать в организм он может также и в виде паров, через кожу или слизистые оболочки. Признаками отравления анилином служат слабость, головокружение, головная боль. При более сильном отравлении возникает тошнота, рвота, а также учащение пульса.
Это вещество оказывает губительное воздействие на нервную систему. При хроническом отравлении может возникать снижение памяти, расстройства сна, а также психические нарушения.
Первая помощь при интоксикациии состоит в том, чтобы убрать источник отравления и омыть пострадавшего теплой водой. Это поможет растворить анилин, который осел на коже пострадавшего. Существуют и специальные антидоты. Их вводят в организм при тяжелых случаях.
Источник
 История анилина началась в XIX веке. Сегодня продукция, изготовленная на его основе, прочно вошла в повседневный обиход. За это время учёные, эксперты производства всесторонне изучили свойства популярного реагента. Анилин (аминобензол, фениламин) является сильнодействующим ядом. Попадая в организм человека, он парализует систему доставки кислорода к тканям.
История анилина началась в XIX веке. Сегодня продукция, изготовленная на его основе, прочно вошла в повседневный обиход. За это время учёные, эксперты производства всесторонне изучили свойства популярного реагента. Анилин (аминобензол, фениламин) является сильнодействующим ядом. Попадая в организм человека, он парализует систему доставки кислорода к тканям.
Давайте выясним, что такое анилин, историю его открытия, физические и химические свойства, где он сейчас применяется, какие симптомы указывают на острое и хроническое отравление им, о последствия интоксикации и мерах профилактики.
Что такое анилин
Это органическое соединение, которое относится к классу ароматических аминов. Впервые получил анилин немецкий химик Отто Унфердорбен в 1826 году, дав ему название кристаллин. Но на этом его история открытия не закончилась. На протяжении следующих 17 лет во время исследований разных учёных его получали ещё трижды.
- В 1834 г. немецкий химик-органик Фридлиб Фердинанд Рунгe выявил анилин в каменноугольной смоле, дав ему название кианол.
- В 1840 г. немецко-русский химик Юлий Фёдорович Фрицше получил это вещество путём нагревания индиго с раствором гидроксида калия, назвав его анилином.
- В 1842 г. русский химик-органик Николай Николаевич Зинин синтезировал анилин путём восстановления нитробензола действием сульфида аммония, назвав его бензидамом.
И лишь в 1843 г. немецкий химик-органик Август Вильгельм Гофман установил общность этих соединений, названных разными именами.
Способы получения
Основной способ синтеза анилина — восстановление нитробензола. Сегодня в качестве восстановителя обычно применяют водород. Это самый распространённый промышленный метод получения анилина.
Часть производственных процессов позволяет использовать в роли восстановителей другие вещества — металлы (железо, цинк, олово), соли (хлорид олова, сульфиды щелочных металлов), сероводород. Успешно применяются в производстве каталитический и электрохимический методы восстановления.
Физические и химические свойства
Формула анилина — C6H5NH2 содержит аминогруппу, поэтому вещество имеет второе название — фениламин. А также благодаря присутствию бензольной группы, он известен как аминобензол.
По своим физическим свойствам анилин — это бесцветная маслянистая жидкость, малорастворимая в воде. Имеет неприятный аммиачный запах. При горении образует яркое коптящее пламя. Температура кипения анилина составляет 184,4 °C. Это горючее вещество — при нагревании выше 70 °C могут образоваться взрывоопасные соединения. На воздухе анилин легко окисляется и приобретает красно-бурый цвет.
Благодаря химическим свойствам взаимодействует с сильными неорганическими кислотами (соляная, серная, фосфорная) и образует соли.
Применение
Анилин — это одно из первых органических соединений, полученных искусственным путём. Его открытие привело к созданию нескольких успешных отраслей.
В промышленности
Производственное использование анилина охватывает различные области — от получения ракетного топлива до изготовления крема для обуви.
Анилин и его соединения применяют в производстве:
- полиуретанов (конструкционные материалы, тепло- и звукоизоляция);
- ускорителей для вулканизации на основе натурального и синтетических каучуков (шины, резинотехнические изделия, резиновая обувь);
- красителей для тканей;
- эпоксидных полимеров;
- взрывчатых веществ;
- ингибиторов коррозии металлов;
- моторного топлива;
- смол, лаков.
Красители на основе анилина придают яркий цвет натуральным и синтетическим тканям, коже, шерсти, овчине. Однако существенным недостатком такого окрашивания является выгорание на солнце и низкая устойчивость к воздействию воды.
Анилин и его соединения являются сырьём для изготовления сложных промежуточных продуктов. Кроме основных областей применения, анилин используют при производстве гербицидов, пестицидов, фунгицидов, типографской краски, чернил, реактивов для фотографии, духов.
В медицине
Анилин является сырьём для фармакологической промышленности. Лекарства, изготовленные с его применением, оказывают следующее действие:
- обезболивающее, жаропонижающее — анальгин, бутадион;
- антимикробное — этазол, сульфален, сульгин, сульфаниламид, бисептол;
- нейролептическое — аминазин, пропазин.
Производные анилина входят в состав медицинских красителей. Метиленовый синий оказывает антисептическое, анальгезирующее действие. Генцианвиолет применяется как антибактериальное, противоглистное, местное противовоспалительное средство. Фуксин используют для местного лечения гнойничковых и грибковых заболеваний кожи, себореи. Красители применяют в бактериологических исследованиях для окраски микроорганизмов.
Действие на организм человека
Анилин является сильным ядом, высокотоксичным для человека. Чаще всего интоксикация развивается при поступлении вещества через дыхательные пути, неповреждённую кожу и слизистые оболочки — ротовую полость, глаза. Небольшое количество может проникать через желудок.
Выводится вещество из организма в основном через почки. Оставшаяся часть выходит через дыхательные пути.
Анилин является гемотоксином, то есть наносящим вред крови человека. Механизм анилинового отравления состоит в образовании метгемоглобина, разрушении эритроцитов. Блокируется транспорт кислорода, что ведёт к поражению центральной нервной системы.
Кроме инактивации гемоглобина, токсичность анилина проявляется в развитии острой дыхательной, сердечно-сосудистой, почечной, печёночной недостаточности.
Накапливается анилин в печени и жировой ткани, создавая депо. Горячий душ, сауна, баня, приём алкоголя могут спровоцировать повторный выход токсина из депо в кровь, вызвав ухудшение состояния даже спустя две недели.
Отравление анилином
При кипении анилин образует пары, которые тяжелее воздуха. В производстве красителей, высока опасность отравления при соприкосновении с его растворами.
Причины отравления:
- непосредственный контакт с веществами в процессе их производства, хранения и применения;
- передозировка лекарственных препаратов;
- суицидальные попытки (нейролептиками);
- нарушения требований техники безопасности на производстве или в домашних условиях;
- аварии на промышленных объектах;
- загрязнение атмосферы ядовитыми парами, водоёмов стоками.
Отравление анилиновыми красителями может произойти в домашних условиях. Их используют для изменения цвета тканей, нанесения рисунков. Концентрация, состав красок рассчитаны на применение вне производственных объектов. Перед началом работы необходимо внимательно прочитать инструкцию. Соблюдение её пунктов обезопасит от случайной интоксикации.
Симптомы острого отравления
Степень тяжести состояния пострадавшего зависит от пути попадания вещества, его концентрации, исходного самочувствия человека. Клиника острого отравления анилином характерна для «яда крови».
Симптомы интоксикации лёгкой степени:

- жалобы на головную боль, слабость, недомогание, диспепсию в виде тошноты, рвоты;
- после приёма внутрь — боль в подложечной области;
- при осмотре выявляется синюшность губ, носогубного треугольника, ушных раковин, ногтей — акроцианоз.
Симптомы отравления средней степени:
- жалобы на сильную головную боль, тяжесть и болезненность в правом подреберье;
- изменения поведения — беспокойство, раздражительность, двигательное возбуждение;
- при осмотре — желтушность склер, выраженный акроцианоз;
- двигательные нарушения в виде неустойчивости при ходьбе;
- затруднение дыхания (одышка), усиленное отделение мокроты;
- учащение пульса.
Симптомы острого отравления анилином тяжёлой степени:

- синюшность кожного покрова, слизистых;
- желтушность кожи, склер;
- угнетение сознания до комы;
- развитие судорожного синдрома;
- одышка, учащение или урежение, патологический характер дыхательных движений (поверхностное, неритмичное);
- снижение артериального давления, учащение пульса, невозможность его определить на лучевой артерии;
- отсутствие мочеиспускания.
Синюшность при отравлении анилином имеет характерный оттенок. Его придаёт коричневый цвет метгемоглобина и красно-синеватый тон поражённого эритроцита. Кожа, губы приобретают сине-чёрный цвет.
На фоне нарастающей сердечно-сосудистой и дыхательной недостаточности наступает остановка кровообращения.
Симптомы хронического отравления
 Клинические проявления хронической интоксикации анилином развиваются постепенно и являются неспецифичными по своему характеру. Человека беспокоят головные боли, слабость, быстрое утомление, расстройства сна. Близкие, коллеги отмечают его возросшую раздражительность, снижение внимания, памяти. У пострадавшего наблюдаются симптомы поражения желудочно-кишечного тракта, печени, почек.
Клинические проявления хронической интоксикации анилином развиваются постепенно и являются неспецифичными по своему характеру. Человека беспокоят головные боли, слабость, быстрое утомление, расстройства сна. Близкие, коллеги отмечают его возросшую раздражительность, снижение внимания, памяти. У пострадавшего наблюдаются симптомы поражения желудочно-кишечного тракта, печени, почек.
Появляются шаткость походки, мышечные подёргивания. Характерны признаки расстройства зрительного аппарата — утомляемость глаз, светобоязнь, снижение остроты зрения. Возможно, образование сыпи на коже.
Симптомы не угрожают жизни, но при отсутствии лечения приводят к глубокой инвалидизации.
Первая помощь при остром отравлении
После прекращения вдыхания анилина или контакта с реагентами его содержащими, метгемоглобин в крови начинает распадаться. Восстанавливается транспорт кислорода к тканям, устраняется причина интоксикации.
При остром отравлении анилином, важна правильная последовательность оказания первой помощи. Её необходимо начинать с прекращения поступления яда в организм:
- устранить источник;
- проветрить помещение;
- снять загрязнённую одежду;
- если состояние пострадавшего позволяет — перенести его в безопасное место.
Мероприятия первой помощи при остром отравлении анилином:
- обратиться к медицинским специалистам (служба «скорой помощи», фельдшер здравпункта);
- промыть чистой водой глаза, прополоскать рот;
- при угнетении сознания нельзя поить, давать таблетки, пытаться промывать желудок;
- до приезда медицинских специалистов наблюдать за сознанием пострадавшего, его дыханием и частотой пульса;
- при развитии терминального состояния проводить сердечно-лёгочную реанимацию.
При суицидальных попытках с использованием нейролептиков, содержащих анилин, промывание желудка можно проводить только в случае ясного сознания и удовлетворительного состояния. То есть, практически сразу после приёма препаратов. При их всасывании снижается артериальное давление, угнетается кашлевой рефлекс, сознание. Манипуляция может осложниться аспирацией желудочного содержимого (затекание в дыхательные пути), развитием острой сердечной и сосудистой недостаточности.
Лечение
Диагностика отравления анилином проводится на основании сбора анамнеза, клинического обследования, результатов лабораторного и аппаратного исследования.
Кроме стандартных анализов, проверяют уровень фракции метгемоглобина (FMetHb) в сыворотке крови. Он присутствует в здоровом организме как продукт метаболизма, в количестве не более 1,0–1,5% от общего гемоглобина (Hb). При отравлениях симптомы появляются при значениях больше 3% FMetHb.
 Принципы лечения острого отравления анилином, следующие:
Принципы лечения острого отравления анилином, следующие:
- внутривенное введение антидота — метиленовый синий, аскорбиновая кислота, тиосульфат натрия;
- инфузионная терапия солевыми растворами;
- диуретики (мочегонные препараты);
- коррекция функции дыхания — в зависимости от показаний перевод на искусственную вентиляцию лёгких;
- методы эфферентной детоксикации — гемодиализ, гемосорбция;
- гипербарическая оксигенация для восстановления транспорта кислорода;
- мониторинг артериального давления, частоты сердечных сокращений, ЭКГ, температуры тела, диуреза, лабораторных анализов.
Интенсивная терапия проводится в условиях отделения анестезиологии-реанимации.
При подозрении на хроническое отравление анилином необходимо обратиться к врачу и пройти обследование. Анализы фракций гемоглобина доступны в амбулаторных условиях.
Последствия отравления
Интоксикация анилином опасна не только в острой, но и хронической форме. При длительном его воздействии на организм человека развиваются:
- осложнения со стороны центральной и периферической нервной системы, печени, почек, селезёнки, сердца, лёгких, желудочно-кишечного тракта;
- нарушения функций зрительного аппарата;
- дерматиты;
- анемия.
Канцерогенность анилина и его соединений для человека не доказана. Такие результаты получены только при исследованиях на лабораторных животных.
Симптомы анилиновой интоксикации неспецифичны. Избежать последствий хронического отравления поможет регулярное прохождение медицинских осмотров, предусмотренное федеральным законодательством.
Профилактика отравлений
Анилин относится к веществам II класса опасности — ГОСТ 12.1.005. Предельно допустимая концентрация (ПДК) в воздухе производственных помещений — 0,1 мг/м3.
Техника безопасности при работе с анилином предусматривает:

- использование средств индивидуальной защиты — костюма, перчаток, маски, очков;
- оборудование производственных помещений приточно-вытяжной вентиляцией;
- регулярное забор анализов воздуха в рабочих зонах;
- запрещение курения и питания в рабочих помещениях;
- соблюдение требований пожарной и взрывоопасности.
При сжигании анилина в воздух попадают токсичные или едкие пары — аммиак, оксиды азота, а также горючие пары, которые тоже могут вызвать отравление.
Работая в домашних условиях с анилиновыми красителями, необходимо следить за самочувствием. При появлении тревожных симптомов важно сразу же проветрить помещение или покинуть его.
Подводим итоги. Анилин — это органическое соединение, нашедшее применение в разных сферах промышленности. В лечебных дозах он входит в состав лекарственных препаратов. История использования анилина неразрывно связана с изучением признаков отравления этим сильнодействующим ядом. Чаще всего он попадает в организм через дыхательные пути. При своевременном прекращении контакта с токсином прогноз заболевания значительно улучшается. Избежать отравления можно, предприняв несложные меры безопасности.
Первая помощь при отравлен
