Что такое водородная связь какие свойства спиртов обусловлены ее образованием

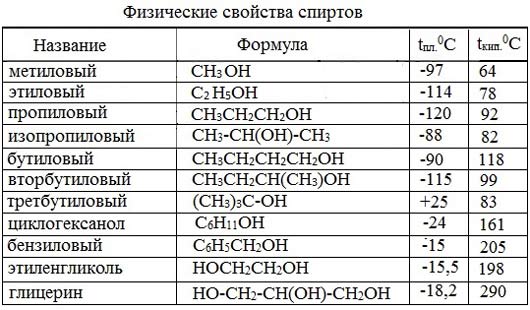
Метиловый спирт (метанол, карбинол, древесный спирт) – простейший одноатомный спирт, бесцветная жидкость (tкип= 64,5; tпл= -97; ρ= 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде, горюч. Пары метанола взрывоопасны. Пары метанола взрывоопасны. Сильный яд!
Метанол вызывает слепоту (достаточно 10 мл). При употреблении внутрь 70 мл и более наступает летальный исход. Смерть наступает от паралича верхних дыхательных путей.
Действие метанола на организм

Этиловый спирт (этанол, винный спирт) – бесцветная жидкость, с запахом спирта, хорошо смешивается с водой, ядовитое наркотическое вещество. Кипит при 78,30С, замерзает при -1140С. Горит слабо светящимся пламенем. В виде ректификата (спирта, очищенного перегонкой) он содержит 95,6 % спирта и 4,4% воды.
Винный спирт – исторически сложившееся название, которое отражает, что этанол является основным компонентом винной продукции.
Этиловый спирт разрушает кровеносную, нервную, пищеварительную системы. Вызывает сильное привыкание и деградацию личности. При употреблении 300 мл, в перерасчете на чистый спирт, может вызвать смертельный исход.
Так как метанол и этанол фактически не отличить друг от друга, то большинство отравления суррогатным алкоголем связано с употреблением продукции, содержащей метиловый спирт вместо этилового.
Действие этанола на организм
А знаете ли вы?
Одноатомным спиртом является и холестерин. Его еще называют холестеролом. Холестерин – компонент желчи, играет важную роль в организме, из него синтезируются многие биологически активные соединения. Он участвует в обмене желчных кислот, в синтезе гормонов коры надпочечников и половых желез. Отложение холестерина на стенках сосудов приводит к атеросклерозу, а в желчном пузыре – к образованию желчных камней.
Низшие члены ряда предельных одноатомных спиртов, содержащие от одного до десяти атомов углерода, — жидкости. Высшие спирты (начиная с С11Н23ОН) при комнатной температуре — твёрдые вещества. Все алканолы легче воды, бесцветны. Низшие спирты имеют характерный алкогольный запах и жгучий вкус. 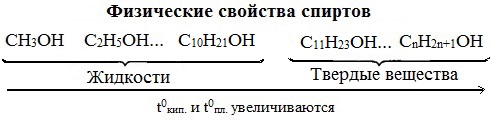
Полярность связи О-Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
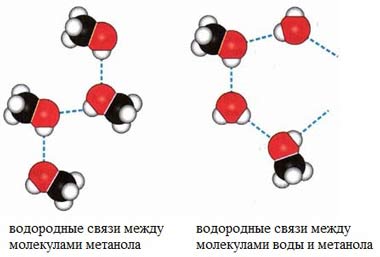
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.
Ассоциация молекул R-OH
Из-за способности образовывать водородные связи в гомологическом ряду спиртов нет газообразных веществ.
В водных растворах водородные связи образуются не только между молекулами спиртов, но также между молекулами спиртов и воды. Образованием водородных связей между молекулами спирта и воды объясняется их хорошая растворимость в воде.
Гидратация молекул R-OH
Водородные связи не прочны и при испарении спиртов легко разрываются.
Видеоопыт «Физические свойства спиртов»
С увеличением углеводородного радикала растворимость спиртов в воде уменьшается. Высшие спирты практически нерастворимы в воде. Метиловый, этиловый, н-пропиловый, изопропиловый спирты, а также этиленгликоль и глицерин смешиваются с водой в любых отношениях. Растворимость фенола в воде ограничена.
Предельные одноатомные спирты
Источник
Модуль I
Тема занятия: “Многоатомные алифатические и ароматические спирты. Полиамины. Аминоспирты.”
Цель занятия:изучение номенклатуры, классификации, строения, и химических свойств спиртов и фенолов, аминов и аминоспиртов.
Студент должен знать:
– классификацию спиртов, фенолов и аминов;
– номенклатуру спиртов, фенолов и аминов;
– строение спиртов, фенолов, аминов и аминоспиртов;
– химические свойства спиртов, фенола, аминов и аминоспиртов.
Студент должен уметь:
– называть по заместительной номенклатуре спирты, фенолы, амины и аминоспирты;
– сравнивать по кислотности спирты, по основности амины;
– сравнивать реакционную способность одноатомных и многоатомных спиртов, алифатических и ароматических (фенолов) спиртов, алифатических и ароматических аминов.
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов Н замещены на –ОН группу.
Классификация спиртов
I. По количеству групп ОН различают: одноатомные, двухатомные и многоатомные спирты:
СН3-СН2-ОН
Этанол Этиленгликоль Глицерин
II. По характеру углеводородного радикала различают:
· предельные СН3-СН2-ОН – этанол
· непредельные СН2 = СН-СН2-ОН – пропен-2-ол
· циклические
циклогексанол
· ароматические
бензиловый спирт
Гомологический ряд одноатомных спиртов.
Первым членом гомологического ряда спиртов является метанол Н3С – ОН, каждый последующий член гомологического ряда отличается на группу СН2 (гомологическую разницу)
| Формула спирта | Название по радикало-функциональной номенклатуре | Название по заместительной номенклатуре |
| СН3ОН | метиловый спирт | метанол |
| С2Н5ОН | этиловый спирт | этанол |
| С3Н7ОН | пропиловый спирт | пропанол |
| С4Н9ОН | бутиловый спирт | бутанол |
| С5Н11ОН | амиловый спирт | пентанол |
| С6Н13ОН | гексиловый спирт | гексанол |
Радикало-функциональная и заместительная номенклатуры спиртов.
Название спиртов по заместительной номенклатуре ИЮПАК образуется от названия соответствующих алканов прибавлением окончания «ол»; по радикало – функциональной номенклатуре название образуется от названия соответствующего радикала с добавлением окончания «-овый спирт».
Нумерация главной цепи начинают с того конца, ближе к которому находится группа ОН.
В зависимости от того, при каком атоме углерода находится гидроксильная группа, различают первичные (пропанол-1), вторичные (пропанол-2) и третичные (2-метилпропанол-2) спирты.
пропанол-1 пропанол-2 2-метилпропанол-2
Изомерия спиртов.
Для спиртов характерна структурная изомерия:
· Изомерия углеродной цепи;
бутанол-1 2-метилпропанол-1
· Изомерия положения функциональной группы.
пропанол-1 пропанол-2
Физические свойства спиртов. Водородная связь.
Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества. Отсутствие газообразных спиртов объясняется способностью молекул к образованию межмолекулярных водородных связей. Первые представители спиртов (метанол, этанол, пропанол) смешиваются с водой в любых соотношениях за счет образования водородной связи с молекулами воды. С ростом молекулярной массы растворимость спиртов в воде резко падает. Высшие спирты практически нерастворимы в воде.
Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и неприятный. Высшие спирты практически не имеют запаха, а третичные спирты обладают неприятным запахом плесени.
Спирты обладают аномально высокими температурами кипения по сравнению с алканами, тиолами простыми эфирами. Эти различия объясняются наличием межмолекулярных связей в молекулах спиртов.
Механизм образования межмолекулярных связей.
Атом кислорода в молекуле спирта обладает большой электроотрицательностью и оттягивает на себя электронную плотность от атома водорода. при этом на атоме водорода возникает δ+, а на атоме кислорода δ-. Поэтому атом водорода электростатически притягивается к атому кислорода другой молекулы и между ними возникает водородная связь. Молекулы связанные между собой водородными связями, образуют ассоциаты.
Образование ассоциатов как бы увеличивает массу спирта и понижает его летучесть. Для разрыва этих связей требуется дополнительная энергия, этим и объясняется высокие температуры кипения.
Наибольшую склонность к образованию водородных связей проявляют первичные спирты. Для вторичных и особенно третичных спиртов способность к ассоциации снижается, так как образованию водородных связей препятствуют разветвленные углеводородные радикалы.
Строение спиртов.
Строение молекулы спирта
СН-кислотный Nu центр
центр
СН3 ® СН2 ® О Н
Электрофильный Центр Кислотный
центр основности центр
Химические свойства спиртов обусловлены их электронным строением.
В молекуле спирта кислород как более электроотрицательный атом тянет на себя электронную плотность от углеводородного радикала и от водорода. при этом связь С – О и О – Н поляризуется и на атомах углерода и водорода возникают δ+, а на атоме кислорода δ-. Полярность связи О – Н определяет её склонность к гетеролитическому разрыву. Атом водорода становится более подвижным и способен отщепляться в виде Н+. Следовательно, спирты проявляют свойства ОН-кислот. В то же время у кислорода имеется неподелённая донорная электронная пара и спирты проявляют основные свойства. Поэтому можно сказать, что спирты являются амфотерными соединениями.
За счет поляризации связи С – О возможен гетеролитический разрыв и для спиртов возможны реакции нуклеофильного замещения (SN). Они, как правило, идут в кислой среде, т.к. протонирование атома кислорода увеличивает d+
Химические свойства
I. Кислотно-оснóвные свойства. Спирты – слабые амфотерные соединения.
1. Взаимодействие с натрием (кислотные свойства)
2С2H5–ОН + 2Nа ® 2 С2H5–ОNа + Н2
этилат натрия
Алкоголяты легко гидролизуются, что показывает – спирты более слабые кислоты, чем вода:
С2H5– ОNа + НОН ® С2H5–ОН + NаОН
2. Взаимодействие с сильной кислотой НС1 (основные свойства). Оснóвным центром в спиртах является атом О, обладающий неподелённой парой электронов. При действии на спирты сильными кислотами происходит присоединение Н+ к атому кислорода группы ОН и образуется неустойчивый алкилоксониевый ион:
Этилоксоний хлорид
II. Реакции SNпо гр. –ОН
Гр. -ОН является плохоуходящей группой (связь мало полярна), поэтому большинство реакций проводят в кислой среде. Механизм р-ции:
СН3-СН2-ОН + Н+ ® СН3-СН2- -Н ® СН3-СН2+ + Н2О
1. Взаимодействие с галогеноводородами:
Если реакция идет с галогеноводородами, то присоединяться будет галогенид-ион: СН3-СН2 – ОН + НСl ® СН3-СН2Сl + Н2О
2. Реакция алкилирования (введение алкила R в молекулу).
Заместить –ОН гр. на галоген можно при действии РСl3, РСl5 и SОСl2, например:
С2Н5ОН + РСl5 → С2Н5Сl + HCl + POCl3
С2Н5ОН + SOСl2 → С2Н5Сl + HCl + SO2
По такому механизму легче реагируют третичные спирты.
III. Реакции SЕ .
К ним относятся реакции взаимодействия спиртов с органическими и минеральными кислотами с образованием сложных эфиров:
1. Взаимодействие с уксусной кислотой.
С2H5 – О Н + Н О – СН3 – О – + Н2О
этиловый эфир уксусной кислоты
2.
С2H5 – О Н + Н О – NО2 С2H5 – О –NО2 + Н2О
Взаимодействие с азотной кислотой:
этилнитрат
IV. Реакции Е (отщепления, или элиминирования)
Эти реакции конкурируют с реакциями SN.
СН3-СН2-ОН + Н+ СН3-СН2- -Н СН3-СН2+
При избытке Н2SО4 и более высокой температуре, чем в случае реакции образования простых эфиров, идет регенерация катализатора и образуется алкен:
СН3-СН2+ + НSО4- ® СН2 = СН2 + Н2SО4
Легче идет реакция SE для третичных спиртов, труднее для вторичных и первичных, т.к. в последних случаях образуется менее стабильные катионы. В данных реакциях выполняется правило А. Зайцева: «При дегидратации спиртов атом Н отщепляется от соседнего атома С с меньшим содержанием атомов Н».
СН3-СН = СН -СН3
Бутанол-2 бутен – 2
В организме гр. –ОН превращается в легкоуходящую путем образования эфиров с Н3РО4:
СН3-СН2-ОН + НО–РО3Н2 СН3-СН2-ОРО3Н2
V. Реакции окисления
1. Первичные и вторичные спирты окисляются СuО, растворами КМnО4, К2Сr2О7 при нагревании с образованием соответствующих карбонилсодержащих соединений:
СН3-СН2- -ОН + О СН3-CH2- -ОН СН3-СН2- -Н
СН3 – – СН3 + О СН3- – СН3 СН3- СН3
Ацетон (кетон)
5CH3OH + 6KMnO4 + 9H2SO4 → 5CO2↑ + 6MnSO4 + K2SO4 + 19H2O
5C2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
Окисление спиртов под действием дихроматов натрия или калия является качественной реакцией. В результате взаимодействия спирт окисляется, а дихромат – ион восстанавливается до Cr+3, в результате чего оранжевое окрашивание переходит в сине-зеленое.
Cr2O72- + 14H+ + 6 ẻ → 2Cr3+ + 7H2O
оранжевый сине-зеленый
на холоду протекает реакция по уравнению:
3С2Н5ОН + 2K2Cr2O7 + 8H2SO4 → 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
При нагревании:
3С2Н5ОН + K2Cr2O7 + 4H2SO4 → 3CH3COH + Cr2(SO4)3 + K2SO4 + 6H2O
2. Третичные спирты окисляются с трудом.
К реакциям окисления относятся и реакции дегидрирования:
СН3 – – ОН СН3 – = О + Н2
3. Спирты горят: С2Н6О + 2О2 → 2СО2 + 3Н2О
VI. По радикалу (R) протекают реакции, характерные для соответствующих углеводородов (УВ). В случае предельных – SR, непредельных – АN, ароматических – SЕ:
1. Реакции по α- углеродному атому с галогенами:
СН3-СН2-ОН + 3Вr2 СВr3-СН2-ОН + 3НВr
Этанол Нарколан
2. Реакции с галогенами в непредельных спиртах:
СН2 = СН-СН2-ОН + Вr2 СН2 Вr–СНВr–СН2ОН
Аллиловый спирт 2,3- Дибромпропанол
3. Реакции по ароматическому кольцу:
Бензиловый спирт n-Нитрофенилметанол
Многоатомные спирты
Многоатомные спирты можно рассматривать как производные углеводородов, в которых несколько атомов водорода замещены на группы ОН.
Двухатомные спирты, называются диолами или гликолями, трехатомные – триолы или глицерины.
Названия многоатомных спиртов образуются по общим правилам номенклатуры ИЮПАК. Представителями многоатомных спиртов являются:
этандиол-1,2 пропантриол-1,2,3
Этиленгликоль глицерин
Источник
Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества. Отсутствие газообразных спиртов объясняется способностью молекул к образованию межмолекулярных водородных связей. Первые представители спиртов (метанол, этанол, пропанол) смешиваются с водой в любых соотношениях за счет образования водородной связи с молекулами воды. С ростом молекулярной массы растворимость спиртов в воде резко падает. Высшие спирты практически нерастворимы в воде.
Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и неприятный. Высшие спирты практически не имеют запаха, а третичные спирты обладают неприятным запахом плесени.
Спирты обладают аномально высокими температурами кипения по сравнению с алканами, тиолами простыми эфирами. Эти различия объясняются наличием межмолекулярных связей в молекулах спиртов.
Механизм образования межмолекулярных связей.
Атом кислорода в молекуле спирта обладает большой электроотрицательностью и оттягивает на себя электронную плотность от атома водорода. при этом на атоме водорода возникает δ+, а на атоме кислорода δ-. Поэтому атом водорода электростатически притягивается к атому кислорода другой молекулы и между ними возникает водородная связь. Молекулы связанные между собой водородными связями, образуют ассоциаты.
Образование ассоциатов как бы увеличивает массу спирта и понижает его летучесть. Для разрыва этих связей требуется дополнительная энергия, этим и объясняется высокие температуры кипения.
Наибольшую склонность к образованию водородных связей проявляют первичные спирты. Для вторичных и особенно третичных спиртов способность к ассоциации снижается, так как образованию водородных связей препятствуют разветвленные углеводородные радикалы.
Строение спиртов.
Строение молекулы спирта
СН-кислотный Nu центр
центр
СН3 ® СН2 ® О Н
Электрофильный Центр Кислотный
центр основности центр
Химические свойства спиртов обусловлены их электронным строением.
В молекуле спирта кислород как более электроотрицательный атом тянет на себя электронную плотность от углеводородного радикала и от водорода. при этом связь С – О и О – Н поляризуется и на атомах углерода и водорода возникают δ+, а на атоме кислорода δ-. Полярность связи О – Н определяет её склонность к гетеролитическому разрыву. Атом водорода становится более подвижным и способен отщепляться в виде Н+. Следовательно, спирты проявляют свойства ОН-кислот. В то же время у кислорода имеется неподелённая донорная электронная пара и спирты проявляют основные свойства. Поэтому можно сказать, что спирты являются амфотерными соединениями.
За счет поляризации связи С – О возможен гетеролитический разрыв и для спиртов возможны реакции нуклеофильного замещения (SN). Они, как правило, идут в кислой среде, т.к. протонирование атома кислорода увеличивает d+
Химические свойства
I. Кислотно-оснóвные свойства. Спирты – слабые амфотерные соединения.
1. Взаимодействие с натрием (кислотные свойства)
2С2H5–ОН + 2Nа ® 2 С2H5–ОNа + Н2
этилат натрия
Алкоголяты легко гидролизуются, что показывает – спирты более слабые кислоты, чем вода:
С2H5– ОNа + НОН ® С2H5–ОН + NаОН
2. Взаимодействие с сильной кислотой НС1 (основные свойства). Оснóвным центром в спиртах является атом О, обладающий неподелённой парой электронов. При действии на спирты сильными кислотами происходит присоединение Н+ к атому кислорода группы ОН и образуется неустойчивый алкилоксониевый ион:
Этилоксоний хлорид
II. Реакции SNпо гр. –ОН
Гр. -ОН является плохоуходящей группой (связь мало полярна), поэтому большинство реакций проводят в кислой среде. Механизм р-ции:
СН3-СН2-ОН + Н+ ® СН3-СН2- -Н ® СН3-СН2+ + Н2О
1. Взаимодействие с галогеноводородами:
Если реакция идет с галогеноводородами, то присоединяться будет галогенид-ион: СН3-СН2 – ОН + НСl ® СН3-СН2Сl + Н2О
2. Реакция алкилирования (введение алкила R в молекулу).
Заместить –ОН гр. на галоген можно при действии РСl3, РСl5 и SОСl2, например:
С2Н5ОН + РСl5 → С2Н5Сl + HCl + POCl3
С2Н5ОН + SOСl2 → С2Н5Сl + HCl + SO2
По такому механизму легче реагируют третичные спирты.
III. Реакции SЕ .
К ним относятся реакции взаимодействия спиртов с органическими и минеральными кислотами с образованием сложных эфиров:
1. Взаимодействие с уксусной кислотой.
С2H5 – О Н + Н О – СН3 – О – + Н2О
этиловый эфир уксусной кислоты
2.
С2H5 – О Н + Н О – NО2 С2H5 – О –NО2 + Н2О
Взаимодействие с азотной кислотой:
этилнитрат
IV. Реакции Е (отщепления, или элиминирования)
Эти реакции конкурируют с реакциями SN.
СН3-СН2-ОН + Н+ СН3-СН2- -Н СН3-СН2+
При избытке Н2SО4 и более высокой температуре, чем в случае реакции образования простых эфиров, идет регенерация катализатора и образуется алкен:
СН3-СН2+ + НSО4- ® СН2 = СН2 + Н2SО4
Легче идет реакция SE для третичных спиртов, труднее для вторичных и первичных, т.к. в последних случаях образуется менее стабильные катионы. В данных реакциях выполняется правило А. Зайцева: «При дегидратации спиртов атом Н отщепляется от соседнего атома С с меньшим содержанием атомов Н».
СН3-СН = СН -СН3
Бутанол-2 бутен – 2
В организме гр. –ОН превращается в легкоуходящую путем образования эфиров с Н3РО4:
СН3-СН2-ОН + НО–РО3Н2 СН3-СН2-ОРО3Н2
V. Реакции окисления
1. Первичные и вторичные спирты окисляются СuО, растворами КМnО4, К2Сr2О7 при нагревании с образованием соответствующих карбонилсодержащих соединений:
СН3-СН2- -ОН + О СН3-CH2- -ОН СН3-СН2- -Н
СН3 – – СН3 + О СН3- – СН3 СН3- СН3
Ацетон (кетон)
5CH3OH + 6KMnO4 + 9H2SO4 → 5CO2↑ + 6MnSO4 + K2SO4 + 19H2O
5C2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
Окисление спиртов под действием дихроматов натрия или калия является качественной реакцией. В результате взаимодействия спирт окисляется, а дихромат – ион восстанавливается до Cr+3, в результате чего оранжевое окрашивание переходит в сине-зеленое.
Cr2O72- + 14H+ + 6 ẻ → 2Cr3+ + 7H2O
оранжевый сине-зеленый
на холоду протекает реакция по уравнению:
3С2Н5ОН + 2K2Cr2O7 + 8H2SO4 → 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
При нагревании:
3С2Н5ОН + K2Cr2O7 + 4H2SO4 → 3CH3COH + Cr2(SO4)3 + K2SO4 + 6H2O
2. Третичные спирты окисляются с трудом.
К реакциям окисления относятся и реакции дегидрирования:
СН3 – – ОН СН3 – = О + Н2
3. Спирты горят: С2Н6О + 2О2 → 2СО2 + 3Н2О
VI. По радикалу (R) протекают реакции, характерные для соответствующих углеводородов (УВ). В случае предельных – SR, непредельных – АN, ароматических – SЕ:
1. Реакции по α- углеродному атому с галогенами:
СН3-СН2-ОН + 3Вr2 СВr3-СН2-ОН + 3НВr
Этанол Нарколан
2. Реакции с галогенами в непредельных спиртах:
СН2 = СН-СН2-ОН + Вr2 СН2 Вr–СНВr–СН2ОН
Аллиловый спирт 2,3- Дибромпропанол
3. Реакции по ароматическому кольцу:
Бензиловый спирт n-Нитрофенилметанол
Многоатомные спирты
Многоатомные спирты можно рассматривать как производные углеводородов, в которых несколько атомов водорода замещены на группы ОН.
Двухатомные спирты, называются диолами или гликолями, трехатомные – триолы или глицерины.
Названия многоатомных спиртов образуются по общим правилам номенклатуры ИЮПАК. Представителями многоатомных спиртов являются:
этандиол-1,2 пропантриол-1,2,3
Этиленгликоль глицерин
Источник
