H2o2 какие свойства проявляет

Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Ничто не красит женщину так, как перекись водорода (Народная мудрость)
Мальчики и девочки, папы и мамы, бабушки и дедушки, химички и химичи, составители и эксперты ЕГЭ (особенно!) читайте внимательно серию статей об участии пероксида водорода в ОВР. Иначе, на ЕГЭ может случиться конфуз, когда вы не сможете написать реакции в 30-м и 32-м заданиях, не решится 34-я задача, будут непонятны многие реакции в тестовых заданиях типа 8, 9, 10, 14, 17, 21.
Химический портрет пероксида водорода
Пероксид водорода H2O2 – химическое соединение водорода с кислородом. Структурная формула Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом. Связь это непрочна и обусловливает неустойчивость молекулы. Чистый пероксид водорода разлагается (со взрывом) на воду и кислород. В разбавленных водных растворах пероксид водорода более устойчив.
► Впервые пероксид водорода получил в 1818 г. французский химик Л.Ж. Тенар, действуя охлажденной соляной кислотой на пероксид бария
BaO2 + 2HCl → BaCl2 + H2O2
Пероксид бария получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария
BaCl2 + Ag2SO4 → 2AgCl↓ + BaSO4↓
Чтобы не использовать дорогую соль серебра в последующем для получения Н2О2 использовали серную кислоту, поскольку при этом сульфат бария остается в осадке, поскольку карбонат бария также нерастворим
BaO2 + H2SO4 → BaSO4↓ + H2O2
Атом кислорода в пероксиде водорода имеет степень окисления (-1), поэтому в окислительно-восстановительных реакциях пероксид может выполнять функцию как окислителя, так и восстановителя
► Пероксид водорода – сильный окислитель, легко отдает атом кислорода. При действии безводной и концентрированной Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются.
Обратите внимание! Если пероксид – окислитель, то продуктом восстановления кислорода будет вода (Н2О). На шкале степеней окисления окислитель “падает вниз”
► H2O2 обладает свойствами слабого восстановителя.
Обратите внимание! Если пероксид – восстановитель, то продуктом его окисления будет свободный кислород (О2). На шкале степеней окисления восстановитель “поднимается вверх”
В следующих статьях вас ожидает много ОВР с пероксидом водорода. Это будут не только классические, но и нестандартные, очень сложные реакции, вызывающие дрожь даже у мудрых экспертов ЕГЭ. Я проведу анализ каждой реакции и обязательно научу вас писать все уравнения ОВР. Со мной не пропадете! Если будете внимательно читать статьи, работать над заданиями и выполнять все рекомендации – высокий балл на ЕГЭ будет вам заслуженной наградой!
Вы не умеете писать ОВР методом полуреакций?! Спокойствие, только спокойствие! Самый лучший в мире репетитор в полном расцвете сил поможет вам! Заходите ко мне на сайт, посетите страницу “Окислительно-восстановительные реакции”. И будет вам счастье!
А пока – пока! Успехов и удачи! До встречи на полях Яндекс Дзен! Не забывайте подписаться на канал и поставить лайк!
Вы хотите сдавать ЕГЭ по химии и биологии? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Пишите мне в WhatsApp +7(903)186-74-55, я отвечу вам обязательно.
Репетитор по химии и биологии кбн В.Богунова
Источник
Пероксид водорода
Пероксид водорода (перекись водорода), H2O2 – простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2 • 2H2O.
Строение молекулы
Молекула Н2O2 содержит в своем составе пероксидный анион O2-2 . Каждый атом кислорода образует 2 ковалентные связи, но имеет степень окисления, равную -1. В упрощенном виде строение молекулы отражает графическая формула:
H+1-O-1-O-1-H+1
Физические свойства
В чистом безводном виде Н2O2 – бесцв. сиропообразная жидкость с плотностью 1,45 г/см3 (т. пл. -0,41°С, т. кип. 150,2°С). Смешивается с водой в любых соотношениях, растворяется также в спирте, эфире. 30%-ный р-р Н2O2 называют пергидролем. Подобно воде, Н2O2 – хороший полярный растворитель, в котором вещества с ионной и полярной ковалентной связью диссоциируют на ионы.
Химические свойства
Разложение Н2O2 (диспропорционирование)
2Н2O2 = 2Н2O + O2↑
2O-1 – 2e- → O20
2O-1 +2e- → 2О-2
При Т > 90° С пероксид водорода разлагается практически полностью. Причиной непрочности молекул Н2O2 является неустойчивость атома кислорода в степепени окисления -1.
Н2O2 – слабая кислота
Молекулы Н2O2 в незначительной степени диссоциируют в водном растворе по схеме:
Н2O2 = Н+ + HO2-
(Кдисс = 1,5 * 10-12 при 20°С)
Кислотные свойства проявляются в реакциях со щелочами с образованием солей – средних (пероксидов) и кислых (гидропероксидов), например:
Н2O2 + Ва(ОН)2 = ВаO2 + 2Н2O
пероксид бария
Гидролиз пероксидов металлов
Хотя по составу пероксиды напоминают оксиды, они на самом деле обладают свойствами солей. В водных растворах полностью гидролизуются с выделением Н2O2:
К2O2 + 2Н2O = 2КОН + Н2O2
Получение Н2O2 из пероксидов металлов
Так как Н2O2 – очень слабая кислота, то она вытесняется из своих солей как сильными кислотами, так и слабыми, например:
ВаO2 + H2SO4 = Н2O2 + BaSO4↓
ВаO2 + СO2 + Н2O = Н2O2 + ВаСO3↓
Н2O2 сильный окислитель
Атомы кислорода, находящиеся в неустойчивой степени окисления -1, стремятся приобрести еще один электрон для перехода в устойчивое состояние. Поэтому пероксид водорода проявляет очень сильные окислительные свойства, особенно в кислой среде:
Н2O-2 + 2H+ + 2e- → 2Н2O-2
Окисление неорганических веществ
Примеры:
ЗН2O2 + 2NH3 = N2 + 6Н2O
4Н2O2 + H2S = H2SO4 + 4Н2O
Н2O2 + 2HI = I2 + 2Н2O
4Н2O2 + PbS = PbSO4 + 4Н2O
ЗН2O2 + 2СrСl3 + 10КОН = 2К2СrO4 + 6KCl + 8Н2O
Н2O2 + 2FeSO4 + H2SO4 = Fe2(SO4)3 + 2Н2O
Окисление органических веществ
Конц. водные растворы Н2O2 в смеси с органическими веществами способны к воспламенению и взрыву при ударе. Например, органические кислоты окисляются до СO2 и Н2О(как при горении в O2):
4Н2O2 + CH3COOH = 2CO2↑ + 6Н2O
Н2O2 + Н2С2O4 = 2СO2↑ + 2Н2O
Пероксиды щел. Me – очень сильные окислители
Окисляют многие неорганические и органические вещества, например:
4Na2O2 + СН3СООН = 2Na2CO3 + 4NaOH
Na2O2 + SO2 = Na2SO4
Важной реакцией является диспропорционирование пероксида Na при взаимодействии с углекислым газом:
2Na2O2 + 2СO2 = 2Na2CO3 + O2↑
На этой реакции основано использование Na2O2 в автономных дыхательных аппаратах и в замкнутых помещениях для поглощения СO2 и образования O2.
Н2O2 – слабый восстановитель (в реакциях с очень сильными окислителями)
Окисление пероксида водорода обычно протекает по схеме:
2Н2O-2 – 2e- → O02↑ + 2H+
Примеры реакций:
5Н2O2 + 2КМnO4 + 3H2SO4 = 5O2↑ + 2MnSO4 + K2SO4 + 8Н2O
ЗН2O2 + К2Сr2O7 + 4H2SO4 = 3O2↑ + Cr2(SO4)3 + K2SO4 + 7Н2O
3Н2O2 + KClO3 = 3O2↑ + KCl + 3Н2O
3Н2O2 + 2AuCl3 = 3O2↑ + 2Au + 6HCl
Источник

Строение молекулы и физические свойства
Перекись водорода относится к простейшим представителям группы пероксидов. Её получают в промышленности и лаборатории несколькими способами. Структурная формула перекиси водорода обозначается H2O2. Степень окисления у атомов кислорода -1.
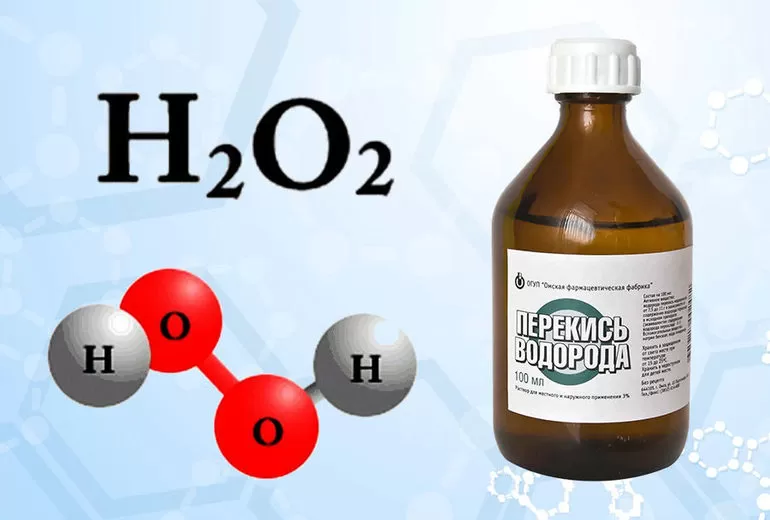
Молекула вещества представлена двумя OH-группами, которые связаны пероксидным -О-О-мостиком и лежат в разных плоскостях. Угол между ними меняется в зависимости от температуры, концентрации раствора и других условий.
Пероксид представлен в виде бесцветной жидкости с «металлическим» вкусом и специфическим запахом. Вязкая консистенция обусловлена развитой системой водородных связей в молекулярной структуре.
Основные физические свойства перекиси водорода:
- Температура кипения: 150,2°C.
- Температура замерзания: -0,432°C.
- Плотность: 1,46 г/см3.
Молекула вещества является полярной, поскольку её строение несимметричное. Соединение может неограниченно растворяться в воде, эфире и спирте. Чистое вещество неустойчиво и способно самопроизвольно разлагаться со взрывом.
Химические особенности
Поскольку оба атома кислорода находятся в промежуточной степени окисления -1, антисептическое средство может проявлять как окислительные, так и восстановительные свойства. Оно участвует в реакциях окисления нитритов до нитратов и выделении иодов из иодидов металлов. Также вещество может расщеплять ненасыщенные соединения.
Перекись обладает слабыми кислотными свойствами, поэтому она диссоциирует по двум ступеням:
- H2O2↔H++OOH−
- OOH−↔H++O22−
Вещество по степени кислотности немного сильнее H2O. Некоторые пероксиды металлов можно рассматривать как его соли. В кислой среде перекись служит окислителем, а в щелочной — восстановителем.
Реагируя с более сильными окислителями, например, с солями серебра и золота, водород служит восстановителем и окисляется до атомарного кислорода. В реакции с нитритом калия вещество выступает окислителем. Если молекула принимает электрон на внешний уровень, тогда степень окисления кислорода меняется на -2; если она его отдаёт, тогда соединение становится восстановителем. Окисление органических веществ пероксидом обычно проводят в уксусной кислоте.
Способы получения вещества
Сначала пероксид водорода получали в промышленности с помощью электролиза серной кислоты или раствора сульфата аммония в H2SO4. В результате реакции получалась надсерная кислота. После гидролиза вещества образовывались пероксид и серная кислота.
В середине XX века открыли новый способ получения перекиси водорода. Антрахиноновый процесс был разработан компанией BASF. При этом методе водород окисляется кислородом воздуха, после чего образуются антрахиноны и пероксид водорода. Реакцию проводят в растворе алкилантрагидрохинонов в бензоле, который служит катализатором. В него также добавляют вторичные спирты. На завершительной стадии процесса катализатор убирают, а из получившейся смеси продуктов выделяют пероксид водорода путём перегонки при сниженном давлении.
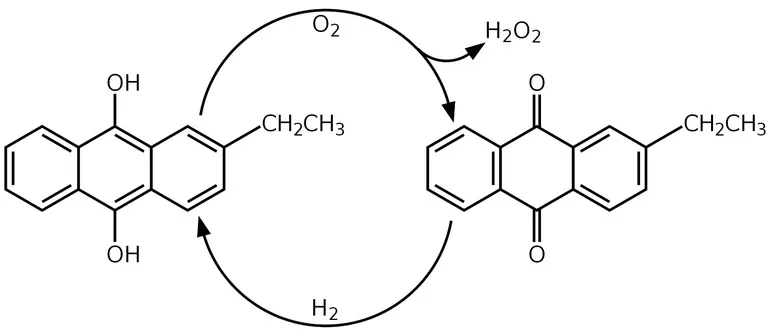
В лабораторных условиях вещество получают с помощью пероксида бария и соляной кислоты. Уравнение взаимодействия соединений: BaO2+2HCl → BaCl2+H2O2. Получившийся хлорид бария осаждают в виде сульфата. Пероксид водорода также можно извлечь при помощи каталитического окисления изопропилового спирта.
В некоторых источниках есть информация, что нужное вещество может образоваться при взаимодействии пероксида бария с серной кислотой, однако такую технологию обычно не используют. Поскольку осадок сульфата бария формируется на зёрнах его пероксида, реагент покрывается нерастворимой оболочкой, которая замедляет реакцию и выход нужного продукта.
Меры предосторожности
Во время работы с концентрированным раствором перекиси необходимо соблюдать меры безопасности. Хотя вещество нетоксично, при попадании в дыхательные пути или на кожный покров и слизистые оно вызывает сильные ожоги. Недостаточно чистый пероксид высокой концентрации может быть взрывоопасен. Всю работу с веществом нужно проводить в «беспылевых» условиях и при отсутствии ионов металлов.
Растворы перекиси водорода относятся к 3-му классу опасности. Вещество может вызывать деструктивные изменения, которые схожи с действием щелочей. Летальная доза пергидроля (название раствора концентрации 30%) составляет 50−100 мл.
Упаковку с аптечным средством необходимо хранить в тёмном месте. При транспортировке нужно избегать встряхивания вещества и других механических воздействий, которые могут привести к его разложению.
Сферы использования
Пероксид водорода может быть разной концентрации. Поскольку растворы обладают различными свойствами, их часто используют в промышленности и быту:
- Вещество применяется при создании бумаги, дезинфицирующих средств и в текстильном производстве в качестве отбеливателя.
- За окислительные свойства пероксид водорода используют как ракетное топливо.
- В аналитической химии при изготовлении пористых материалов средство применяют в качестве пенообразователя.
- В промышленности простейший представитель пероксидов зарекомендовал себя как катализатор и гидрирующий агент.
- В аквариумистике 3%-й раствор помогает очистить резервуары для воды, бороться с паразитами, а также способен оживить задохнувшихся рыб.
- В пищевой промышленности пероксид используется для дезинфекции упаковок для различных напитков и поверхностей оборудования, с которым контактируют продукты.
- В сфере быта средство помогает вывести пятна марганцовки на предметах мебели и текстиле, а также в качестве домашнего антисептика.
Перекись широко используется в области косметологии. Ею обесцвечивают волосы и отбеливают зубы. Поскольку процесс основан на окислении, локоны часто портятся, поэтому вещество не советуют применять обладателям тонких и повреждённых прядей. С зубами не наблюдается дефектов, поскольку с прозрачной эмалью эффект отбеливания достигается за счёт разницы в отражении света дентином.
Применение в области медицины
Широкое применение перекиси водорода нашли в медицине. Средство с бактерицидным механизмом действия предназначено для внешнего использования. Перед применением необходимо тщательно изучить инструкцию к лекарству.
Формы выпуска пероксида водорода:

- Раствор разведённый 1−3%. Применяется для полоскания полости рта и в качестве препарата местного действия.
- Раствор концентрированный 27−31%. Это средство используется редко и только по назначению специалиста. Обычно для обработок его разводят до 3%-го раствора. Лекарство предназначено для лечения заболеваний кожного покрова.
- Гидроперит. Лекарство представлено соединением 35%-го раствора пероксида с карбамидом. Выпускается в форме таблеток. В таком виде препарат легче перевозить и хранить. Чтобы сделать раствор, необходимо растворить в воде 2 таблетки на 100 мл жидкости.
Препаратом лечат гнойные раны и воспалённые слизистые оболочки. Средство используется при носовых и капиллярных кровотечениях, а также для промывки и глубокой очистки ран. Медицинским раствором обрабатывают ротовую полость и горло при ангине, стоматите или тонзиллите. Средство также избавляет кожный покров от пигментных пятен. С помощью лекарства убирают серные пробки при чистке ушей. Препарат применяется в гинекологии для лечения различных женских патологий.
При лёгкой механической очистке ватный тампон смачивают в 3%-м растворе и обрабатывают им поражённые участки кожи. Для компрессов применяют перекись с концентрацией 1 процент. Продолжительность процедуры не должна превышать 30 мин. Для обработки участков кожи с пигментными пятнами используют пергидроль. Ротовую полость или органы половой системы обрабатывают 0,25%-м раствором.
Применение перекиси водорода противопоказано при индивидуальной непереносимости вещества. В редких случаях негативные последствия могут проявиться в жжении во время процедуры и аллергии в виде красных пятен на коже. При длительной терапии после обработок ротовой полости может возникнуть гипертрофия сосочков языка. Если соблюдать дозировку и схему применения перекиси водорода в соответствии с инструкцией, тогда получится избежать побочных действий.
Источник
Перекись водорода (Н2О2) — химическое соединение из группы, включающей пероксиды. Впервые вещество было получено Луи Тенаром в 1818 году путем подкисления раствора перекиси бария азотной кислотой. Это сильный окислитель во многих химических реакциях, таких как окисление ракетного топлива (80%), мощное дезинфицирующее и отбеливающее средство.
Перекись водорода классифицируется как одна из активных форм кислорода. Химическая формула агента состоит из двух атомов водорода и двух атомов кислорода. Благодаря этой структуре молекула под действием органических и неорганических веществ, тепла, света быстро разлагается с выделением атомарного кислорода. Дезинфицирующее действие самой перекиси водорода довольно слабое, но при распаде, оно проявляется быстро и эффективно благодаря свободным атомам кислорода.
Химическая формула перекиси водорода, строение молекулы
Н-О-O-H-связи вокруг атомов кислорода в молекуле H2O2 расположены под углом (аналогично H-O-H-связям в воде), причем атомы H-O-O-H образуют двугранный угол (в твердой фазе около 90°).

Физические свойства пероксида
Чистый пероксид водорода сильно отличается от знакомого всем 3%раствора, который присутствует в каждой в домашней аптечке.
При комнатной температуре он является сиропообразной, бесцветной (концентрированная принимает бледно-голубой цвет), жидкостью с температурой замерзания -0,41 ° С и температурой кипения около 150 ° С. Вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды.
Хорошо растворяется в полярных (органических) растворителях и до любой концентрации — в воде. Имеет металлический привкус. Молярная масса 34,01 г/моль.
Химические свойства
Пероксид обладает сильными окислительными свойствами, возникающими в результате образования атомарного кислорода:
H2O2 → H2O + O
Чистая перекись водорода без стабилизаторов — очень нестабильна и подвергается экзотермическому разложению, часто взрывчатому. Это происходит под воздействием воды, кислорода, под воздействием тепла, при контакте с некоторыми металлами (например, марганцем), оксидами металлов и ультрафиолетом.
2H2O2 → 2H2O + O2
Подобное разложение катализируется многими веществами, например, серебром и платиной, оксидом марганца, соединениями йода:
H2O2 + I → H2O + IO
H2O2 + IO → H2O + I+ O2
Эффективным ферментом, который расщепляет перекись водорода, является каталаза.
Благодаря тому, что пергидроль легко реагирует со многими металлами и разлагается при контакте со светом, его следует хранить в герметично закрытой таре, изготовленной из толстостенного полиэтилена или алюминия, не подвергаться воздействию дневного света и источников тепла. Его смесь с карбонатом гидрата натрия (Na2CO3 · 1,5H2O2) является относительно стабильной и безопасной в использовании.

Перекись водорода имеет слабые кислотные свойства. Слабее угольной кислоты. В водных растворах диссоциирует в соответствии с уравнением:
Н2О2 = Н+ +ООН-
В присутствии восстановителей пероксид водорода ведет себя как окислитель (O-I → O-II), например :
2 NH2OH + 6H2O2 → 2 HNO3 + 8H2O
В присутствии окислителей пероксид показывает восстановительные свойства (O-I → O0), например, в реакции с перманганатом калия в кислых условиях :
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
или с солями серебра (I) в щелочной среде:
2AgNO3 + H2O2 + 2KOH → 2Ag + O2 + 2H2O + 2KNO3
Это агрессивное вещество для живых тканей. При контакте с кожей появляется белый цвет.
Получение — синтез пероксида водорода с использованием метода антрахинона.
В настоящее время hydrogen получают в промышленности методом антрахинона. путем окисления 2-этил-9,10-антрацендиола кислородным газом, прошедшим через раствор этого соединения в смеси подходящих растворителей. Перекись отделяют экстракцией воды и оставляют в растворе.
Этиллантрахинон регенерируют восстановлением газообразным водородом до 2-этил-9,10-антрацендиола, катализируемого палладием на подходящем носителе или соединениях никеля. В методах промышленного производства цикл обеих реакций (окисление и восстановление) осуществляется поочередно.
Разведенный водный раствор перекиси, полученный в этом процессе, концентрируют осторожным выпариванием воды при пониженном давлении, получая таким образом раствор с максимальной концентрацией 70%. Большая концентрация приводит к взрыву. Более концентрированные растворы и полностью чистый пероксид, может быть получен путем быстрого замораживания его из водного концентрированного раствора.
Интересные химические опыты с перекисью водорода — видео:
Водные растворы перекиси водорода и их применение
Перекись водорода в чистом виде не является коммерчески доступным веществом, поскольку законы большинства европейских стран и США запрещают его продажу по соображениям безопасности. В торговле (максимум 70% растворов) это соединение доступно после соблюдения особых условий (правила RID и ADR), а наиболее распространенной коммерческой формой является пергидроль 30% водный раствор и 3-5% растворы для домашнего использования, называемые перекисью водорода.

Перекись в растворе 3-3,5% используется для дезинфекции ран, и такие растворы для непосредственного использования доступны в аптеках. H2O2 оказывает особенно сильное разрушающее действие на анаэробные бактерии (анаэробы).
Дезинфекция раны с использованием перекиси водорода значительно снижает риск попадания бактерий в организм через поврежденный эпидермис. Быстрое уничтожение бактерий во время дезактивации также разрушает клетки крови, вытекающие из раны, а также часть клеток кожи, подвергнутых повреждению.
7-15% растворы обычно используются в качестве так называемых «Активных кислородных отбеливателей» в бытовой химии, 5% водный раствор используется для обесцвечивания волос. Очень разбавленные растворы (прибл. 1%) применяются в народной медицине для перорального применения. До сих пор считаются спорным способом лечения некоторых видов рака.
Источник
