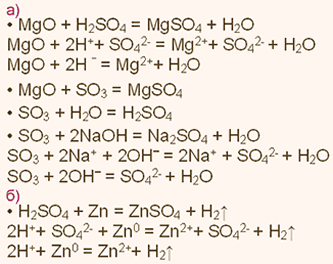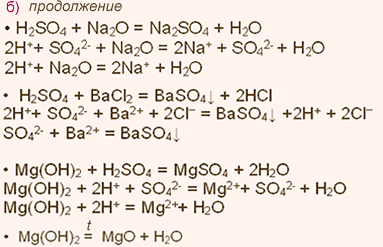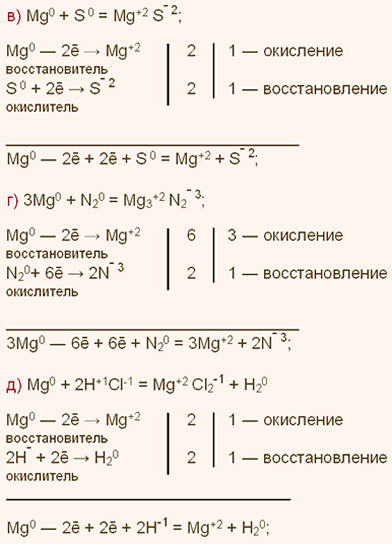Химические свойства какого элемента наиболее похожи на свойства элемента кремния
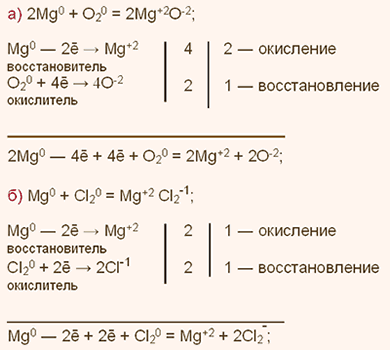
3.6. Зависимость свойств элементов от строения их
атомов
Теория
строения атомов объясняет периодическое изменение свойств элементов при
увеличении порядкового номера.
Важнейшими
свойствами элементов являются металличность
(металлические свойства) и неметалличность
(неметаллические свойства).
Металличность – это
способность атомов элемента отдавать электроны. Количественной характеристикой
металличности элемента является энергия ионизации.
Энергия
ионизации атома
– это количество энергии, которое необходимо для отрыва электрона от атома
элемента, т.е. для превращения атомов в положительно заряженный ион:
Чем
меньше энергия ионизации, тем легче атом отдает электрон, тем сильнее
металлические свойства элемента.
Неметалличность – это
способность атомов элемента присоединять
электроны.
Количественной
характеристикой неметалличности элемента является сродство к электрону (Еср).
Сродство к
электрону – это энергия, которая выделяется при присоединении электрона к
нейтральному атому, т.е. при превращении
атомов в отрицательно заряженный ион:
Чем
больше сродство к электрону, тем легче атом присоединяет электрон, тем сильнее
неметаллические свойства элемента. Универсальной характеристикой металличности и
неметалличности элементов является электроотрицательность элемента (ЭО).
Электроотрицательность
элемента характеризует способность его атомов притягивать к себе электроны,
которые участвуют в образовании химических связей с другими атомами в молекуле.
Чем
больше металличность, тем меньше ЭО.
Чем
больше неметалличность, тем больше ЭО.
При
определении значений относительной электроотрицательности различных элементов
за единицу принята ЭО лития.
Рассмотрим,
как изменяются некоторые характеристики элементов в малых периодах слева направо:
Ø
Заряд ядер
атомов увеличивается.
Ø
Число
электронных слоев атомов не изменяется.
Ø
Число электронов
на внешнем слое атомов увеличивается от 1 до 8.
Ø
Радиус атомов
уменьшается.
Ø
Прочность связи
электронов внешнего слоя с ядром увеличивается.
Ø
Энергия ионизации
увеличивается.
Ø
Сродство к
электрону увеличивается.
Ø
Электроотрицательность
увеличивается.
Ø
Металличность
элементов уменьшается.
Ø
Неметалличность
элементов увеличивается.
В больших
периодах
с увеличением заряда ядер электронное строение атомов изменяется сложнее, чем в
малых периодах. Поэтому и изменение свойств элементов в больших периодах более
сложное.
Рассмотрим
это изменение свойств на примере четвертого периода. Он начинается, как и малые
периоды, двумя s-элементами – К и Са, в атомах которых на внешнем слое
находится соответственно 1 и 2 электрона. Эти элементы имеют наибольшие радиусы
атомов среди всех элементов IV периода, поэтому электроны внешнего слоя слабо
связаны с атомами, и эти элементы являются типичными металлами. Эти элементы
имеют самые низкие в IV периоде значения ЭО.
Рассмотрим,
как изменяются некоторые характеристики элементов в главных подгруппах сверху
вниз:
Ø
Число
электронных слоев атомов увеличивается.
Ø
Число электронов
на внешнем слое атомов одинаково.
Ø
Радиус атомов увеличивается.
Ø
Прочность связи
электронов внешнего слоя с ядром уменьшается.
Ø
Энергия
ионизации уменьшается.
Ø
Сродство к
электрону уменьшается.
Ø
Электроотрицательность
уменьшается.
Ø
Металличность
элементов увеличивается.
Ø
Неметалличность
элементов уменьшается.
В малых периодах
закономерно изменяется высшая
валентность элементов: во втором периоде от I у Li до V у N;
в третьем периоде от I у Na до VII у
Cl. В большом четвертом периоде высшая валентность увеличивается от I у K до VII
у Mn; у следующих элементов она понижается до II у Zn, а потом снова увеличивается от III у Ga
до VII у Br.
Периодическое
изменение высшей валентности объясняется периодическим изменением числа валентных электронов в атомах.
Валентные
электроны
– это электроны, которые могут участвовать в образовании химических связей.
В атомах s-
и p-элементов валентными
являются, как правило, все электроны внешнего слоя.
В атомах d-элементов
валентными являются электроны внешнего слоя, а также все или некоторые d-электроны
предвнешнего слоя.
Число
валентных электронов для большинства элементов равно номеру группы.
УПРАЖНЕНИЯ
1.
Расположите в порядке усиления металлических
свойств, следующие элементы: As, Sb, N, P, Bi. Обоснуйте полученный ряд, исходя
из строения атомов этих элементов.
Решение:
N < P < As
< Sb < Bi → металлические свойства возрастают так как:
На внешнем энергетическом уровне у всех элементов по 5 электронов, но от N до
Bi возрастают радиусы атомов.
Чем больше радиус атома, тем слабее притяжение внешних электронов к ядру, тем
сильнее проявляются металлические свойства (способность отдавать электроны).
_____________________________________________________________
2.
Расположите в порядке
усиления неметаллических свойств, следующие элементы: Si, Al, P, S, Cl, Mg, Na.
Обоснуйте полученный ряд, исходя из строения атомов этих элементов.
Решение:
Na
< Mg < Al < Si < P < S < Cl → неметаллические свойства
возрастают так как:
Число энергетических уровней постоянно.
Увеличивается число электронов на внешнем
уровне, и увеличивается заряд ядра. (от 11 у Na до 17 у Cl )
Следовательно притяжение электронов к ядру
увеличивается, и радиус, немного уменьшается.
Из-за усиления притяжения электронов к ядру
металлические свойства (способность отдавать электроны) уменьшается, а
неметаллические свойства увеличиваются.
_____________________________________________________________
3.
Напишите формулы
оксидов бора, бериллия и лития и расположите их в порядке возрастания основных
свойств. Запишите формулы гидроксидов, соответствующих этим оксидам. Каков их
химический характер?
Решение:
B2O3 < BeO < Li2O →
основные свойства возрастают.
H3BO3 – борная
кислота, характер кислотный.
Be(OH)2 –
гидроксид бериллия, характер амфотерный.
LiOH – гидроксид лития,
характер основный.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Электронная
конфигурация элемента 1s2 2s2 2p6 3s1. Назовите атомный
(порядковый) номер и группу, в которую входит этот элемент.
2.
Приведены электронные
формулы внешних электронных оболочек элементов: а) 2s2 2p5, б) 3s2 3p4, в) 3d1 4s2. Составьте полные
электронные формулы и определите порядковые номера элементов. Какие это
элементы?
3.
В каком периоде Периодической таблицы находится элемент с
полностью или частично заселенными орбиталями 1s 2s 2p 3s 3p 3d 4s?
4.
По положению в
Периодической таблице определите: а) что лучший окислитель – сера или фосфор?
б) У селена или у мышьяка лучше выражены металлические свойства?
5.
По положению элементов в периодической системе
определите, какой элемент имеет большую ЭО; больший радиус атома:
Объясните ответ.
6.
Какой элемент имеет самую большую ЭО. Почему?
7.
Напишите символы всех металлов третьего периода,
если первым неметаллом в этом периоде является кремний.
8.
Напишите символы всех неметаллов главной подгруппы V группы, если известно, что в этой подгруппе два
элемента являются металлами.
9.
Атомы каких элементов – металлов или неметаллов –
имеют обычно большее число электронов на внешнем электронном слое.
10.
Напишите символы всех элементов, атомы которых
содержат пять валентных электронов. Напишите формулы высших оксидов этих
элементов.
1. Химические свойства какого элемента наиболее | |
а) фосфора | б) алюминия |
в) углерода | г) свинца |
2. Какой из элементов IV-ого | |
а) калий | б) цинк |
в) кальций | г) германий |
3. Укажите символ элемента с наименее выраженными | |
а) Mg | б) Ca |
в) Be | г) Ba |
4. Какие свойства атомов элементов уменьшаются при | |
а) радиус атома | б) все ответы верны |
в) число энергетических уровней в | г) неметаллические |
5. Какие свойства атомов элементов возрастают с | |
а) металлические | б) все ответы верны |
в) неметаллические | г) число электронов на внешнем |
6. У какого из элементов VI группы неметаллические | |
а) хрома | б) теллура |
в) кислорода | г) серы |
7. Какие утверждения справедливы для | |
а) все ответы верны | б) справа налево неметаллические |
в) число энергетических уровней в | г) число электронов на внешнем |
8. Чем различаются между собой атомы расположенных в | |
а) все ответы верны | б) радиусом |
в) числом валентных электронов | г) формулой высшего оксида |
9. Что одинаково для атомов расположенных в одной и | |
а) радиус | б) число энергетических уровней |
в) степень окисления | г) формула высшего оксида |
10. В ряду элементов Be – Mg – Ca: | |
а) металлические свойства слева | б) в таком же порядке растет радиус |
в) растет число энергетических уровней | г) все ответы верны |
Ответы:
1 | в |
2 | а |
3 | в |
4 | а |
5 | а |
6 | в |
7 | а |
8 | а |
9 | г |
10 | г |
Источник
Задача 1044.
Рассмотреть особенности строения атомов элементов главной подгруппы третьей группы. Какие валентные состояния характерны для этих элементов? Как изменяются их свойства с увеличением порядкового номера элемента?
Решение:
Элементы главной подгруппы IIIА группы характеризуются наличием трёх электронов в наружном электронном слое атома. Электронная формула валентных подуровней имеет вид ns2np1. Строение электронных остовов атомов данной подгруппы сильно различаются. Только бор и алюминий имеют атомные остовы, которые можно описать электронными формулами характерными для благородных газов; второй снаружи электронный слой атома бора содержит два электрона, атома алюминия – восемь. У галлия и индия атомные остовы завершаются d-подуровнями, а у таллия – d- и f-подуровни.
Имея на наружном электронном слое один неспаренный р-электрон. Элементы IIIА группы в основном состоянии проявляют ковалентность равную 1. В возбуждённом состоянии (ns1np2) для всех элементов подгруппы характерна ковалентность равная 3.
В своих соединениях для всех элементов IIIА группы характерна степень окисления +3; таллий в большинстве своих соединений проявляет степень окисления +1. С увеличением порядкового номера возрастают радиусы атомов элементов, поэтому металлические свойства рассматриваемых элементов заметно усиливаются с возрастанием порядкового номера, энергия ионизации I1, I2, I3 закономерно уменьшаются (только у таллия I3 выше, чем у индия). Бор – неметалл, алюминий – амфолит; а галлий, индий и таллий – типичные металлы. Электроотрицательность элементов IIIА группы закономерно уменьшается с увеличением порядкового номера. Основные свойства гидроксидов усиливаются сверху вниз – бор – образует кислоту, алюминий – амфолит, а остальные – основания. С возрастанием порядкового номера элемента восстановительная способность элементов увеличиваются, а окислительные – уменьшаются (самый сильный восстановитель – таллий, самый сильный окислитель – бор).
Сходство химических свойств бора и кремния
Задача 1045.
В чем проявляется сходство химических свойств бора и кремния? Чем объясняется это сходство?
Решение:
По своим химическим свойствам бор в значительной степени сходен с кремнием (бор и кремний образуют ряд гидридов), находящимся в третьем периоде и в четвёртой группе периодической системы, т. е. правее и ниже бора. Это явление, носящее название диагонального сходства, наблюдается не только у бора и кремния, но так же у лития и магния, натрия и кальция. У бора и у кремния ионные потенциалы Z/R, где Z – заряд иона, R – радиус иона, следует ожидать близкие значения. Действительно, ионные потенциалы для ионов бора и кремния, будут равны 3/0,41 = 7,32 и 4/0,56 = 7,31. Близость ионных потенциалов приводит к близким свойствам самих соединений. При близких значениях ионных потенциалов следует ожидать примерно одинакового поляризующего действия катионов на однотипные анионы. В этом случае физико-химические характеристики разных соединений могут оказаться близкими. Оба элемента образуют прочные бинарные соединения. Энтальпии образования характеристических оксидов В2О3 -1273,8 кДж/моль и SiO2 -911,6 кДж/моль. Бор и кремний образуют преимущественно ковалентные -связи. Электроотрицательности В и Si имеют близкие значения, соответственно 2,07 и 1,79. Оба элемента – неметаллы. При обычных условия и бор, и кремний химически инертны и реагируют только с фтором. Бор и кремний образуют слабые кислоты, их соединения – слабые восстановители.
Источник
Химические свойства углерода
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
С хлором, бромом и йодом кремний реагирует только при нагревании. При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
Так с хлором реакция протекает при 340-420 оС:
С бромом – 620-700 оС:
С йодом – 750-810 оС:
Все галогениды кремния легко гидролизуются водой:
а также растворами щелочей:
Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Источник
| ||||||||||||||||||||||||||||||||||||||||
https://Reshebnikxim.narod.ru/ | ||||||||||||||||||||||||||||||||||||||||
Источник