Индол его строение и свойства в состав какой аминокислоты входит индол
Эта статья об органическом веществе; о реке в Крыму см. Мокрый Индол.
| Индол | |
|---|---|
| Систематическое наименование | 1H-индол |
| Традиционные названия | 2,3-бензпиррол, 1-бензазол, бензопирро́л, кетол, |
| Хим. формула | C8H7N |
| Состояние | бесцветные кристаллы |
| Молярная масса | 117,15 г/моль |
| Плотность | 1,22 г/см³ |
| Температура | |
| • плавления | 52,5 °C |
| • кипения | 254 °C |
| Давление пара | 100 кПа[1] |
| Константа диссоциации кислоты | 17 |
| Рег. номер CAS | 120-72-9 |
| PubChem | 798 |
| Рег. номер EINECS | 204-420-7 |
| SMILES | C1(NC=C2)=C2C=CC=C1 |
| InChI | InChI=1S/C8H7N/c1-2-4-8-7(3-1)5-6-9-8/h1-6,9H SIKJAQJRHWYJAI-UHFFFAOYSA-N |
| RTECS | NL2450000 |
| ChEBI | 16881 |
| ChemSpider | 776 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Индо́л (бензопирро́л, 2,3-бензпиррол) — гетероциклическое конденсированное ароматическое соединение.
Бесцветные кристаллы с запахом, напоминающим запах капусты.
Индольное ядро входит во множество биохимических природных соединений. Как индивидуальное вещество содержится в каменноугольной смоле и в некоторых эфирных маслах, например, в масле жасмина.
История[править | править код]
Структурная зимическая формула индола предложенная Байером в 1869 г.
Изучение индола началось с изучения растительного красителя индиго. Из индиго окислением можно получить изатин, а затем в индоксил . В 1866 году Адольф фон Байер восстановил цинковой пылью индоксил до индола[2]. В 1869 году он предложил химическую структурную формулу для индола (на рисунке слева)[3].
Некоторые производные индола очень широко использовались в качестве красителей до конца 19-го века. В 1930-х годах интерес к индолу вновь увеличился, когда стало известно, что индольное ядро входит в молекулы многих важных алкалоидов, в аминокислоту триптофан, в ауксины и другие биохимически важные вещества. Но и в наши дни он продолжает интенсивно изучаться[4].
От слова «индиго» индол и получил своё название.
Физические свойства[править | править код]
При нормальных условиях представляет собой бесцветные листовидные кристаллы с запахом, напоминающим запах прелой капустной кочерыжки.
Растворимость в некоторых растворителях[править | править код]
- в бензоле — растворим;
- в воде — 0,36 г/100 г (при 25 °C) — плохо растворим;
- в диэтиловом эфире — легко растворим;
- в лигроине — растворим;
- в метаноле — растворим;
- в этаноле — 35,9 г/100 г (при 20 °C).
Химические свойства[править | править код]
Индол по своей реакционной способности схож с бензолом, но более реакционноспособен. Неподеленная пара электронов азота в индоле является частью ароматического секстета, поэтому индол не проявляет склонности к связыванию протона и лишен основных свойств. Напротив, в реакциях с сильными основаниями индол проявляет свойства слабой NH-кислоты.
Как слабая кислота, индол в растворе натрия в жидком аммиаке (NH3) образует N-натрийиндол, с гидроксидом калия (КОН) при 130 °C — N-калийиндол.
Обладает ароматическими свойствами. Электрофильное замещение идёт главным образом в положении атома углерода 3.
Нитрование обычно осуществляется бензоилнитратом, сульфирование — пиридинсульфотриоксидом, бромирование — диоксандибромидом, хлорирование — SO2Cl2, алкилирование — активными алкилгалогенидами.
Ацетилирование в уксусной кислоте также идёт в положение 3, в присутствии ацетата натрия (CH3COONa) — в положение 1.
В уксусном ангидриде образуется 1,3-диацетилиндол. Индол легко присоединяется по двойной связи a, b к непредельным кетонам и нитрилам.
Аминометилирование (реакция Манниха) в мягких условиях протекает в положение 1, в жёстких — в положение 3.
Замещение в бензольном кольце (преимущественно в положения 4 и 6) идёт лишь в кислых средах при блокированном присоединения по атому в положении 3. В присутствии воды, надкислот или на свету индол окисляется в индоксил, который затем превращается в димер, называемый индиго.
Более жёсткое окисление под действием озона (О3), диоксида марганца MnO2 приводит к разрыву пиррольного кольца с образованием 2-формамидобензальдегида. При гидрировании индола водородом в мягких условиях восстанавливается пиррольное кольцо, в более жёстких — и бензольное.
Нахождение в природе[править | править код]
Индол и его гомолог скатол образуются в кишечнике человека и других млекопитающих в результате расщепления гнилостными бактериями аминокислоты триптофана — индол обладает очень неприятным запахом, но в крайне малых концентрациях он имеет запах жасмина (в эфирном масле которого содержится) и применяется в парфюмерии.
Индол содержится в эфирных маслах жасмина и цитрусовых, входит в состав каменноугольной смолы.
Индольное ядро — фрагмент молекул многих важных природных биохимических соединений (например, триптофана, серотонина, мелатонина, буфотенина).
Ядро индола является R-группой одной из 20 кодируемых аминокислот — триптофана, и поэтому присутствует практически в любом белке. Ядро индола также входит в состав индольных алкалоидов.
Получение[править | править код]
Обычно индол выделяют из нафталиновой фракции каменноугольной смолы или получают дегидрированием о-этиланилина с последующей циклизацией образующегося продукта.
Синтез[править | править код]
Индол и его производные синтезируют циклизацией арилгидразонов карбонильных соединений (реакция Фишера), взаимодействием ариламинов с α-галоген- или α-гидроксикарбонильными соединениями (реакция Бишлера).
Применение[править | править код]
Индол служит исходным сырьём для синтеза гетероауксина, триптофана, используется в парфюмерной и фармацевтической промышленности. В парфюмерии индол применяют как фиксатор запаха.
Индол и его производные используют при синтезе многих биологически активных соединений (гормонов, галлюциногенов) и лекарственных средств (например, индопана, индометацина, индол-3-карбинола).
Примечания[править | править код]
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
Источник
Индол — бесцветные кристаллы с запахом,
напоминающим нафталин. Хорошо растворим
в органических растворителях, горячей
воде и жидком аммиаке. Индол впервые
был получен Байером в 1866 г. перегонкой
оксииндола над цинковой пылью. Основным
природным источником индола является
каменноугольная смола. Индол относится
к гетероароматическим соединениям.
Индол обладает слабыми кислотными
свойствами.
1) Как электронодонорное соединение и
слабое основание индол реагирует с
различными электрофильными реагентами.
В отличие от пиррола в индоле реакционным
центром обычно является углеродный
атом в положении 3, что обусловлено
влиянием бензольного цикла. В то же
время индол является слабой NH-кислотой
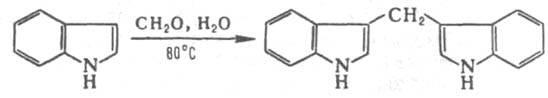
и дает соли.2) Взаимод. с альдегидами
приводит к образованию дииндолильных
производных, например:

3) Аминометилирование (р-ция Манниха) в
мягких условиях протекает в положение
1, в жестких – в положение 3. Замещение в
бензольное кольцо (преим. в положения
4 и 6) идет лишь в кислых средах при
блокированном положении 3.
4)Индолы легко окисляются кислородом
воздуха и многими другими окислителями.
Реакции окисления протекают сложно и
приводит к открытию пятичленного цикла.
В присутствии кислорода на свету индол
может окисляться до индоксила, который
в дальнейшем при окислении дает димер,
а затем краситель индиго.
Производные индола: триптофан и его
продукты метаболических превращений:
мелатонин, серотонин.
Триптофан- (2-амино-3-(3-индолил) – пропионовая
кислота) ароматическая альфа- аминокислота,
обладает всеми свойствами 3-замещенных
индолов: легко окисляется, в сильнокислой
среде неустойчив (разрушается в условиях
кислотного гидролиза белков, поэтому
для его определения проводят щелочной
гидролиз. Триптофан дает многочисленные
цветные реакции (напр., Адамкевича
реакцию). Триптофан-бесцветное
кристаллическое вещество, Тпл=283-285
градусов, растворим в воде, плохо
растворим в этаноле и не растворим в
диэтиловом эфире.
Т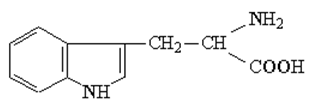 РИПТОФАН
РИПТОФАН
– незаменимая аминокислота, входящей в
состав большинства белков животного и
растительного происхождения. Триптофан
в организме человека непосредственно
преобразуется в серотонин – соединение,
которое вызывает умственное расслабление
и создает ощущение эмоционального
благополучия. Серотонин, в свою очередь,
является предшественником мелатонина,
регулирующего биологические часы. У
людей, находящихся в состоянии депрессии,
в крови мало как серотонина, так и
триптофана. Их низкое содержание в
организме вызывает депрессию, тревожность,
бессонницу, расстройства внимания,
гиперактивность, мигрень, головные
боли, напряжение.
М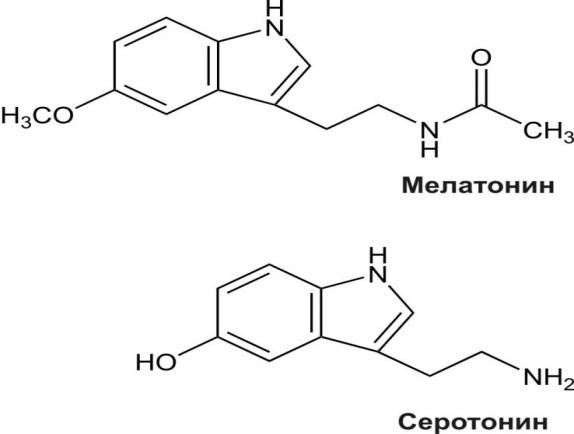 елатонин-гормон,
елатонин-гормон,
участвующий в регуляции циркадных
ритмов организма (циклических колебаниях
активности различных органов). Его часто
используют спортсмены для сглаживания
сбоя биоритмов за счет улучшения сна
при перелете нескольких часовых поясов.
Серотонин – биогенный амин, влияющий на
функции различных органов и тканей при
взаимодействии со специфическими
рецепторами. Он играет важнейшую роль
в деятельности центральной и периферической
нервной системы в качестве передатчика
нервных импульсов.
Гетероауксин (β-индолилуксусная кислота)
— вещество группы ауксинов, фитогормон,
стимулятор роста растений. Химическое
вещество высокой физиологической
активности, образующееся в растениях
и влияющее на ростовые процессы ( гормон
роста); один из наиболее широко
распространённых ауксинов. Впервые
выделен из культуры плесневых грибов
и др. микроорганизмов голландским
химиком Ф.Кеглем с сотрудниками; позднее
обнаружен и у высших растений; образуется
из аминокислоты триптофана в листьях,
а затем перемещается в растущие стебли
и корни растений, где окисляется и
переходит в деятельное состояние.
Гетероауксин можно получить синтетически
путем взаимодействия индола и гликолевой
кислоты в присутствии основания под
действием высокой температуры:

Нахождение в природе:
Индол содержится в эфирных маслах
жасмина и цитрусовых, входит в состав
каменноугольной смолы. Кольцо индола
— фрагмент молекул важных природных
соединений (например, триптофана,
серотонина, мелатонина, буфотенина).
Обычно индол выделяют из нафталиновой
фракции каменноугольной смолы или
получают дегидрированием о-этиланилина
с последующей циклизацией образующегося
продукта. Ядро индола входит в состав
индольных алкалоидов. Сам индол –
фиксатор запаха в парфюмерии; его
производные используют в производстве
биологически активных соединений
(гормонов, галлюциногенов) и лекарственных
средств (например, индопана, индометацина).
Триптофан является компонентом пищевых
белков. Наиболее богаты триптофаном
такие продукты, как сыр, рыба, мясо,
бобовые, творог, грибы, овёс, сушёные
финики, арахис, кунжут, кедровый орех,
молоко, йогурт. Триптофан присутствует
в большинстве растительных белков,
особенно им богаты соевые бобы. Очень
малое количество триптофана содержится
в кукурузе, поэтому питание только
кукурузой приводит к нехватке этой
аминокислоты. Одним из лучших источников
триптофана является арахис, причем как
цельные орехи, так и арахисовая паста.
Помимо стимуляции растяжения клеток
растений, гетероауксин влияет и на
многие другие процессы. Под его действием
интенсифицируется деление клеток.
Известно, что процесс опадения листьев
контролируется гетероауксином: перед
опадением его приток из листа в черешок
сильно сокращается. Обработка черешка
гетероауксином предотвращает опадение.
Особенно сложными кажутся механизмы
регуляции гетероауксином процессов
цветения и плодоношения. Он влияет на
пол образующегося цветка, на рост и
формирование пыльцевой трубки.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
| Имена | |
|---|---|
| Название ИЮПАК 1 H- Индоль | |
| Другие имена 2,3-бензопиррол, кетол, | |
| Идентификаторы | |
Количество CAS |
|
3D модель ( JSmol ) |
|
| ЧЭБИ |
|
| ЧЭМБЛ |
|
| ChemSpider |
|
| ECHA InfoCard | 100.004.019 |
| КЕГГ |
|
PubChem CID |
|
| Номер RTECS |
|
| UNII |
|
Панель управления CompTox ( EPA ) |
|
ИнЧИ
| |
Улыбки
| |
| Свойства | |
Химическая формула | C 8 H 7 N |
| Молярная масса | 117,151 г · моль -1 |
| Внешность | Белое твердое вещество |
| Запах | Кал или жасмин нравится |
| Плотность | 1,1747 г / см 3 , твердый |
| Температура плавления | От 52 до 54 ° C (от 126 до 129 ° F, от 325 до 327 K) |
| Точка кипения | От 253 до 254 ° C (от 487 до 489 ° F, от 526 до 527 K) |
Растворимость в воде | 0,19 г / 100 мл (20 ° C) Растворим в горячей воде |
| Кислотность (p K a ) | 16,2 (21,0 в ДМСО ) |
| Основность (p K b ) | 17,6 |
Магнитная восприимчивость (χ) | -85,0 · 10 −6 см 3 / моль |
| Структура | |
Кристальная структура | Pna2 1 |
Молекулярная форма | Планарный |
Дипольный момент | 2,11 D в бензоле |
| Опасности | |
| Паспорт безопасности | [1] |
| Заявление R / S (устаревшее) | Р: 21 / 22-37 / 38-41-50 / 53 С: 26-36 / 37 / 39-60-61 |
| точка возгорания | 121 ° С (250 ° F, 394 К) |
| Родственные соединения | |
Родственные ароматические | бензол , бензофуран , карбазол , карболин , инден , бензофуран , бензотиофен , индолин , изатин , метилиндол , оксиндол , пиррол , скатол , бензофосфол |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| проверить ( что есть ?) | |
| Ссылки на инфобоксы | |
Индол представляет собой ароматическое гетероциклическое органическое соединение с формулой C 8 H 7 N . Он имеет бициклическую структуру, состоящую из шестичленного бензольного кольца, конденсированного с пятичленным пиррольным кольцом. Индол широко распространен в естественной среде и может вырабатываться различными бактериями . Как межклеточная сигнальная молекула , индол регулирует различные аспекты физиологии бактерий, включая образование спор , стабильность плазмиды , устойчивость к лекарствам , образование биопленок и вирулентность . Аминокислота триптофан вл етс производное индола и предшественником нейротрансмиттера серотонина .
Общие свойства и появление
Индол находится в твердом состоянии при комнатной температуре. Он естественным образом встречается в человеческих фекалиях и имеет сильный запах фекалий . Однако при очень низких концентрациях он имеет цветочный запах и входит в состав многих духов . Это также происходит в каменноугольной смоле .
Соответствующий заместитель называется индолилом .
Индол подвергается электрофильному замещению , в основном в положении 3 (см. Диаграмму справа). Замещенные индолы являются структурными элементами (а для некоторых соединений – синтетическими предшественниками) алкалоидов триптамина, полученных из триптофана , в том числе нейромедиаторов серотонина и мелатонина , а также природных психоделических препаратов диметилтриптамина и псилоцибина . Другие индольные соединения включают ауксин растительного гормона (индолил-3-уксусную кислоту, ИУК ), триптофол , противовоспалительный препарат индометацин и бета-блокатор пиндолол .
Имя индол является портманто из слов тх УГОВ и оле мкм , так как индол был впервые выделен обработкой красителя индиго с олеумом.
История
Первоначальная структура индола Байера, 1869 г.
Химия индолов начала развиваться с изучением красителя индиго . Индиго можно превратить в изатин, а затем в оксиндол . Затем, в 1866 году, Адольф фон Байер восстановил оксиндол до индола, используя цинковую пыль. В 1869 году он предложил формулу индола (слева).
Некоторые производные индола были важными красителями до конца XIX века. В 1930-х годах интерес к индолу усилился, когда стало известно, что индольный заместитель присутствует во многих важных алкалоидах (например, триптофане и ауксинах ), и сегодня он остается активной областью исследований.
Биосинтез и функция
Индол биосинтезируется в шикиматном пути через антранилат . Он является промежуточным звеном в биосинтезе триптофана , где он остается внутри молекулы триптофансинтазы между удалением 3-фосфоглицеральдегида и конденсацией с серином . Когда в клетке необходим индол, он обычно производится из триптофана триптофаназой .
Индол образуется через антранилат и далее реагирует с образованием аминокислоты триптофана.
Как межклеточная сигнальная молекула , индол регулирует различные аспекты физиологии бактерий, включая образование спор , стабильность плазмиды , устойчивость к лекарствам , образование биопленок и вирулентность . Ряд производных индола выполняет важные клеточные функции, включая нейротрансмиттеры, такие как серотонин .
Поддерживает слизистую оболочку реакционная способность :
↑ IL-22 производства
Эта диаграмма показывает биосинтез биоактивных соединений (индола и некоторых других производных) из триптофана бактериями в кишечнике. Индол вырабатывается из триптофана бактериями, которые экспрессируют триптофаназу . Clostridium sporogenes метаболизирует триптофан в индол, а затем в 3-индолепропионовую кислоту (IPA), мощный нейрозащитный антиоксидант , улавливающий гидроксильные радикалы . IPA связывается с рецептором прегнана X (PXR) в клетках кишечника, тем самым облегчая гомеостаз слизистой и барьерную функцию . После всасывания из кишечника и распределения в головном мозге IPA оказывает нейропротекторный эффект против церебральной ишемии и болезни Альцгеймера . Виды Lactobacillus метаболизируют триптофан в индол-3-альдегид (I3A), который действует на арилуглеводородный рецептор (AhR) в иммунных клетках кишечника, в свою очередь, увеличивая выработку интерлейкина-22 (IL-22). Сам Индол вызывает секрецию из глюкагон-подобного пептида-1 (GLP-1) в кишечных L клеток и действует в качестве лиганда для AhR. Индол также может метаболизироваться в печени в индоксилсульфат , соединение, которое в высоких концентрациях является токсичным и связано с сосудистыми заболеваниями и дисфункцией почек . AST-120 ( активированный уголь ), кишечный сорбент , принимаемый внутрь , адсорбирует индол, в свою очередь, снижая концентрацию индоксилсульфата в плазме крови.
Синтетические маршруты
Индол и его производные также можно синтезировать множеством методов.
Основные промышленные маршруты начинаются с анилина через парофазную реакцию с этиленгликолем в присутствии катализаторов :
Обычно реакции проводят при температуре от 200 до 500 ° C. Урожайность может достигать 60%. Другие предшественники индола включают формилтолуидин , 2-этиланилин и 2- (2-нитрофенил) этанол, все из которых подвергаются циклизации .
Синтез индола Леймгрубера-Батчо
Индол синтез Leimgruber-Batcho является эффективным методом синтеза индола и замещенных индолов. Этот метод, впервые описанный в патенте 1976 г., является высокоэффективным и может генерировать замещенные индолы. Этот метод особенно популярен в фармацевтической промышленности , где многие фармацевтические препараты состоят из специально замещенных индолов.
Синтез индола по Фишеру
Синтез индола из фенилгидразина и пировиноградной кислоты с помощью микроволн в одном сосуде
Одним из старейших и наиболее надежных методов синтеза замещенных индолов является синтез индола Фишера , разработанный в 1883 году Эмилем Фишером . Хотя синтез индола сам по себе проблематичен с использованием синтеза индола Фишера, он часто используется для получения индолов, замещенных в 2- и / или 3-положениях. Индол все еще может быть синтезирован с использованием синтеза индола Фишера путем взаимодействия фенилгидразина с пировиноградной кислотой с последующим декарбоксилированием образовавшейся индол-2-карбоновой кислоты. Это также было выполнено в однореакторном синтезе с использованием микроволнового излучения.
Другие индолообразующие реакции
- Синтез индола Бартоли
- Синтез индола Бишлера – Мёлау
- Синтез индола Фукуяма
- Синтез индола по Гассману
- Геметсбергерский синтез индола
- Ларок синтез индола
- Синтез маделунга
- Синтез индола Неницеску
- Reissert синтез индола
- Синтез индола Байера-Эммерлинга
- В реакции Дильса-Риза диметилацетилендикарбоксилат реагирует с 1,2-дифенилгидразином с образованием аддукта, который в ксилоле дает диметилиндол-2,3-дикарбоксилат и анилин . С другими растворителями образуются другие продукты: с ледяной уксусной кислотой – пиразолон , а с пиридином – хинолин .
Химические реакции индола
Основность
В отличие от большинства аминов , индол не является основным : как и пиррол , ароматический характер кольца означает, что неподеленная пара электронов на атоме азота недоступна для протонирования. Однако сильные кислоты, такие как соляная кислота, могут протонировать индол. Индол в основном протонируется по C3, а не по N1, из-за енаминоподобной реакционной способности части молекулы, расположенной за пределами бензольного кольца. Протонированная форма имеет p K a -3,6. Чувствительность многих индольных соединений (например, триптаминов ) в кислых условиях вызвана этим протонированием.
Электрофильное замещение
Наиболее реакционной позицией на индоле для электрофильного ароматического замещения является C3, который в 10 13 раз более реактивен, чем бензол . Например, он алкилируется фосфорилированным серином в процессе биосинтеза аминокислоты триптофана. Вильсмайер-Хаак формилирование индола будет иметь место при комнатной температуре исключительно на C3.
Поскольку пиррольное кольцо является наиболее реакционной частью индола, электрофильное замещение карбоциклического (бензольного) кольца обычно происходит только после замещения N1, C2 и C3. Заслуживающее внимания исключение возникает, когда электрофильное замещение проводится в условиях, достаточно кислых, чтобы полностью протонировать C3. В этом случае C5 является наиболее частым местом электрофильной атаки.
Грамин , полезный синтетический промежуточный продукт, получают по реакции Манниха индола с диметиламином и формальдегидом . Это предшественник индол-3-уксусной кислоты и синтетического триптофана.
N – H кислотность и металлоорганические анионные комплексы индола
N – H-центр имеет ap K a в ДМСО 21 , поэтому для полного депротонирования требуются очень сильные основания, такие как гидрид натрия или н- бутиллитий, и условия отсутствия воды . Полученные металлоорганические производные могут реагировать двумя способами. Более ионные соли, такие как соединения натрия или калия, имеют тенденцию реагировать с электрофилами при азоте-1, тогда как более ковалентные соединения магния ( индольные реактивы Гриньяра ) и (особенно) комплексы цинка имеют тенденцию реагировать на углероде 3 (см. Рисунок ниже). Аналогичным образом полярные апротонные растворители, такие как ДМФА и ДМСО, склонны способствовать атаке азота, тогда как неполярные растворители, такие как толуол, способствуют атаке C3.
Углеродная кислотность и литиирование C2
После протона N – H водород в точке C2 является следующим по кислотности протоном индола. Реакция N- защищенных индолов с бутиллитием или диизопропиламидом лития приводит к литированию исключительно в положении C2. Этот сильный нуклеофил затем можно использовать как таковой с другими электрофилами.
Бергман и Венемальм разработали технику литиирования 2-положения незамещенного индола, как и Катрицки.
Окисление индола
Из-за того, что индол богат электронами, он легко окисляется . Простые окислители, такие как N- бромсукцинимид, будут избирательно окислять индол 1 до оксиндола ( 4 и 5 ).
Циклоприсоединения индола
Только пи-связь C2 – C3 индола способна к реакциям циклоприсоединения . Внутримолекулярные варианты часто более продуктивны, чем межмолекулярные циклоприсоединения. Например, Padwa et al. разработали эту реакцию Дильса-Альдера для образования передовых промежуточных соединений стрихнина . В этом случае 2-аминофуран представляет собой диен , а индол – диенофил . Индолы также претерпевают внутримолекулярные [2 + 3] и [2 + 2] циклоприсоединения.
Несмотря на посредственные выходы, межмолекулярные циклоприсоединения производных индола хорошо задокументированы. Одним из примеров является реакция Пикте-Шпенглера между производными триптофана и альдегидами , которая дает смесь диастереомеров , приводящую к снижению выхода желаемого продукта.
Гидрирование
Индолы подвержены гидрированию иминной субъединицы.
Смотрите также
- Индол-3-масляная кислота
- Индоловый тест
- Изоиндол
- Изоиндолин
- Мартине синтез диоксиндола
- Скатол (3-метилиндол)
- Stollé синтез
- Триптамин
Ссылки
Общие ссылки
- Хулихан, WJ, изд. (1972). Индолы, часть первая . Нью-Йорк: Wiley Interscience.
- Сандберг, Р.Дж. (1996). Индолы . Сан-Диего: Academic Press. ISBN 978-0-12-676945-6.
- Джоуль, JA; Миллс, К. (2000). Гетероциклическая химия . Оксфорд, Великобритания: Blackwell Science. ISBN 978-0-632-05453-4.
- Джоуль, Дж. (2000). EJ, Томас (ред.). Наука синтеза . 10 . Штутгарт: Тиме. п. 361. ISBN. 978-3-13-112241-4.
- Schoenherr, H .; Лейтон, Дж. Л. (2012). «Прямые и высокоэнантиоселективные реакции изо-Пикте-Шпенглера с α-кетоамидами: доступ к малоизученным структурам ядра индола». Орг. Lett . 14 (10): 2610–3. DOI : 10.1021 / ol300922b . PMID 22540677 .
внешние ссылки
| Викискладе есть медиафайлы по теме индолов . |
- Синтез индолов (обзор новейших методов)
- Синтез и свойства индолов на chemsynthesis.com
Источник
