Энергия ионизации и какие свойства элементов она характеризует

Энергия ионизации – это количество энергии, которое изолированный атом в основном электронном состоянии должен поглотить для освобождения электрона, в результате чего образуется ион.
Эта величина обычно выражается в кДж/моль или количество, необходимое для того, чтобы потерять один электрон.
Образование ионов
Ионы – это атомы, которые получили или потеряли электроны. Образуется ионизирующее излучение со своими положительными и отрицательными особенностями для человека. При рассмотрении первоначально нейтрального атома, вытеснение первого электрона потребует меньше работы, чем вытеснение второго, второй потребует меньше, чем третьего и так далее. Для вытеснение каждого последующего электрона требуется больше работы. Это происходит потому, что после потери первой отрицательно заряженной элементарной частицы общий заряд атома становится положительным, а отрицательные силы будут притягиваться к положительному заряду новообразованного иона.
При рассмотрении первоначально нейтрального атома, вытеснение первого электрона потребует меньше работы, чем вытеснение второго, второй потребует меньше, чем третьего и так далее. Для вытеснение каждого последующего электрона требуется больше работы. Это происходит потому, что после потери первой отрицательно заряженной элементарной частицы общий заряд атома становится положительным, а отрицательные силы будут притягиваться к положительному заряду новообразованного иона.
Чем больше отрицательно заряженных элементарных частиц потеряно, тем более положительным будет этот ион, тем труднее отделить другие электроны от этого атома.
В общем, чем дальше электрон от ядра, тем легче его изгнать. Другими словами, энергия ионизации является функцией атомного радиуса: чем больше радиус, тем меньше количество работы, необходимой для удаления электрона с внешней орбитали. Например, было бы гораздо легче забрать электроны от более крупного элемента Ca (кальция), чем от того, где они крепче удерживаются к ядру как Cl (хлор).
В химической реакции, понимание энергии ионизации важно для того, чтобы понять поведение различных атомов при связях друг с другом.
Например, энергия ионизации натрия (щелочного металла) составляет 496 кДж/моль, тогда как хлора – 1251,1 кДж/моль.
Элементы, находящиеся близко друг к другу в периодической таблице, или элементы, не имеющие большой разницы в энергии ионизации, образуют полярные ковалентные или ковалентные связи. Например, углерод и кислород делают СО2 (углекислый газ) находящиеся близко один к другому на периодической таблице. Они поэтому формируют ковалентное скрепление. Углерод и хлор образуют CCl4 (четыреххлористый углерод) другой молекулой, которая ковалентно связана.
Периодическая таблица и тренд ионизации
Энергия ионизации зависит от атомного радиуса. Так как идя справа налево по периодической таблице, атомный радиус увеличивается, а энергия ионизации уменьшается слева направо в периодах и вниз по группам.
Объяснение шаблона в первых нескольких элементах
Водород имеет электронную структуру 1s1. Это очень маленький атом, и электрон приближается к ядру и, следовательно, притягивает. Нет электронов, экранирующих его от ядра, поэтому энергия ионизации высока 1310 кДж моль-1.
Гелий имеет структуру 1s2. Электрон удаляется с той же орбиты, что и в случае с водородом он близок к ядру. Значение 2370 кДж моль-1 намного выше, чем у водорода, потому что ядро теперь имеет 2 протона, притягивающие их вместо 1.
Литий – 1s22s1. Свой внешний электрон находится на втором энергетическом уровне, гораздо более удаленнее от ядра. Можно утверждать, что это было бы компенсировано дополнительным протоном в ядре, но электрон не чувствует полной тяги ядра – он экранируется.
Если сравнить литий с водородом (а не с гелием), электрон водорода также чувствует тягу 1+ от ядра, но расстояние намного больше с литием. Первая энергия ионизации лития падает до 519 кДж моль-1, тогда как водород составляет 1310 кДж моль-1.
Исключения из этой тенденции наблюдаются для щелочноземельных металлов (группа 2: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra), унбинилий (Ubn) и элементов группы азота (группа 5: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi)). Группы 2 и 5 имеют полностью и наполовину заполненную электронную конфигурацию соответственно, поэтому для удаления отрицательно заряженных элементарных частиц из полностью заполненных орбиталей требуется больше работы, чем из неполнозаполненных.
Щелочные металлы (группа I) обладают малой энергией ионизации, особенно по сравнению с галогенами или группой VII.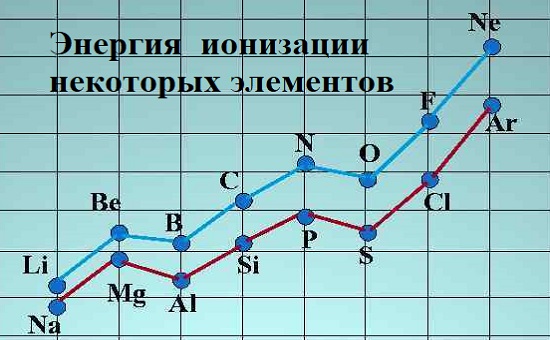
В дополнение к радиусу (расстоянию между ядром и электронами на самой внешней орбите), количество электронов между ядром, в самой внешней оболочке, также влияет на энергию ионизации.
Этот эффект, при котором полный положительный заряд ядра не ощущается внешними электронами из-за отрицательных зарядов внутренних, частично отменяющих положительный заряд, называется экранированием.
Чем больше электронов защищает внешнюю электронную оболочку от ядра, тем меньше работы требуется для вытеснения отрицательно заряженной элементарной частицы из указанного атома.
Чем выше эффект экранирования требуется меньше приложить работы. Из-за экранирующего эффекта энергия ионизации уменьшается сверху вниз в группе. Из таблицы Менделеева видно что Цезий имеет низкую, а фтор самую высокую энергию ионизации (за исключением гелия и неона).
Для чего необходимо знать про эту величину
Падение энергии ионизации при движении вниз таблицы приводит к снижению энергии активации и, следовательно, к более быстрым реакциям.
Энергия ионизации являются одним из наиболее важных факторов, которые необходимо учитывать при оценке прочности химических связей и прогнозировании того, как химические вещества будут связываться друг с другом. Но это не свободная энергия.
Источник
Такие свойства
атомов, как их размер, энергия ионизации,
сродство к электрону, электроотрицательность,
связаны с электронной конфигурацией
атома. В их изменении с увеличением
порядкового номера элемента наблюдается
периодичность.
Радиус атома –
важная характеристика. Чем больше
атомный радиус, тем слабее удерживаются
внешние электроны. И наоборот, с
уменьшением атомного радиуса электроны
притягиваются к ядру сильнее.
В периоде атомный
радиус в общем уменьшается слева направо.
Это объясняется ростом силы притяжения
электронов с ростом заряда ядра. В
подгруппах сверху вниз атомный радиус
возрастает, так как в результате
прибавления дополнительного электронного
слоя увеличивается объем атома, а значит,
и его радиус.
Энергия ионизации
– это энергия,
необходимая для отрыва наиболее слабо
связанного электрона от атома. При
отрыве электрона от атома образуется
соответствующий катион.
Энергия ионизации
для элементов одного периода возрастает
слева направо с возрастанием заряда
ядра. В подгруппе она уменьшается сверху
вниз вследствие увеличения расстояния
электрона от ядра.
Атомы могут не
только отдавать, но и присоединять
электроны. При этом образуется
соответствующий анион. Энергия, которая
выделяется при присоединение к атому
одного электрона, называется сродством
к электрону.
Определение
электроотрицательности дал американский
ученый Л. Полинг. Он же предложил и первую
шкалу электроотрицательности. Согласно
Полингу,
Электроотрицательность
есть способность атома в соединении
притягивать к себе электроны.
Вопрос№11. Химическая связь, её основные характеристики: длина, валентный угол, энергия и полярность.
Длина связи
– это межъядерное расстояние. Химическая
связь тем прочнее, чем меньше ее длина.
Однако мерой прочности связи является
энергия связи.
Энергия связи
определяется количеством энергии,
которое необходимо для разрыва связи.
Углы между связями
называются валентными.
Полярность
химических связей
— характеристика химической связи,
показывающая изменение распределения
электронной плотности в пространстве
вокруг ядер.
Вопрос№12. Ковалентная связь. Два способа её образования. Свойства ковалентной связи. Направленность и насыщаемость связи. Сигма и Пи связи.
Ковалентная
связь, один
из видов химической связи между двумя
атомами, которая осуществляется общей
для них электронной парой.
Механизм образования
ковалентной связи рассмотрим на примере
образования молекулы водорода.
Ядро свободного
атома водорода окружено электронным
облаком, образованным 1s-электроном. При
взаимодействии атомов происходит
частичное перекрывание их электронных
облаков (орбиталей). В результате
возникает общее электронное облако.
Образование химической связи происходит
за счет неспаренных электронов каждого
атома. Неспаренные электроны связываются
в общую пару электронов, которую называют
неподеленной парой.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Такие свойства атомов, как их размер, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность.
Атомы не имеют строго определенных границ, что обусловлено волновой природой электронов. В расчетах пользуются так называемыми эффективными или кажущимися радиусами, т. е. радиусами шарообразных атомов, сближенных между собой при образовании кристалла. Обычно их рассчитывают из рентгенометрических данных.
Радиус атома — важная его характеристика. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. И, наоборот, с уменьшением атомного радиуса электроны притягиваются к ядру сильнее.
В периоде атомный радиус в общем уменьшается слева направо. Это объясняется ростом силы притяжения электронов с ростом заряда ядра. В подгруппах сверху вниз атомный радиус возрастает, так как в результате прибавления дополнительного электронного слоя увеличивается объем атома, а значит, и его радиус.
Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион.
Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра. Энергия ионизации связана с химическими свойствами элементов. Так, щелочные металлы, имеющие небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных; газов связана с их высокими значениями энергии ионизации.
Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения сродства к электрону известны не для всех элементов; измерять их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода.
Определение электроотрицательности дал американский ученый Л. Полинг в 1932 г. Он же предложил и первую шкалу электроотрицательности. Согласно Полингу, электроотрицательность – это способность атома в соединении притягивать к себе электроны. Имеются в виду валентные электроны, т. е. электроны, которые участвуют в образовании химической связи. Очевидно, у благородных газов электроотрицательность отсутствует, так как внешний уровень в их атомах завершен и устойчив.
Сопоставляя значения электроотрицательностей элементов от франция (0,86) до фтора (4,10), легко заметить, что относительная электроотрицательность подчиняется периодическому закону: в периоде она растет с увеличением номера элемента, в группе — уменьшается. Ее значения служат мерой неметалличности элементов. Очевидно, чем больше относительная электроотрицательность, тем сильнее элемент проявляет неметаллические свойства. Неметаллы характеризуются большой относительной электроотрицательностью, а металлы — небольшой. При химическом взаимодействии элементов электроны смещаются от атома с меньшей к атому с большей относительной электроотрицательностью.
3. Развитие представления о строении атома: планетарная модель Резерфорда, теория Бора, квантовая теория строения атома.
Суть планетарной модели строения атома (Э.Резерфорд, 1911 г.) можно свести к следующим утверждениям:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Эта модель оказалась очень наглядной и полезной для объяснения многих экспериментальных данных, но она сразу обнаружила и свои недостатки. В частности, электрон, двигаясь вокруг ядра с ускорением (на него действует центростремительная сила), должен был бы, согласно электромагнитной теории, непрерывно излучать энергию. Это привело бы к тому, что электрон должен был бы двигаться вокруг ядра по спирали и в конце концов упасть на него. Никаких доказательств того, что атомы непрерывно исчезают, не было, отсюда следовало, что модель Резерфорда в чем-то ошибочна.
Теория Бора. В 1913 г. датский физик Н.Бор предложил свою теорию строения атома. Как и Резерфорд, он считал, что электроны двигаются вокруг ядра подобно планетам, движущимся вокруг Солнца. Однако к этому времени уже доказали дискретность энергии электрона в атоме и это позволило Бору положить в основу новой теории два необычных предположения (постулата):
1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам.
2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии.
Таким образом, Бор предположил, что электрон в атоме не подчиняется законам классической физики. Согласно Бору, излучение или поглощение энергии определяется переходом из одного состояния в другое, что соответствует переходу электрона с одной стационарной орбиты на другую. При таком переходе излучается или поглощается энергия.
Бор рассчитал частоты линий спектра атома водорода, которые очень хорошо согласовывались с экспериментальными значениями, но было обнаружено также и то, что для других атомов эта теория не давала удовлетворительных результатов.
Квантовая модель строения атома. В последующие годы некоторые положения теории Бора были переосмыслены и дополнены. Наиболее существенным нововведением явилось понятие об электронном облаке, которое пришло на смену понятию об электроне только как частице. Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
Свойства элементарных частиц, образующих атом
| Частица | Заряд | Масса | ||
| Кл | условн. ед. | г | а.е.м. | |
| Электрон | -1,6∙10-19 | -1 | 9,10∙10-28 | 0,00055 |
| Протон | 1,6∙10-19 | +1 | 1,67∙10-24 | 1,00728 |
| Нейтрон | 1,67∙10-24 | 1,00866 |
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv, где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот.(принцип неопределённости Гейзенберга). Математическим выражением принципа неопределенности служит соотношение
∆x∙m∙∆v > ћ/2, где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
4. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: А — массовое число, Z — заряд ядра, равный числу протонов, равный порядковому номеру в таблице, равный числу электронов и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями: Z = А – N, N = А – Z, А= Z + N.
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики
Источник
Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные свойства соответствующего простого вещества.
Для многоэлектронного атома существуют также понятия второго, третьего и т. д. ионизационных потенциалов, представляющих собой энергию удаления электрона от его свободных невозбуждённых катионов с зарядами +1, +2 и т. д. Эти ионизационные потенциалы, как правило, менее важны для характеристики химического элемента.
Энергия ионизации всегда имеет эндоэнергетическое значение (это понятно, так как чтобы оторвать электрон от атома, требуется приложить энергию, самопроизвольно это произойти не может).
На энергию ионизации атома наиболее существенное влияние оказывают следующие факторы:
- эффективный заряд ядра, являющийся функцией числа электронов в атоме, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях;
- радиальное расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо связанного с атомом и покидающего его при ионизации, электрона;
- мера проникающей способности этого электрона;
- межэлектронное отталкивание среди наружных (валентных) электронов.
На энергию ионизации оказывают влияние также и менее значительные факторы, такие, как квантовомеханическое обменное взаимодействие, спиновая и зарядовая корреляция и др.
Энергии ионизации элементов измеряется в Электронвольт на 1 атом или в Джоуль на моль.
Энергии ионизации элементов.
| Элемент | I1 | I2 | I3 | I4 | I5 | I6 | I7 |
|---|---|---|---|---|---|---|---|
| Na | 495,8 | 4564 | — | — | — | — | — |
| Mg | 737,7 | 1451 | 7730 | — | — | — | — |
| Al | 577,6 | 1817 | 2744 | 11600 | — | — | — |
| Si | 786,5 | 1577 | 3228 | 4350 | 16100 | — | — |
| P | 1011,8 | 1904 | 2910 | 4950 | 6270 | 21200 | — |
| S | 999,6 | 2253 | 3380 | 4565 | 6950 | 8490 | 27000 |
| Cl | 1251,2 | 2296 | 3850 | 5160 | 6560 | 9360 | 11000 |
| Ar | 1520,6 | 2666 | 3946 | 5770 | 7230 | 8780 | 12000 |
Энциклопедичный YouTube
1/3
Просмотров:
6 801
597
4 686
✪ Закономерности в периодической таблице. Энергия ионизации
✪ Тесты по химии. Энергия ионизации. А13 ЦТ 2008 по химии
✪ № 24. Неорганическая химия. Тема 3. Периодический закон. Часть 11. Энергии ионизации и ЭО
Думаю, пришло время обсудить
некоторые закономерности периодической таблицы.
Начнём с того, что преподают
в начальном курсе химии и что включают
в стандартные экзаменационные тесты.
С энергии ионизации.
Энергия ионизации.
Это величина энергии,
необходимой для того, чтобы отнять электрон у
нейтрального атома.
Минимальная
энергия отрыва электрона… Минимальная энергия отрыва электрона. И если вы не знаете, что
такое ион, то самое время
объяснить это вам.
Потому что это очень важно.
Ион — это по сути атом или молекула.
Вы знаете,
молекулы — это такие сочетания
атомов, связанных друг с другом.
Будут ещё ролики по этим связям.
У этих атомов или молекул количество протонов не совпадает
с числом электронов.
Из-за этого несовпадения возникает
заряд.
Если протонов больше, чем электронов, заряд будет
положительным.
Взять, например, водород.
Атом водорода.
Нейтральный,
без заряда.
Теперь отнимем у него электрон.
Электрон у водорода 1.
Всего 1 электрон.
Если отнять электрон, останется только
протон.
Будет заряд +1.
У электрона −1.
Отняв этот электрон,
мы изменили атом.
Ионизировали его,
отняв электрон.
Итак, мы ионизировали его, отняв электрон.
Такой ион, количество протонов в котором
превышает количество электронов,
называется
катионом.
Катион — положительно заряженный ион.
Возможна и противоположная ситуация.
Рассмотрим на примере другого элемента.
Давайте возьмём хлор.
Он обозначается таким
способом.
У атома хлора 7 валентных электронов.
Почему бы не добавить 1?
Это сделает атом чрезвычайно стабильным.
У него будет 8 валентных электронов и
отрицательный заряд.
Вот отрицательно заряженный ион.
Это анион.
Анион.
Насколько я помню, приставка «a» в большинстве
случаев означает
отрицание.
Надеюсь я прав.
Анион — отрицательный ион.
Катион — его противоположность.
Выходит, что энергию ионизации можно
назвать энергией катионизации,
ведь это именно энергия отрыва электрона.
Это энергия, необходимая для превращения
в катион.
Вы уже знакомы с периодической таблицей.
Вот она.
Сама таблица содержит данные о том, какие элементы
охотно отдадут электрон, а какие —
не очень.
Давайте по порядку,
начнём с первой группы.
Вот она.
Мы начнём с щелочных металлов.
Опустим пока водород.
Давайте поговорим вот об этих.
Чтобы на внешнем уровне у них оказалось
8 электронов, им проще
отдать свой единственный валентный
электрон.
Взять, например… например, калий.
У калия 1 валентный электрон на 4-м уровне.
Если его отдать, будет
8 на 3-м.
Он получит электронную конфигурацию аргона.
И это выгодно.
Эти элементы охотно отдают электроны.
Для отрыва электрона им нужно очень малое
количество энергии. Очень малое.
Малая энергия ионизации.
И причина здесь очевидна.
А что здесь?
Возьмём неон.
Легко ли отнять его электрон?
У неона всё хорошо.
Он не хочет вступать в реакции,
образовывать связи.
Его всё устраивает,
он абсолютно счастлив.
А что касается электрона,
неон очень не хочет его отдавать.
Неон, криптон, аргон — это инертные газы.
Чтобы отнять у них электроны, нужна огромная
энергия.
Большая энергия ионизации.
По мере продвижения слева направо
энергия возрастает.
Эту закономерность не обязательно
запоминать.
Вот смотрите: у этих элементов на 1 электрон больше.
У них
2 электрона.
И для октета им
проще отдать
оба электрона.
Но отдавать электрон они будут уже не так
охотно, потому что
щелочным металлам в этом
отношении просто.
Что лежит в основе этой закономерности?
Этот элемент ни при каких условиях не
отдаст электрон.
А этот элемент близок к неону и не
захочет отступать и становиться
похожим на кислород.
Он не отдаст свой электрон.
Такая закономерность.
Если запутаетесь, посмотрите на
крайности.
Этот элемент отдаёт электроны.
А этот — отбирает.
А что насчёт энергии отрыва
электрона?
Этот элемент сам его отдаст.
А у этого и у неона
его не отнять.
А что по вертикали?
Например, сверху вниз,
в пределах группы.
Мы уже знаем, что щелочные металлы охотно
отдают электроны.
Чем ниже, тем больше
электронное облако.
У нейтрального атома цезия 55 электронов,
и его 55-й электрон
находится гораздо дальше
от ядра атома, чем 3-й электрон
лития.
Я повторю. Его 55-й электрон находится гораздо дальше от ядра атома, нежели 3-й электрон лития.
Это 55-й электрон, который не только стремится оторваться,
он ещё и гораздо слабее привязан
к ядру, нежели 3-й электрон лития.
Чем ниже элемент в группе,
тем больше атом и тем дальше
электроны от ядра.
Их становится гораздо проще оторвать.
Верно?
И энергия ионизации снижается.
Хотя ксенон не хочет отдавать свои электроны,
ему приходится тяжелее, чем неону.
Выходит, что энергия ионизации, необходимая
для отрыва электрона, растёт снизу вверх.
Итак, энергия ионизации, необходимая для отрыва электрона, растёт снизу вверх.
Это совсем не обязательно запоминать.
Это может пригодиться на экзамене,
но потом вы и не вспомните, например,
у кого энергия ионизации выше: у цезия
или фтора.
Если вы посмотрите на периодическую
таблицу, то увидите, что у цезия всего 1 электрон, который
он отдаст.
Он очень далёк от ядра атома.
55-й электрон очень легко потерять.
А фтору к своим 9 электронам нужен всего 1, чтобы
стать неоном.
А неон стабилен.
У него полный октет электронов.
Они близки
к ядру и сильно притягиваются
к протонам ядра.
Эти электроны не отобрать.
Если говорить об энергии отрыва,
у цезия она очень низкая,
у гелия — очень высокая.
Такова закономерность.
Она всего лишь выражает готовность элемента
отдавать электроны.
Отдавать свои электроны или же
удерживать их.
А вот то, что я взял из Википедии.
Это реальные
значения энергии ионизации.
Людям нравятся такие графики. Не уверен, что
они их понимают,
но такие графики пользуются популярностью.
Они соответствуют периодической таблице.
С увеличением числа протонов в атоме
и соответствующим увеличением числа электронов
наблюдается периодическая зависимость
энергии ионизации.
Это водород.
Его энергия ионизации около 13,5
электрон-вольт.
Это единица энергии.
Их можно перевести в джоули.
Гелий намного стабильнее.
Чтобы отнять его 2-й электрон, нужно
почти вдвое больше энергии.
Продолжим. После гелия,
вот в этой точке, будет литий.
Литий.
Порядковый номер — 3.
Я запишу.
Это литий.
Чтобы отнять электрон у лития, нужно
всего 5 электрон-вольт.
Вдвое меньше, чем для водорода.
По мере продвижения по таблице вправо
энергия ионизации растёт.
С такими зазубринами.
О них мы ещё будем говорить.
Энергия ионизации растёт по направлению к неону.
У неона она высокая.
Неон — инертный газ, он стабилен.
Следующий идёт натрий.
Вы знаете, что у натрия легко отнять
электрон.
Энергия ионизации падает.
Она становится ниже, чем даже
у лития.
И так везде.
Здесь инертные газы.
Лучше я, давайте, передвину экран. Вот таким образом.
Гелий.
Почти невозможно отнять электрон.
Неон.
Сложно, но проще, чем у гелия.
Это потому, что атом неона больше,
и электроны находятся дальше от ядра.
Аргон.
То же самое, и вот что интересно:
энергия ионизации почти такая же, как у водорода.
Криптон.
То же самое.
Электрон отнять тяжело,
но сделать это не сложнее, чем
у водорода.
Далее, ксенон.
А правее всех — радон… радон.
Вы спросите, почему такое большое
расстояние.
Вспомните периодическую таблицу.
После аргона идёт
блок d-элементов.
Обратите внимание:
здесь только s- и p-элементы.
Внезапно появляются d-элементы.
Больше подуровней нужно заполнить.
А перед радоном заполняется
уже f-подуровень.
Перед радоном заполняется f-подуровень.
Именно по этой причине расстояние
настолько возрастает.
Здесь применяются
общие закономерности.
Чем правее элемент в таблице, тем сложнее
отнять его электрон,
потому что атом стремится к октету.
Особенно сложно — у инертных газов.
А вот щелочные металлы охотно
отдают электрон, чтобы получить
конфигурацию неона.
Но даже инертные газы подвержены
снижению энергии ионизации с увеличением
радиуса атома,
иными словами, при движении по таблице в направлении вниз.
Так что валентные электроны радона держатся
слабее, чем валентные электроны гелия.
Ну вот и всё об энергии ионизации.
В следующем ролике я расскажу о
металлических свойствах и
электроотрицательности.
Subtitles by the Amara.org community
Примечания
- ↑ Ахметов Н. С. Актуальные вопросы курса неорганической химии. — М.:Просвещение, 1991. — 224 с. ISBN 5-09-002630-0. 36
Ссылки
- Periodic Table of the Elements First Ionization Potential
Источник
