Как опытным путем доказать в каких пробирках содержатся растворы

В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
Вариант 1
а) гидроксид натрия;
б) карбонат калия;
в) хлорид бария.
Вариант 2
а) карбонат кальция;
б) сульфат натрия;
в) хлорид калия.
Вариант 3
а) нитрат бария;
б) сульфат натрия;
в) карбонат кальция.
Вариант 4
а) хлорид натрия;
б) хлорид алюминия;
в) хлорид железа (III).
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
После этой части работы выполните одну-две экспериментальные задачи из следующего перечня (по указанию учителя).
Задача 1
Докажите опытным путём, что железный купорос, образец которого вам выдан, содержит примесь сульфата железа (III). Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Задача 2
Получите оксид железа (III), исходя из хлорида железа (III). Напишите уравнения соответствующих реакций, а уравнение реакции с участием электролита и в ионном виде.
Задача 3
Получите раствор алюмината натрия, исходя из хлорида алюминия. Запишите уравнения проделанных реакций в молекулярном и ионном виде.
Задача 4
Получите сульфат железа (II), исходя из железа. Запишите уравнения проделанных реакций и разберите окислительно-восстановительные процессы.
Ответ
Вариант 1
Доказать содержимое пробирок можно с помощью раствора серной кислоты. Для этого прильём немного воды в пробирки с сухими веществами, и растворим их содержимое, а потом в каждую прильём раствор кислоты.
а) Видимых изменений нет:
2NaOH + H2SO4 ⟶ Na2SO4 + 2H2O
2Na+ + 2OH- + 2H+ + SO42- ⟶ 2Na+ + SO42- + 2H2O
2Na+ + SO42- ⟶ H2O
б) Выделится газ:
K2CO3 + H2SO4 ⟶ K2SO4 + H2O + CO2↑
2K+ + CO32- + 2H+ + SO42- ⟶ 2K+ + SO42- + H2O + CO2↑
2H+ + CO32- ⟶ H2O + CO2↑
в) Выпадет белый осадок:
BaCl2 + H2SO4 ⟶ 2HCl + BaSO4↓
Ba2+ + 2Cl- + 2H+ + SO42- ⟶ 2H+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
Вариант 2
Прильём немного воды в пробирки с сухими веществами, и перемешаем их содержимое.
а) Содержимое пробирки не растворилось, а после добавления раствора кислоты выделится газ:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- ⟶ Ca2+ + 2Cl- + H2O + CO2↑
CaCO3 + 2H+ ⟶ Ca2+ + H2O + CO2↑
В пробирки, в которых произошло растворение веществ, добавим хлорида бария.
б) Выпал белый осадок:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
2Na+ + SO42- + Ba2+ + 2Cl- ⟶ 2Na+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
в) Видимых изменений нет:
KCl + BaCl2 ⇸
Вариант 3
Прильём немного воды в пробирки с сухими веществами, и перемешаем их содержимое. В пробирки, где произошло растворение веществ, прильём раствор хлорида бария.
а) Содержимое пробирки растворилось, при добавлении хлорида бария изменений нет:
Ba(NO3)2 + BaCl2 ⇸
б) Содержимое пробирки растворилось, при добавлении хлорида бария выпал белый осадок:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
2Na+ + SO42- + Ba2+ + 2Cl- ⟶ 2Na+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
в) Содержимое пробирки не растворилось, после добавления раствора кислоты выделился газ:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- ⟶ Ca2+ + 2Cl- + H2O + CO2↑
CaCO3 + 2H+ ⟶ Ca2+ + H2O + CO2↑
Вариант 4
Доказать содержимое пробирок можно с помощью раствора щелочи. Для этого прильём немного воды в пробирки с сухими веществами, и растворим их содержимое, а потом в каждую прильём щелочь.
а) Изменений не наблюдается.
NaCl + NaOH ⇸
б) Выпал белый осадок:
AlCl3 + 3NaOH ⟶ 3NaCl + Al(OH)3↓
Al3+ + 3Cl- + 3Na+ + 3OH- ⟶ 3Na+ + 3Cl- + Al(OH)3↓
Al3+ + 3OH- ⟶ Al(OH)3↓
в) Выпал бурый осадок:
FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe3+ + 3Cl- + 3Na+ + 3OH- ⟶ 3Na+ + 3Cl- + Fe(OH)3↓
Fe3+ + 3OH- ⟶ Fe(OH)3↓
Задача 1
Доказать, что железный купорос содержит примесь сульфата железа (III), можно с помощью качественной реакции на ионы Fe3+, для этого используем желтую кровяную соль, в результате реакции выпадет синий осадок:
2Fe2(SO4)3 + 3K4[Fe(CN)6] ⟶ 6K2SO4 + Fe4[Fe(CN)6]3↓
4Fe3+ + 6SO42- + 12K+ + 3[Fe(CN)6]4- ⟶ 12K+ + 6SO42- + Fe4[Fe(CN)6]3↓
4Fe3+ + 3[Fe(CN)6]4- ⟶ Fe4[Fe(CN)6]3↓
Задача 2
FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe3+ + 3Cl- + 3Na+ + 3OH- ⟶ 3Na+ + 3Cl- + Fe(OH)3↓
Fe3+ + 3OH- ⟶ Fe(OH)3↓
2Fe(OH)3 t ⟶ Fe2O3 + 3H2O
Задача 3
AlCl3 + 3NaOH ⟶ 3NaCl + Al(OH)3↓
Al3+ + 3Cl- + 3Na+ + 3OH- ⟶ 3Na+ + 3Cl- + Al(OH)3↓
Al3+ + 3OH- ⟶ Al(OH)3↓
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
Al(OH)3 + Na+ + OH- ⟶ Na+ + [Al(OH)4]-
Al(OH)3 + OH- ⟶ [Al(OH)4]-
Задача 4
| CuSO4 + Fe ⟶ FeSO4 + Cu | ||
| Cu+2 + 2ē ⟶ Cu0 | 1 | окислитель (восстановление) |
| Fe0 – 2ē ⟶ Fe+2 | 1 | восстановитель (окисление) |
Источник
Другие задания смотри здесь…
![]()
Реактивы: раствор натрий гидроксида, разбавленная сульфатная кислота, а также промывалка с водой и стеклянные палочки. Дополнительный реактив: раствор аргентум (І) нитрата.
ВАРИАНТ І
Задание 1. Распознавание твердых соединений.
В трех произвольно пронумерованных пробирках находятся белые порошки калий нитрата, натрий карбоната и кальций карбоната. Определите содержимое каждой пробирки.
Ход работы
Добавляем к содержимому каждой пробирки 1-2 мл разбавленной сульфатной кислоты. В двух пробирках наблюдаем выделение большого количества углекислого газа, напоминает “закипание” воды, причем в одной из пробирок раствор становится мутным. Следовательно в этой пробирке содержится кальций карбонат, а в другой пробирке – натрий карбонат. Соответственно в третьей пробирке – калий нитрат.
CaCO3 + H2SO4 = CaSO4↓ + H2O + CO2↑
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
2Na+ + CO32- + 2H+ + SO42- = 2Na+ + SO42- + H2O + CO2↑
2H+ + CO32- = H2O + CO2↑
№ пробирки | Формула реактива | Наблюдения | Вывод (формула соединения) |
| 1 | H2SO4 | выделяется углекислий газ и раствор становится мутным | CaCO3 |
| 2 | H2SO4 | выделяется углекислий газ | Na2CO3 |
| 3 | H2SO4 | – | KNO3 |
Задание 2. Распознавание растворов соединений.
В трех произвольно пронумерованных пробирках находятся бесцветные растворы натрий хлорида, магний хлорида и цинк сульфата. Определите содержимое каждой пробирки..
Ход работы
1. Добавляем к содержимому каждой пробирки 1-2 мл натрий гидроксида. В двух пробирках наблюдаем образование белого осадка. Следовательно в третьей пробирке без осадка содержится раствор натрий хлорида.
MgCl2 + 2NaOH = 2NaCl + Mg(OH)2↓
Mg2+ + 2Cl- + 2Na+ + 2OH- = 2Na+ + 2Cl- + Mg(OH)2↓
Mg2+ + 2OH- = Mg(OH)2↓
ZnSO4 + 2NaOH = Na2SO4 + Zn(OH)2↓
Zn2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Zn(OH)2↓
Zn2+ + 2OH- = Zn(OH)2↓
2. Добавляем к содержимому двух пробирок с осадком в избытке щелочи. В одной из пробирок наблюдаем растворение осадка. Следовательно в этой пробирке содержится раствор цинк сульфата, а во второй пробирке – раствор магний хлорида.
Zn(OH)2↓ + 2NaOH = Na2[Zn(OH)4]
Zn(OH)2 + 2Na+ + OH- = 2Na+ +[Zn(OH)4]2-
Zn(OH)2 + OH- = [Zn(OH)4]2-
№ пробирки | Формула реактива | Наблюде- ния | Формула реактива в избыт- ке | Наблюде- ния | Вывод (формула соедине- ния) |
| 1 | NaOH | образование белого осадка | NaOH | растворение осадка | ZnSO4 |
| 2 | NaOH | образование белого осадка | NaOH | без изменений | MgCl2 |
| 3 | NaOH | – | – | – | NaCl |
Задание 3. Обнаружение ионов в растворе.
Выданный раствор содержит две соли Натрия — карбонат и ортофосфат. Докажите наличие в нем анионов СО32– и РО43–.
Ход роботы
1. Разделяем содержимое пробирок на две порции.
2. Добавляем к содержимому каждой пробирки первой порции 1 мл разбавленной сульфатной кислоты. В одной из пробирок наблюдаем выделение большого количества углекислого газа, напоминает “закипание” воды. Следовательно в этой пробирке раствор натрий карбоната.
Составляем молекулярное и ионно-молекулярное уравнения проведенной качественной реакции.
Na2СO3 + H2SO4 = Na2SO4 + H2O +CO2↑
2Na+ + СO32- + 2H+ + SO42- = 2Na+ + SO42- + H2O +CO2↑
2H+ + CO32- = H2O + CO2↑
3. Добавляем к содержимому каждой пробирки второй порции 2—3 капли раствора аргентум (І) нитрата. Наблюдаем появление желтого осадка аргентум (І) ортофосфата. Следовательно в этой пробирке раствор натрий ортофосфата.
Составляем молекулярное и ионно-молекулярное уравнения проведенной качественной реакции.
Na3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4↓
3Na+ + PO43- + 3Ag+ + 3NO3- = 3Na+ + 3NO3- + Ag3PO4↓
3Ag+ + PO43- = Ag3PO4↓
ВЫВОД: Карбонат-ионы СО32- в растворе обнаруживают с помощью катионов Гидрогена H+, , что содержатся в растворе кислоты, сильнее карбонатной. Особым внешним эффектом качественной реакции является образование углекислого газа СО2↑. Поднесенная к отверстию пробирки зажженная спичка перестает гореть и гаснет без всякого звукового эффекта или при пропускании этого газа в раствор кальций гидроксида образуется белый осадок кальций карбоната.
Ортофосфат-ионы PO43- в растворе обнаруживают с помощью катионов Аргентума Ag+, что содержатся в растворе аргентум (І) нитрата. Особым внешним эффектом качественной реакции является образование желтого осадка Ag3PO4↓, нерастворимого в воде и растворимого в нитратной кислоте.
ВАРИАНТ ІІ
Задание 1. Распознавание твердых соединений.
В трех произвольно пронумерованных пробирках находятся белые порошки натрий нитрата, магний карбоната и барий сульфата. Определите содержимое каждой пробирки.
Добавляем к содержимому каждой из трех пробирок 1-2 мл разбавленной сульфатной кислоты. В одной из пробирок наблюдаем выделение большого количества углекислого газа, напоминает “закипание” воды, следовательно в этой пробирке содержится магний карбонат. Во второй пробирке наблюдаем образование белого кристаллического осадка, следовательно в этой пробирке содержится нерастворимый в сильной кислоте барий сульфат. Соответственно в третьей пробирке содержится натрий нитрат.
MgCO3 + H2SO4 = MgSO4 + H2O + CO2↑
Mg2+ + CO32- + 2H+ + SO42- = Mg2+ + SO42- + H2O + CO2↑
2H+ + CO32- = H2O + CO2↑
№ пробирки | Формула реагента | Наблюдения | Вывод (формула соединения) |
| 1 | H2SO4 | выделение углекислого газа | MgCO3 |
| 2 | H2SO4 | образование белого кристаллического осадка | BaSO4 |
| 3 | H2SO4 | – | NaNO3 |
Задание 2. Распознавание растворов соединений.
В трех произвольно пронумерованных пробирках находятся бесцветные растворы калий нитрата, барий хлорида, алюминий сульфата. Определите содержимое каждой пробирки.
Ход работы
1. Разделяем содержимое пробирок на две порции.
2. Добавляем к содержимому каждой из трех пробирок первой порции 1-2 мл разбавленной сульфатной кислоты. В одной из пробирок наблюдаем образование белого мелкокристаллического осадка, нерастворимого в сильной кислоте, следовательно в этой пробирке содержится барий хлорид.
BaCl2 + H2SO4 = 2HCl + BaSO4↓
Ba2+ + 2Cl- + 2H+ + SO42- = 2H+ + 2Cl- + BaSO4↓
Ba2+ + SO42- = BaSO4↓
2. Добавляем к содержимому остальных двух пробирок второй порции 1-2 мл раствора натрий гидроксида. В одной из пробирок наблюдаем образование белого осадка, следовательно в этой пробирке содержится раствор алюминий сульфата. Соответственно в другой пробирке – раствор калий нитрата.
Al2(SO4)3 + 6NaOH = 3Na2SO4 + 2Al(OH)3↓
2Al3+ + 3SO42- + 6Na+ + 6OH- = 6Na+ + 3SO42- + Al(OH)3↓
2Al3+ + 6OH- = Al(OH)3↓
Al3+ + OH- = Al(OH)3↓
№ пробир- ки | Формула реактива | Наблюдения | Формула реактива | Наблюдения | Вывод (формула соединения) |
| 1 | H2SO4 | образование белого мелко- кристалличес- кого осадка | – | – | BaSO4 |
| 2 | H2SO4 | без изменений | NaOH | образование белого осадка | Al2(SO4)3 |
| 3 | H2SO4 | без изменений | NaOH | – | KNO3 |
Задание 3. Виявление ионов в растворе.
Выданный раствор содержит две соли Калия — карбонат и иодид. Докажите наличие в нем анионов СО32– та І–.
Ход работы
1. Разделяем содержимое пробирок на две порции.
1. Добавляем к содержимому каждой пробирки первой порции 1 мл разбавленной сульфатной кислоты. В одной из пробирок наблюдаем выделение большого количества углекислого газа, напоминает “закипание” воды, следовательно в этой пробирке содержится раствор калий карбоната.
Составляем молекулярное и ионно-молекулярное уравнения проведенной качественной реакции.
K2СO3 + H2SO4 = K2SO4 + H2O +CO2↑
2K+ + СO32- + 2H+ + SO42- = 2K+ + SO42- + H2O +CO2↑
2H+ + CO32- = H2O + CO2↑
2. Добавляем к содержимому каждой пробирки второй порции 2—3 капли раствора аргентум (І) нитрата. Наблюдаем образование желтого творожистого осадка аргентум (І) иодида, следовательно в этой пробирке содержится раствор калий иодида.
Составляем молекулярное и ионно-молекулярное уравнения проведенной качественной реакции.
KI + AgNO3 = KNO3 + AgI↓
K+ + I- + Ag+ + NO3- = K+ + NO3- + AgI↓
Ag+ + I- = AgI↓
ВЫВОД: Карбонат-ионы СО32- в растворе обнаруживают с помощью катионов Гидрогена H+, что содержатся в растворе кислоты, сильнее карбонатной. Особым внешним эффектом качественной реакции является образование углекислого газа СО2↑. Поднесенная к отверстию пробирки зажженная спичка перестает гореть и гаснет без всякого звукового эффекта или при пропускании этого газа в раствор кальций гидроксида образуется белый осадок кальций карбоната.
Иодид-ионы I- в растворе обнаруживают с помощью катионов Аргентума Ag+, что содержатся в растворе аргентум (І) нитрата. Особым внешним эффектом качественной реакции является образование желтого творожистого осадка AgI↓, нерастворимого в нитратной кислоте.
Другие задания смотри здесь…
Источник
1) Различить вещества: а) MgCl2; б) NaOH; в) Na2CO3; г) NaNO3;
а)
Действия
: Ко всем веществам добавляем р-р соляной кислоты.
Наблюдения
: В одной из пробирок выделяется газ.
Уравнения реакции:

Выводы:
В данной пробирке содержится карбонат натрия, т.к. протекает качественная реакция на карбонат-ион. б)
Действия
: Оставшиеся вещества растворяем в воде и к полученным растворам добавляем фенолфталеин.
Наблюдения
: В одной из пробирок раствор розовеет.
Уравнения реакции:

Выводы:
Раствор фенолфталеина розовеет в щелочной среде (под действиям ионов OH- ), поэтому в данной пробирке находится гидроксид натрия. в)
Действия
: К оставшимся растворам добавляем раствор нитрата серебра (I).
Наблюдения
: В одной из пробирок образовался белый осадок.
Уравнения реакции:

Выводы:
Эта реакция качественная на хлорид-ион, значит, в данной пробирке находится хлорид магния. г)
Действия
: К оставшемуся раствору добавляем концентрированную серную кислоту и кусочек меди. Нагреваем.
Наблюдения
: Выделяется газ бурого цвета, медь растворяется, а раствор становится голубого цвета.
Уравнения реакции:

Выводы:
Реакция является качественной на нитрат-ион, следовательно, в данной пробирке находится нитрат натрия.
2) Различить вещества: а) CaCO3; б) Ba(NO3)2; в) Na2SO4; г) Na2S
а)
Действия
: Ко всем веществам добавляем р-р соляной кислоты.
Наблюдения
: В одной из пробирок выделяется газ без запаха, а в другой – с неприятным запахом.
Уравнения реакции:

Выводы:
В пробирке, в которой выделялся газ без запаха, содержится

т. к. это качественная реакция на карбонат-ион. Там, где выделялся газ с неприятным запахом

содержится сульфид натрия. б)
Действия
: После растворения оставшихся веществ в воде добавляем раствор сульфата натрия.
Наблюдения
: В одной из пробирок образовался белый осадок.
Уравнения реакции:

Выводы:
Качественная реакция на ион бария, значит, в данной пробирке – нитрат бария. в)
Действия
: К оставшемуся р-ру добавляем р-р хлорида бария.
Наблюдения
: Образовался белый осадок.
Уравнения реакции:

Выводы:
Это качественная реакция на сульфат-ион, следовательно, в данной пробирке – сульфат натрия.
3) Доказать, что выданное вещество – сульфат алюминия Al2(SO4)3
а)
Действия
: К выданному в-ву добавляем раствор хлорида бария.
Наблюдения
: Выпал белый осадок.
Уравнения реакции:

Выводы:
Это качественная реакция на сульфат-ион. б)
Действия
: К небольшому количеству раствора щелочи добавляем раствор выданного вещества.
Наблюдения
: Образовался белый студенистый осадок.
Уравнения реакции:

Выводы:
В результате происходит образование нерастворимого основания

за счет связывания ионов

Значит, в исследуемом веществе содержится ион алюминия. в)
Действия
: Добавляем избыток щелочи.
Наблюдения
: В избытке щелочи осадок растворяется.
Уравнения реакции:

Выводы:
Гидроксид обладает амфотерными свойствами: образуется матааллюминат натрия. Это еще раз доказывает, что выданное вещество содержит ион алюминия.
4) Различить растворы: NaCL, BaCl2, AlCl3
а)
Действия
: Ко всем растворам добавляем р-р сульфата натрия.
Наблюдения
: В одной из пробирок выпадает белый осадок.
Уравнения реакции:

Выводы:
В данной пробирке содержится хлорид бария, т.к. эта реакция – качественная на ионы бария. б)
Действия
: К двум оставшимся растворам добавляем немного раствора щелочи.
Наблюдения
: В одной из пробирок образовался белый студенистый осадок.
Уравнения реакции:

Выводы:
В данной пробирке – хлорид алюминия. в)
Действия
: Несколько капель оставшегося раствора вносим в пламя спиртовки на нихромовой проволоке.
Наблюдения
: Пламя окрашивается в желтый цвет.
Выводы:
В данной пробирке – хлорид натрия, т.к. в желтый цвет пламя окрашивают ионы натрия.
5) Доказать, что кристаллы FeSO4 частично окислились и содержат примеси ионов Fe3+
Действия
: Растворяем кристаллы в воде и добавляем р-р

Наблюдения
: Образуется зеленый и бурый осадки.
Уравнения реакции:
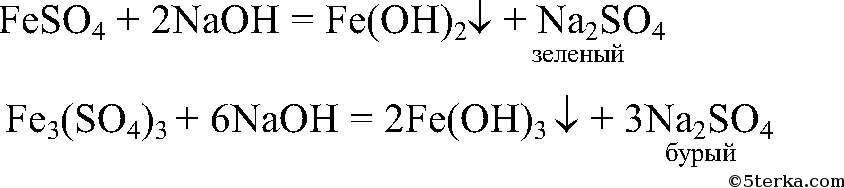
Выводы:
Бурый осадок – нерастворимое основание


имеет зеленый цвет. Значит, в исходном

содержались окислившиеся ионы

6) В двух склянках дана вода. В одной из них вода содержит MgSO4, а в другой – Ca(HCO3)2. Проделать опыты, при помощи которых можно устранить постоянную и временную жесткость.
а)
Действия
: В воду, содержащую

добавляем р-р

Наблюдения
: Образуется белый осадок.
Уравнения реакции:

Выводы:
Ионы

обуславливают постоянную жесткость воды. Такую воду можно умягчить, добавив раствор карбоната натрия, т. к. при этом происходит связывание ионов

б)
Действия
: В воду, содержащую

добавляем: раствор

известковое молоко, т.е. насыщенный раствор

кипятим ее.
Наблюдения
: Образуется белый осадок.
Уравнения реакции:

Выводы:
Присутствие

обуславливает временную жесткость воды. Эту воду можно умягчить добавлением известкового молока, соды или кипячением, т.к. все эти процессы сопровождаются образованием

7) Осуществить превращения:
а) Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe(NO3)3
1.
Действия
: К порошку железа добавляем соляную кислоту.
Уравнения реакции:

2.
Действия
: После прекращения выделения газа добавляем раствор щелочи.
Уравнения реакции:

3.
Действия
: К осадку добавляем немного р-ра перекиси водорода.
Уравнения реакции:
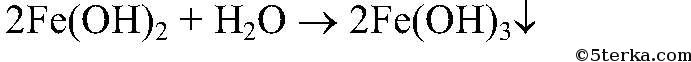
4.
Действия
: К осадку добавляем раствор азотной кислоты
Уравнения реакции:

б) Al → Al(SO4)3 → Al(OH)3 → NaAlO2
1.
Действия
: К нескольким гранулам

добавляем р-р

Уравнения реакции:

2.
Действия
: После выделения газа добавляем щелочь (по каплям).
Уравнения реакции:

3.
Действия
: К осадку добавляем избыток щелочи.
Уравнения реакции:

Источник
Практическая работа№1
«Решение экспериментальных задач по темам «Важнейшие классы неорганических соединений и «Реакции ионного обмена»
Вспомните правила техники безопасности при работе в химическом кабинете.
Задание №1. Опытным путем определите, в какой из выданных вам пробирок содержится:
А) раствор соляной кислоты;
Б) раствор гидроксида натрия;
В) дистиллированная вода.
Задание№2. В одной пробирке находится гидроксид магния, а в другой – гидроксид цинка. Определите, в какой пробирке находится каждое из этих веществ. Составьте уравнения соответствующих реакций в молекулярном и ионно-молекулярном виде.
Задание№3. Вам выдан оксид. С помощью химических реакций определите, кислотный он или основной.
Составьте уравнение соответствующих реакций в молекулярном и ионно-молекулярном виде.
Задание №4. В шести пробирках находятся растворы сульфата меди(11). В каждую из пробирок последовательно прилейте следующие растворы:
А) сульфида натрия;
Б) нитрата калия;
В) гидроксида натрия;
Г) хлорида бария;
Д) соляной кислоты;
Е) сероводородной кислоты.
Составьте уравнения реакций, протекающих до конца, в молекулярном и ионно-молекулярном виде.
Задание№5. Осуществите практически следующие превращения и напишите уравнения следующих реакций:
а)Cu CuO CuCl2 Cu(OH)2 CuO
б) ZnO ZnCl2 Zn(OH)2 ZnSO4
Na 2ZnO2
в) C CO2 Ca CO3 Ca Cl2
Задание№6. Осуществите реакции, схемы которых даны:
А) Ва2+ + SO42- = BaSO4
Б) Н+ + ОН – = Н2О
В) СО32- + 2Н+ = СО2 + Н2О
Задание №7. Вам выдана смесь медных и цинковых опилок. Выделите из этой смеси медные опилки химическим способом. Напишите уравнения реакций.
Практическая работа№2
«Галогены»
Изучение свойств соляной кислоты
В пять пробирок налейте раствор соляной кислоты. В первую пробирку добавьте 1-2 капли лакмуса и прилейте по каплям раствор гидроксида натрия до полной нейтрализации кислоты.
Напишите уравнения электролитической диссоциации соляной кислоты и сокращенное ионно-молекулярное уравнение реакции нейтрализации.
Во вторую пробирку положите кусочек цинка, в третью – кусочек меди.
Отметьте, что происходит. Напишите уравнения протекающей реакции, коэффициенты расставьте методом электронного баланса. В выводе укажите ион-окислитель и с каким металлом реагирует соляная кислота.
В четвертую пробирку добавьте немного оксида меди(11), осторожно перемешайте и нагрейте, а в пятую – мела. Что наблюдаете?
Напишите молекулярное, полные и сокращенные ионно-молекулярные уравнения. В общем выводе охарактеризуйте химические свойства соляной кислоты.
Решение экспериментальных задач по теме «Галогены»
Задание№1.Докажите опытным путем, что в состав соляной кислоты входят ионы водорода и хлора.
Задание №2. Определите, не содержит ли данный вам раствор нитрата натрия примеси хлорида.
Задание№3. Определите, в какой из выданных вам 3-х пробирок с твердыми веществами находятся хлорид бария, бромид натрия, иодид натрия.
Составьте уравнения всех реакций в молекулярном и ионно-молекулярном виде.
Отчет о проделанной работе представьте в виде таблицы:
№опыта | Ход работы | наблюдения | уравнения | вывод |
1 | ||||
2 | ||||
3 | ||||
4 | ||||
5 | ||||
6 | ||||
7 | ||||
8 |
Практическая работа№3
«Решение экспериментальных задач по теме «Подгруппа кислорода»
Задача№1. Проведите реакции, подтверждающие, что в состав серной кислоты входят ионы водорода и сульфат-ион.
Задание№2. В две пробирки налейте раствор сульфида натрия. Прилейте в одну из них хлорную воду, а в другую бромную воду. Что наблюдаете? Объясните свои наблюдения.
Задание №3. Определите в какой из выданных вам пробирок с бесцветными растворами находится соляная кислота, а в какой – серная кислота, и в какой – гидроксид натрия.
Задание№4. Определите, содержит ли поваренная соль примесь сульфатов.
Задание№5. С помощью характерных реакций установите, является выданная вам соль сульфатом, хлоридом или иодидом.
Задание №6. Вам выданы три пробирки с сульфатом, сульфитом и сульфидом. Определите с помощью одного реактива, в какой пробирке находится каждое из указанных веществ.
Задание№7. Используя оксид меди (11), получите раствор сульфата меди и выделите из него кристаллический медный купорос.
Напишите уравнения всех реакций, для окислительно-восстановительных составьте схемы электронного баланса, для реакций ионного обмена – сокращенные ионно-молекулярные уравнения.
Отчет о проделанной работе представьте в виде таблицы:
№опыта | Ход работы | наблюдения | уравнения | вывод |
1 | ||||
2 | ||||
3 | ||||
4 | ||||
5 | ||||
6 | ||||
7 |
Практическая работа№4
«Получение аммиака и изучение его свойств»
Ознакомление со свойствами водного раствора аммиака
Опыт 1. Получение аммиака и растворение его в воде
1. В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония и порошка гидроксида кальция (немного влажного). Пробирку на одну треть заполните этой смесью и закройте ее пробкой с газоотводной трубкой. Затем пробирку со смесью укрепите так, чтобы дно пробирки было немного выше ее отверстия. На газоотводную трубку направленную вверх, наденьте сухую пробирку, закрепленную в штативе открытым концом вниз.(рис.60)Почему аммиак собирают в перевернутую вверх дном пробирку?
2. Пробирку со смесью прогрейте сначала всю, а затем нагревайте в том месте, где находится смесь. Обратите внимание на появление капель воды на стенках пробирки.
3. Когда пробирка заполнится аммиаком, не переворачивая, закройте пробкой, погрузите в сосуд с водой, затем откройте пробку. Почему вода в пробирке поднимается?
4. Когда вода в пробирке перестанет подниматься, отверстие пробирки закройте под водой пробкой и выньте ее из воды. В полученный раствор опустите красную лакмусовую бумажку. Напишите уравнения проведенных реакций. Какое вещество образуется при растворении аммиака в воде? Какое наблюдение подтверждает этот вывод?
Опыт 2. Образование хлорида аммония.
Смесь хлорида аммония и гидроксида кальция немного нагрейте, газоотводную трубку введите в пробирку, в которой налито 0,5 см3 концентрированной соляной кислоты. Конец газоотводной трубки должен находиться на расстоянии 5-6 мм от поверхности кислоты. Объясните появление белого дыма. Напишите уравнение реакции. Почему конец газоотводной трубки нельзя погрузить в кислоту.
Кислотно-основные свойства водного раствора аммиака
Опыт 1. Свойства водного раствора аммиака.
1. В пробирку налейте 2-3 см3 водного раствора аммиака и добавьте 2-3 капли фенолфталеина. Отметьте цвет раствора. Нагрейте этот раствор до кипения. Объясните появление окраски, составьте уравнение реакции.
2. В пробирку налейте 2-3 см3 водного раствора аммиака и добавьте 2-3 капли фенолфталеина. Затем приливайте по каплям раствор серной кислоты до исчезновения окраски индикатора. Объясните причину исчезновения окраски индикатора, составьте уравнение реакции.
Опыт 2. Использование водного раствора аммиака для получения гидроксидов металлов.
В пробирку с 2-3 мл раствора соли алюминия прилейте водный раствор аммиака. Что вы наблюдаете? Напишите ионно-молекулярные уравнения реакции( полное и сокращенное)
Возгонка хлорида аммония
В сухую пробирку внесите немного ( на донышке) хлорида аммония. Нагревая пробирку держите ее наклонно (см. рис. 36 на стр. 126). Объясните почему в верхней холодной части пробирки появляется белый налет?
Отчет о проделанной работе представьте в виде таблицы:
№опыта | Ход работы | Рисунок наблюдения | уравнения | вывод |
1 | ||||
2 | ||||
3 | ||||
4 | ||||
5 | ||||
6 | ||||
7 |
Практическая работа №5
Минеральные удобрения
Опыт 1. Сравнение растворимости фосфатов кальция.
В одну пробирку внесите фосфат кальция, в другую – гидрофосфат кальция, в третью – дигидрофосфат кальция ( по 1/5 чайной ложки). Прилейте в пробирки по 5 мл воды и размешайте смеси стеклянной палочкой. Объясните наблюдаемое.
Опыт 2. Ознакомление с минеральными удобрениями и их анализ.
Опыт 2.1. Опишите внешний вид выданных вам удобрений. Сравните их растворимость. Для этого насыпьте в пробирки по 1/5 чайной ложки каждого удобрения, прилейте в каждую пробирку по 5 мл воды и перемешайте, результаты наблюдения внесите в таблицу:
Название удобрения | Хим. формула | Внешний вид | Растворимость в воде |
Опыт 2.2. Докажите опытным путем, что сульфат аммония и нитрат аммония нельзя смешивать с известью перед внесением этих удобрений в почву и объясните почему. Напишите уравнения реакций.
Опыт 2.3. Докажите экспериментально, что:
А) в состав хлорида аммония входят ионы аммония и хлорид-ионы;
Б) в состав сульфата аммония входят ионы аммония и сульфат-ионы.
Составьте сокращенные ионно-молекулярные уравнения.
Опыт 2.4. На основании характерных реакций определите, к какой пробирке находится следующее удобрение:
А) хлорид калия;
Б) суперфосфат;
В) сульфат аммония.
Напишите уравнения происходящих реакций в сокращенном ионно-молекулярном виде.
Отчет о проделанной работе представьте в виде таблицы:
№опыта | Ход работы | Рисунок наблюдения | уравнения | вывод |
1 | ||||
2 | ||||
3 | ||||
4 | ||||
5 | ||||
6 | ||||
7 |
Практическая работа №6
Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов
Получение и свойства оксида углерода (IV)
1. Получите углекислый газ с помощью аппарата, заряженного мелом или мрамором и соляной кислотой (рис. 61). Напишите сокращенное ионно-молекулярное уравнение.
2. Наполните углекислым газом химический стакан, проверяя наполнение горящей лучинкой. Осторожно перелейте газ в другой стакан и испытайте горящей лучинкой содержимое обоих стаканов. Укажите, какие свойства углекислого газа лежат в основе этого опыта.
3. Налейте в пробирку 2-3 мл дистиллированной волы, добавьте несколько капель фиолетового лакмуса и пропускайте через него углекислый газ до изменения окраски индикатора. Объясните наблюдаемое. Составьте уравнение соответствующей реакции. Нагрейте содержимое до начала кипения. Объясните, почему снова изменился цвет лакмуса.
4. Налейте в пробирку 2-3 мл известковой воды и пропустите через нее углекислый газ до помутнения. Составьте уравнение реакции.
Продолжайте пропускать углекислый газ через мутную смесь до полного осветления раствора. Объясните, почему растворился карбонат кальция. Составьте уравнение реакции.
Полученный прозрачный раствор гидрокарбоната кальция нагрейте до кипения. Что вы наблюдаете. Объясните происходящее явление соответствующим уравнением реакции. Сделайте вывод:
А) каким образом карбонаты можно превратить в гидрокарбонаты;
Б) как можно гидрокарбонаты превратить в карбонаты.
Отношение карбонатов к действию кислот
В три пробирки насыпьте по1-2 г карбоната натрия, гидрокарбоната натрия и карбоната кальция. Прилейте в каждую пробирку по 1 мл соляной кислоты.
Как убедится, что при взаимодействии карбонатов с кислотой выделяется углекислый газ? Напишите уравнения реакций в молекулярном, полном и сокращенном ионно-молекулярном виде.
Распознавание карбонатов
Вам выданы три пробирки с растворами хлорида, карбоната и сульфата натрия. Определите опытным путем, в какой пробирке находится карбонат. Укажите, какая реакция является качественной на карбонат-ион. Составьте сокращенное ионно-молекулярное уравнение этой реакции.
Отчет о проделанной работе представьте в виде таблицы:
№опыта | Ход работы | Рисунок наблюдения | уравнения | вывод |
1 | ||||
2 | ||||
3 | ||||
4 | ||||
5 | ||||
6 | ||||
7 |
Практическая работа №7
Решение экспериментальных задач по теме «Металлы»
Опыт 1. Окрашивание пламени солями металлов
Налейте в одну пробирку раствор хлорида натрия, в другую – хлорида калия, в третью – хлорида кальция, в четвертую – хлорида меди.
В пламени спиртовки тщательно прокалите железную проволоку. Смочите ее, опустив в пробирку с раствором хлорида натрия, и внесите в пламя спиртовки, наблюдайте…окрашивание. Проволоку промойте в соляной кислоте и хорошо прокалите. Теперь смочите ее в растворе хлорида калия и внесите в пламя горелки, наблюдайте…окрашивание.
Убедитесь также, что соль хлорида кальция окрашивает пламя в… цвет, соль меди – в …цвет.
Опыт 2. В выданных вам трех пробирках содержатся хлориды натрия, магния и алюминия. Одним реактивом определите, в какой пробирке находится каждое из выданных вам веществ. Составьте уравнения приведенных реакций в молекулярном и ионно-молекулярном виде.
Опыт 3. В пробирка дан6ы хлорида натрия, калия и кальция. Определите опытным путем, какое вещество находится в каждой пробирке.
Опыт 4. В пробирках даны сульфаты железа (11), железа (111) и меди (11). Различите их, не использую реактивы.
Опыт 5. Докажите опытным путем, что железный купорос, образец которого вам дан, содержит примесь сульфата железа (111). Составьте сокращенное ионно-молекулярное уравнение.
Опыт 6. Приведите реакции, подтверждающие качественный состав хлорида железа (111) и сульфата железа (11
