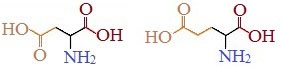
Какая функциональная группировка придает аминокислоте кислые свойства
Опубликовано 8 месяцев назад по предмету
Химия
от emailmuhamedx9
Не тот ответ, который вам нужен?
Найди нужный
Самые новые вопросы
Математика – 8 месяцев назад
Сколько здесь прямоугольников
История – 1 год назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
Литература – 1 год назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
Русский язык – 1 год назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
Русский язык – 1 год назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
Русский язык – 1 год назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
Физика – 1 год назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
Аминокислоты относятся к гетерофункциональным соединениям, т.е. вещества, проявляющим свойства двух классов соединений. В неорганической химии такие соединения называют амфотерными.
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений.
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной. $alpha$-аминокислоты являются амфотерными электролитами. Имея как минимум две диссоциирующие и противоположно заряженные группировки, аминокислоты в растворах с нейтральным значением рН практически всегда находятся в виде биполярных ионов, или цвиттер-ионов, в которых противоположные заряды пространственно разделены, например $H_3^+N—CH_2—CH_2—COO^-$.
Именно амфотерность аминокислот обуславливает их наиболее характерные свойства.
1. Кислотные свойства аминокислот проявляются по карбоксильной группе в их способности взаимодействовать, например, с щелочами:

или вступать в реакцию этерификации со спиртами с образованием сложных эфиров:

2. Основные свойства аминокислот проявляются по аминогруппе в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно-акцепторному механизму:

3. Амфотерность аминокислот проявляется также в их способности образовывать в растворе в результате диссоциации биполярный ион — внутреннюю соль, а самое главное, за счет амфотерности аминокислоты могут вступать друг с другом в реакции поликонденсации. образуя полипептиды и белки:

КАЧЕСТВЕННЫЕ (ЦВЕТНЫЕ) РЕАКЦИИ НА АМИНОКИСЛОТЫ И БЕЛКИ
Качественные цветные реакции можно подразделить на два типа: универсальные и специфические. К универсальным реакциям относятся те, которые дают окрашивание в присутствии любых белков.

Специфические реакции доказывают наличие какой-то определенной аминокислоты. Все качественные реакции можно наблюдать на примере раствора яичного белка, представляющего собой многокомпонентную смесь аминокислот:

УНИВЕРСАЛЬНЫЕ ЦВЕТНЫЕ РЕАКЦИИ
1. Биуретовая реакция – универсальная реакция на все белки и пептиды, так как является реакцией на пептидную связь. Представляет собой взаимодействие щелочного раствора биурета ($(H_2NC(O))_2NH$ с раствором сульфата меди в присутствии гидроксида натрия (реактив Фелинга).

В реакцию, подобную биуретовой, вступают многие вещества, содержащие в молекуле не менее двух амидных группировок, амиды и имиды аминокислот и некоторые другие соединения. Продукты реакции в этом случае имеют фиолетовую или синюю окраску.


В условиях биуретовой реакции белки дают фиолетовую окраску, что используется для их качественного и количественного анализа. Биуретовая реакция обусловлена присутствием в белках пептидных связей, которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные солеобразные комплексы меди.
2. Нингидриновая реакция – цветная реакция на α-аминокислоты, которую осуществляют нагреванием последних в избытке щелочного раствора нингидрина (гидрата 1,2,3-индантриона).


Образующееся в результате реакции соединение (дикетогидринимин – на рисунке самый левый продукт реакции) имеет фиолетово-синюю окраску. Данную используют для колориметрического количественного определения $alpha$-аминокислот, в том числе в автоматических аминокислотных анализаторах.
СПЕЦИФИЧЕСКИЕ ЦВЕТНЫЕ РЕАКЦИИ
1. Реакция Щульца-Распайли (аналогично проводится реакция Адамкевича, только с добавлением глиоксиловой кислоты) – является специфической реакцией на аминокислоту триптофан – взаимодействие раствора яичного белка с 10% раствором сахарозы и равным объемом концентрированной $H_2SO_4$. На границе двух жидкостей образуется красно-фиолетовое кольцо (при нагревании на водяной бане реакция идет быстрее – главное не смешивать жидкости).


2. Реакция Милона – используется для обнаружения тирозина, в составе которого имеется фенольный гидроксил. При добавлении к раствору белка реактива Милона (раствор $HgNO_3$ и $Hg(NO_3)_2$ в разбавленной азотной кислоты $HNO_3$, содержащей примесь азотистой кислоты $HNO_2$) образуется осадок, сначала окрашенный в розовый, а затем в пурпурно-красный цвет. Нагревание до $50^circ C$ ускоряет эту реакцию.


3. Ксантопротеиновая реакция – является специфической реакцией и используется для обнаружения $alpha$-аминокислот, содержащих в радикале ароматический цикл, например фенилаланина. Для ее осуществления к раствору белка прибавляют концентрированную азотную кислоту $HNO_3$ до тех пор, пока не прекратится образование осадка, который при нагревании окрашивается в желтый цвет. Окраска возникает в результате нитрования ароматических колец аминокислотных остатков белка (тирозина и триптофана). При добавлении к охлажденной жидкости избытка щелочи появляется оранжевое окрашивание, обусловленное образованием солей нитроновых кислот.



4. Реакция Фоля на серосодержащие аминокислоты (цистеин, метионин) – взаимодействие раствора яичного белка с 30% раствором NaOH и 5% раствором уксуснокислого свинца – $Pb(CH_3COO)_2$. При длительном нагревании жидкость буреет, выпадает черный осадок сульфида свинца.


Источник
Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
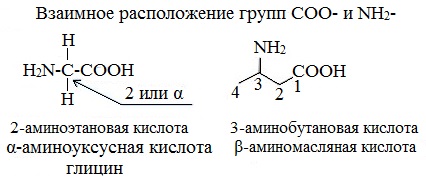
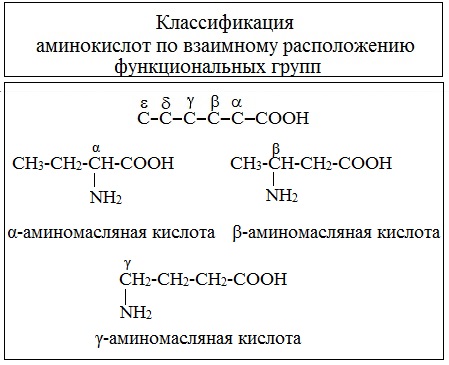
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серусодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
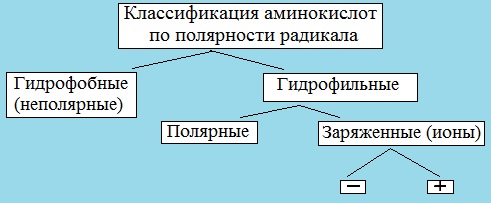
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
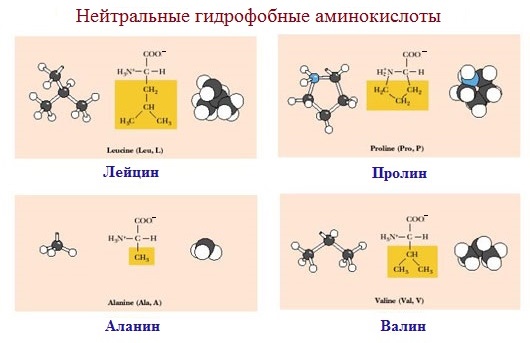
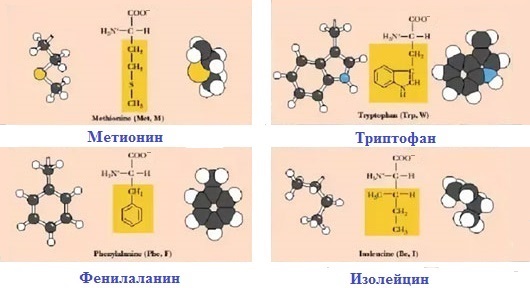
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серусодержащие: метионин
— иминокислота: пролин.
2. Полярные незаряженные
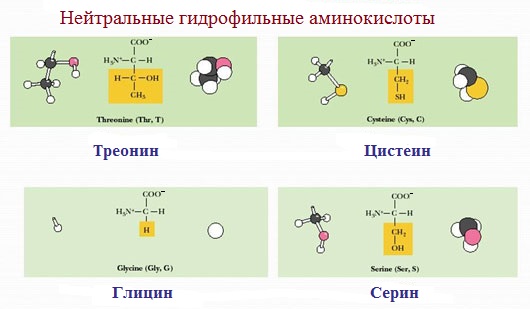
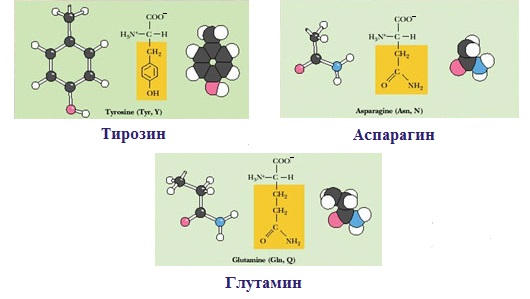
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
3. Заряженные отрицательно при рН-7 (кислые)
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.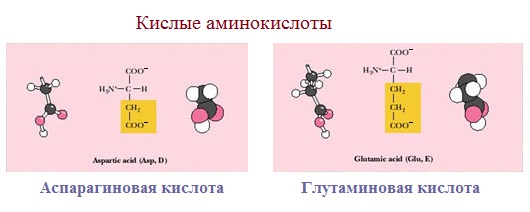
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.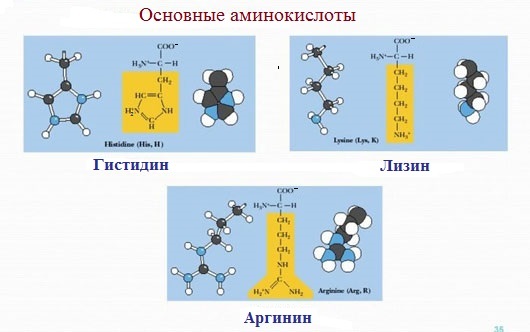
В ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:

VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.

Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Качество некоторых пищевых белков относительно белков женского молока
Аминокислоты
Источник
Цель: расширить знания о функциях белков в живой клетке; научить учащихся выявлять причины происходящих в клетке процессов, используя свои знания о функциях в ней белков.
Оборудование: таблицы по общей биологии, модель первичной структуры белка.
Ход урока
I. Проверка знаний учащихся.
Карточка для работы у доски.
Запишите номера вопросов, против них – правильные ответы.
- Какие органические вещества в клетке на первом месте по массе?
- Какие элементы входят в состав простых белков?
- Сколько аминокислот образует все многообразие белков?
- Сколько аминокислот являются незаменимыми для человека?
- Какие белки называются неполноценными?
- Какая функциональная группировка придает аминокислоте кислые, какое – щелочные свойства?
- В результате какой реакции образуется пептидная связь?
- Между какими группировками аминокислот образуется пептидная связь?
- Какие связи стабилизируют вторичную структуру белков ?
- Какую структуру имеет молекула гемоглобина?
Тесты классу.
Тест 1. Какие органические вещества в клетке на первом месте по массе?
- углеводы.
- белки
- липиды.
- нуклеиновые кислоты.
Тест 2. Какие элементы входят в состав простых белков?
- углерод…
- водород
- кислород
- сера
- фосфор
- азот
- железо
- хлор.
Тест 3. Сколько аминокислот образует все многообразие белков?
- 170
- 26
- 20
- 10
Тест 4. Сколько аминокислот являются незаменимыми для человека?
- таких аминокислот нет.
- 20
- 10
- 7
Тест 5. Какие белки называются неполноценными?
- В которых отсутствуют некоторые аминокислоты.
- В которых отсутствуют некоторые незаменимые аминокислоты.
- В которых отсутствуют некоторые заменимые аминокислоты.
- Все известные белки являются полноценными.
Тест 6. Какая функциональная группировка придает аминокислоте кислые, какое –щелочные свойства?
- Кислые – радикал, щелочные – аминогруппа.
- Кислые – аминогруппа, щелочные – радикал.
- Кислые – карбоксильная группа, щелочные – радикал.
- Кислые – карбоксильная группа, щелочные – аминогруппа.
Тест 7. В результате какой реакции образуется пептидная связь?
- Реакция гидролиза.
- Реакция гидратации.
- Реакции конденсации.
- Все вышеперечисленные реакции могут привести к образованию пептидной связи.
Тест 8. Между какими группировками аминокислот образуется пептидная связь?
- Между карбоксильными группами соседних аминокислот.
- Между аминогруппами соседних аминокислот.
- Между аминогруппой одной аминокислоты и радикалом другой.
- Между аминогруппой одной аминокислоты и карбоксильной группой другой.
Тест 9. Какие связи стабилизируют вторичную структуру белков ?
- ковалентные
- водородные
- ионные
- такие связи отсутствуют
Тест 10. Какую структуру имеют молекула гемоглобина?
- первичную
- вторичную
- третичную
- четвертичную
II. Изучение нового материала.
1. Свойства белков.
У человека более 10 000 видов разных белков.
Свойства белков:
- Денатурация (утрата трехмерной конформации без изменения первичной структуры ). Ренатурация.
- Нерастворимые белки (кератин, фиброин) и растворимые белки (альбумины, фибринген).
- Малоактивные и химически высокоактивные.
- Устойчивые и крайне неустойчивые.
- Фибриаллярные и глобулярные.
- Нейтральные (альбумины, глобулины), основные (гистоны), кислые (казеин)
- Инактивация при замерзании.
2. Функции белков в клетке и организме.
1. Строительная.
2. Каталическая (ферментативная).
Напомним некоторые особенности функционирования ферментов:
а) ферменты ускоряют протекание реакции только одного вида, то есть обладают специфичностью действия;
б) ферменты конкретного организма действуют в узких температурных пределах;
в) ферменты эффективно работают при строго определенных показателях среды. Например, в разных участках пищеварительного тракта она может быть слабощелочной, щелочной или кислой.
Ферментативный белок соединятся реагирующими веществами, ускоряет их превращения ения и выходит из реакции неизменным.
3. Регуляторная.
Осуществляется с помощью гормонов. Многие гормоны являются белками. Рассмотрим их действия на некоторых конкретных примерах.
Пример 1
Пример 2
Ослабленное функционирование поджелудочной железы может привести к нарушению (замедлению) процесса превращения глюкозы в гликоген, вследствие чего возникает серьезное заболевание – сахарный диабет.
4. Двигательная функция белка проявляется при работе мускулатуры человека и животных. В мышечных клетках имеются специальные сократительные белки, обеспечивающие специфическое функционирование этих клеток.
5. Транспортная функция белка проявляется в переносе кислорода и углекислого газа с помощью белка глобина.
6. Защитная функция белка заключается в выработке белков – антител, уничтожающих возбудителей болезней, попавших в организм.
Защитная функция белка приносит… человеку не только пользу. Могут возникнуть серьезные проблемы при пересадке органов и тканей от одного человека другому. Пересаженный орган воспринимается иммунной системой нового «хозяина» этого органа как чужеродный белок. Воздействие антител приводит к отторжению пересаженного органа со всеми вытекающими отсюда последствиями.
Аналогичные проблемы могут возникнуть при беременности, в том случае, если мать будущего ребенка является резус-отрицательной, а отец имеет резус-положительную кровь. В том случае может возникнуть серьёзный конфликт между материнским организмом и организмом развивающего плода.
Напомним, что ген резус-положительности доминирует над геном резус-отрицательности.
Следствием указанного выше конфликта являются задержка и нарушение процесса развития плода, в ряде случаев – его гибель. Связи с ответным воздействием антител плода на чужеродный белок материнского организма женщина испытывает симптомы обостренно протекающего токсикоза беременности.
Защитные функции могут быть могут быть ослаблены либо с помощью медицинских средств (когда это необходимо),либо в результате негативного воздействия природных факторов(ухудшение условий жизни организма, агрессия вируса СПИДа) (см. схему).
7. Энергетическая функция белка проявляется в выделении свободной энергии при последовательном расщеплении полипептидной молекулы
Биологическую роль, которую играют белки в живой клетке и организме, трудно переоценить. Вероятно, жизнь на нашей планете действительно можно рассматривать как способ существования белковых тел, осуществляющих обмен веществом и энергией с внешней средой.
III. Закрепление.
«Свойства и функции белков. »
Тест 1. Что образуется при окислении 1 г белка?
- Вода
- Углекислый газ.
- Аммиак.
- 17,6 кДж энергии.
- Мочевина.
- 38,9 кДж энергии.
Тест 2. В пробирке с пероксидом водорода поместили кусочек варенной колбасы, хлеба, моркови, рубленного яйца. В одной из пробирок выделялся кислород. В какой?
- С кусочком вареной колбасы.
- С кусочком хлебы.
- С кусочком моркови.
- С кусочком рубленного яйца.
Тест 3. Какие суждения верны?
- Ферменты специфичны, каждый фермент обеспечивает раекции одного типа.
- Ферменты универсальны и могут катализировать реакции разных типов.
- Каталическая активность ферментов не зависит от рН и температуры.
- 4. Каталическая активность ферментов напрямую зависит от рН и температуры.
Тест 4. Какие суждения верны?
- Фермент – ключ, субстрат – замок, согласно теории Фишера.
- Фермент – замок, субстрат – ключ, согласно теории Фишера.
- После каталитической реакции фермент и субстрат распадаются, образуя продукты реакции.
- После каталитической реакции фермент остается неизменным, субстрат распадается, образуя продукты реакции.
Тест 5. Какие суждения верны?
- Витамины являются кофакторами ферментов.
- Все белки являются биологическими катализаторами, ферментов.
- При замерзании происходит необратимая денатурация ферментов.
- Ренатурация – утрата трехмерной конфигурации белка без изменения первичной структуры
Тест 6. Какая функциональная группировка придает аминокислоте кислые, какое –щелочные свойства?
- Кислые – радикал, щелочные – аминогруппа.
- Кислые – аминогруппа, щелочные – радикал.
- Кислые – карбоксильная группа, щелочные – радикал.
- Кислые – карбоксильная группа, щелочные – аминогруппа.
Тест 7. В результате какой реакции образуется пептидная связь?
- Реакция гидролиза.
- Реакция гидратации.
- Реакции конденсации.
- Все вышеперечисленные реакции могут привести к образованию пептидной связи.
Тест 8. Между какими группировками аминокислот образуется пептидная связь?
- Между карбоксильными группами соседних аминокислот.
- Между аминогруппами соседних аминокислот.
- Между аминогруппой одной аминокислоты и радикалом другой.
- Между аминогруппой одной аминокислоты и карбоксильной группой другой.
Тест 9. Какие связи стабилизируют вторичную структуру белков?
- ковалентные
- водородные
- ионные
- такие связи отсутствуют.
Тест 10. Какие связи стабилизируют третичную структуру белков?
- ковалентные
- водородные
- ионные
- гидрофильно-гидрофобное взаимодействие.
На дом: стр. 94-99, вопросы в конце параграфа.
Источник

Ответ
Ответ дан
janislav
Правильный вариант ответа : Б)