Какая масса этилового спирта и воды содержится в 1 кг 40 раствора

Задача 427.
Вычислить мольные доли спирта и воды в 96%-ном (по массе) растворе этилового спирта.
Решение:
Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех
веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна
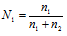 , а мольная доля спирта
, а мольная доля спирта  , где n1 – количество спирта; n2 – количество воды.
, где n1 – количество спирта; n2 – количество воды.
Рассчитаем массу спирта и воды, содержащихся в 1 литре раствора, при условии, что их плотности равны единице из пропорций:
а) масса спирта:

б) масса воды:

Находим количество веществ по формуле: 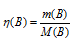 , где m(В) и М(В) – масса и количество вещества.
, где m(В) и М(В) – масса и количество вещества.
Тогда

Теперь рассчитаем мольные доли веществ:

Ответ: 0,904; 0,096.
Задача 428.
В 1кг воды растворено 666г КОН; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю КОН; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
Решение:
а) Массовая доля – процентное отношение массы растворённого вещества к общей массе раствора определяется по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
m(р-ра) = m(H2O) + m(KOH) = 1000 + 666 = 1666 г.
Тогда

б) Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Найдём массу КОН, приходящуюся на 100 мл раствора по формуле: формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(KOH) = 1,395 .1000 = 1395 г.
Отсюда

Теперь рассчитаем молярность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов HNO3 приходится на 1000г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

г) Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна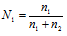 а мольная доля спирта
а мольная доля спирта  , где n1 – количество щёлочи; n2 – количество воды.
, где n1 – количество щёлочи; n2 – количество воды.
В 100г данного раствора содержится 40г КОН 60г Н2О.
Откуда

Тогда

Ответ: а) 40%; б) 9,95 моль/л; в) 11,88 моль/кг; г) 0,176; 0,824.
Задача 429.
Плотность 15%-ного (по массе) раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
Решение:
Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(H2SO4) = 1,105 . 1000 = 1105 г.
Массу H2SO4, содержащуюся в 1000 мл раствора, находим из пропорции:

Определим молярную массу эквивалента H2SO4 из соотношения:
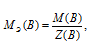
МЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(В) – эквивалентное число; Z(кислоты) равно числу ионов H+ в H2SO4 → 2.
Отсюда

а) Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащегося в 1 литре раствора.
Тогда

б) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Теперь рассчитаем моляльность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов H2SO4 содержится в 1000г воды, составив пропорцию:

а) Массу , содержащуюся в растворе, вычислим по формуле:
Теперь рассчитаем моляльность раствора:

Ответ: а) 3,38н; б) 1,69 моль/л; 1,80 моль/кг.
Задача 430.
Плотность 9%-ного (по массе) раствора сахарозы С12Н22О11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
Решение:
М(С12Н22О11) = 342г/моль. Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(С12Н22О11) =1,035 . 1000 = 1035 г.
а) Массу С12Н22О11, содержащуюся в растворе, вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда

Концентрация вещества в г/л показывает число граммов (единиц массы), содержащихся в 1л раствора. Следовательно, концентрация сахарозы составляет 93,15г/л.
б) Молярная(объёмно-молярная) концентрация (СМ) показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Тогда

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов С12Н22О11 содержится в 1000 г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

Ответ: а) 93,15 г/л; б) 0,27 моль/л; в) 0,29 моль/кг.
Источник
Задача 427.
Вычислить мольные доли спирта и воды в 96%-ном (по массе) растворе этилового спирта.
Решение:
Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех
веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна
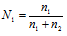 , а мольная доля спирта
, а мольная доля спирта  , где n1 – количество спирта; n2 – количество воды.
, где n1 – количество спирта; n2 – количество воды.
Рассчитаем массу спирта и воды, содержащихся в 1 литре раствора, при условии, что их плотности равны единице из пропорций:
а) масса спирта:

б) масса воды:

Находим количество веществ по формуле: 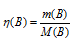 , где m(В) и М(В) – масса и количество вещества.
, где m(В) и М(В) – масса и количество вещества.
Тогда

Теперь рассчитаем мольные доли веществ:

Ответ: 0,904; 0,096.
Задача 428.
В 1кг воды растворено 666г КОН; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю КОН; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
Решение:
а) Массовая доля – процентное отношение массы растворённого вещества к общей массе раствора определяется по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
m(р-ра) = m(H2O) + m(KOH) = 1000 + 666 = 1666 г.
Тогда

б) Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Найдём массу КОН, приходящуюся на 100 мл раствора по формуле: формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(KOH) = 1,395 .1000 = 1395 г.
Отсюда

Теперь рассчитаем молярность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов HNO3 приходится на 1000г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

г) Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна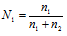 а мольная доля спирта
а мольная доля спирта  , где n1 – количество щёлочи; n2 – количество воды.
, где n1 – количество щёлочи; n2 – количество воды.
В 100г данного раствора содержится 40г КОН 60г Н2О.
Откуда

Тогда

Ответ: а) 40%; б) 9,95 моль/л; в) 11,88 моль/кг; г) 0,176; 0,824.
Задача 429.
Плотность 15%-ного (по массе) раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
Решение:
Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(H2SO4) = 1,105 . 1000 = 1105 г.
Массу H2SO4, содержащуюся в 1000 мл раствора, находим из пропорции:

Определим молярную массу эквивалента H2SO4 из соотношения:
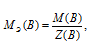
МЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(В) – эквивалентное число; Z(кислоты) равно числу ионов H+ в H2SO4 → 2.
Отсюда

а) Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащегося в 1 литре раствора.
Тогда

б) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Теперь рассчитаем моляльность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов H2SO4 содержится в 1000г воды, составив пропорцию:

а) Массу , содержащуюся в растворе, вычислим по формуле:
Теперь рассчитаем моляльность раствора:

Ответ: а) 3,38н; б) 1,69 моль/л; 1,80 моль/кг.
Задача 430.
Плотность 9%-ного (по массе) раствора сахарозы С12Н22О11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
Решение:
М(С12Н22О11) = 342г/моль. Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(С12Н22О11) =1,035 . 1000 = 1035 г.
а) Массу С12Н22О11, содержащуюся в растворе, вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда

Концентрация вещества в г/л показывает число граммов (единиц массы), содержащихся в 1л раствора. Следовательно, концентрация сахарозы составляет 93,15г/л.
б) Молярная(объёмно-молярная) концентрация (СМ) показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Тогда

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов С12Н22О11 содержится в 1000 г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

Ответ: а) 93,15 г/л; б) 0,27 моль/л; в) 0,29 моль/кг.
Источник
Радиофизик, меньше математик, радио, сетевой админ, программист. Родом из…
Считаем: 300 мл 70% = 210 грамм спирта. Теперь: 80% в растворе – это 80 грамм в 100 мл. Чтобы получить 210 грамм нужно взять 160 + 50 – это дважды по 100 грамм 80% раствора и 50/0,8 = 262,5 грамма раствора по 80%. Потом просто долить водой до 300 мл. Всё.
P.S. Это всё без учёта того, что спирт растворяется в воде и в итоге даёт меньший объём, чем оба вещества по отдельности – особенность растворения спирта в воде. Но от нас тут такой точности и не требуется. Мы же не растворяем спирт, а используем уже водный раствор спирта.
всё точно) а проще сделать так: 300×0,7=210:0,8= 262,5 мл спиртового раствора 80% долить водой до 300мл
Какова минимальная концентрация спирта в растворе, что бы тот обладал, хоть какими то, дезинфицирующими свойствами?
начальник лаборатории, алкоголик, задрот в компьютерные игры
Кратко: 60-70 %
Полно:
Разберемся подробно, что такое дезинфекция:
Дезинфицирующие средства — химические и физические средства, применяемые для уничтожения во внешней среде возбудителей инфекционных заболеваний человека, животных и болезней растений
Химические дезинфицирующие средства, применяемые для уничтожения патогенных микроорганизмов на предметах внешней среды, должны обладать хорошей растворимостью в воде, вызывать гибель микробов в короткие сроки, не снижать активности в присутствии органических веществ, быть нетоксичными или малотоксичными для человека и животных, не иметь резкого неприятного запаха и не портить обеззараживаемых предметов.
Теперь отвечу как спирт убивает те самые микроорганизмы, происходит процесс денатурации белков микроорганизмов. И чтобы это происходило нужна достаточная концентрация спирта. Слишком мало просто не подействует. Но почему не используют 96% спирт для живых организмах, все просто – с увеличением концентрации, спирт вызывает денатурацию белков все сильнее, и уже на поверхности живого организма, что препятствует его проникновению в глубь тканей, поэтому дезинфицирующий эффект будет поверхностным. И поэтому 60-70% та золотая середина что нужна.
P.S. Желательно услышать ответ медика на этот вопрос, я ответил лишь поверхностно, затронув лишь некоторые химические процессы и механизмы.
Если водка это всегда этиловый спирт 40% разбавленный водой, то почему у нее так много сортов?
Что наша жизнь? Игра!
И кто ж тому виной,
что я увлекся этою игрой…
Играю…
Стоп, стоп! Водка – это не просто этиловый разбавленный спирт!
И пропорции не всегда были 40% спирта и 60% воды, вот при Сталине, как говрят, была и водка в 56 градусов, а еще раньше -при нэпе – в 30 градусов.
Многое зависит от качества воды и от того, какую обработку эта вода проходит на каждом конкретном предприятии. Есть вполне жесткие стандарты содержания в водке различных химических примесей, есть требования по ионному составу. Но, как там ни старайся, полной идентичности разных “вод” на разных предприятиях добиться просто невозможно.
Кроме того, и спирт же тоже бывает разный. Он может быть произведен не обязательно из пшеницы, но и из ржи, например. Кстати, даже из кукурузы есть.
И, наконец, добавки. Они есть: разные виды сахара, ароматизаторы спиртновые,настои и так далее.
Вот отсюда и большое количество сортов, и разные водочные бренды.
Прочитать ещё 2 ответа
Чему равна молярность, нормальность и титр 40%раствора CaCl2 плотностью 1 396г/см3?
Молодой-исследовать в области химии и ядерной физики ускорителей частиц, г. Падуя, Италия. · tele.click/real_italy
Плотность раствора по видимому указана с ошибкой, Предположу, что р=1,396 г/см3
1) Найдем массу растворенной соли CaCl2
из p=m/V узнаем массу 1 л(для удобства) раствора:
m(р-ра) = p*V= 1,396*1000 = 1396 г
Массу соли найдем из
w=m(CaCl2)/m(р-ра)
m(CaCl2)= w*m(р-ра) = 0,4 * 1396 = 558,4 г
2) Рассчитаем молярность:
Cm = n/V
n=m(CaCl2)/M(CaCl2) = 558,4 / 111 = 5,03 моля ~ 5 моль
Итого: Сm = 5 моль / 1 л = 5 моль/л
3)Нормальность
N = Cm * z = 5 моль/л * 2 = 10 моль/л
По поводу нормальности не доконца уверен, но когда сталкивался, она всегда была больше молярность в z раз . Где z , на мой взгляд условное значение, которое определялось колличество электронов в реакции, разрядности соли/кислоты/щелочи. В данном случаи соль двухзарядная.
4) Титр раствора будет
Т = m (г)/ V(мл) = 558,4 г / 1000 мл = 0,5584 г/мл
Источник
Задача 427.
Вычислить мольные доли спирта и воды в 96%-ном (по массе) растворе этилового спирта.
Решение:
Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех
веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна
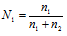 , а мольная доля спирта
, а мольная доля спирта  , где n1 – количество спирта; n2 – количество воды.
, где n1 – количество спирта; n2 – количество воды.
Рассчитаем массу спирта и воды, содержащихся в 1 литре раствора, при условии, что их плотности равны единице из пропорций:
а) масса спирта:

б) масса воды:

Находим количество веществ по формуле: 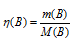 , где m(В) и М(В) – масса и количество вещества.
, где m(В) и М(В) – масса и количество вещества.
Тогда

Теперь рассчитаем мольные доли веществ:

Ответ: 0,904; 0,096.
Задача 428.
В 1кг воды растворено 666г КОН; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю КОН; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
Решение:
а) Массовая доля – процентное отношение массы растворённого вещества к общей массе раствора определяется по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
m(р-ра) = m(H2O) + m(KOH) = 1000 + 666 = 1666 г.
Тогда

б) Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Найдём массу КОН, приходящуюся на 100 мл раствора по формуле: формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(KOH) = 1,395 .1000 = 1395 г.
Отсюда

Теперь рассчитаем молярность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов HNO3 приходится на 1000г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

г) Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна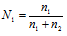 а мольная доля спирта
а мольная доля спирта  , где n1 – количество щёлочи; n2 – количество воды.
, где n1 – количество щёлочи; n2 – количество воды.
В 100г данного раствора содержится 40г КОН 60г Н2О.
Откуда

Тогда

Ответ: а) 40%; б) 9,95 моль/л; в) 11,88 моль/кг; г) 0,176; 0,824.
Задача 429.
Плотность 15%-ного (по массе) раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
Решение:
Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(H2SO4) = 1,105 . 1000 = 1105 г.
Массу H2SO4, содержащуюся в 1000 мл раствора, находим из пропорции:

Определим молярную массу эквивалента H2SO4 из соотношения:
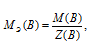
МЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(В) – эквивалентное число; Z(кислоты) равно числу ионов H+ в H2SO4 → 2.
Отсюда

а) Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащегося в 1 литре раствора.
Тогда

б) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Теперь рассчитаем моляльность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов H2SO4 содержится в 1000г воды, составив пропорцию:

а) Массу , содержащуюся в растворе, вычислим по формуле:
Теперь рассчитаем моляльность раствора:

Ответ: а) 3,38н; б) 1,69 моль/л; 1,80 моль/кг.
Задача 430.
Плотность 9%-ного (по массе) раствора сахарозы С12Н22О11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
Решение:
М(С12Н22О11) = 342г/моль. Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(С12Н22О11) =1,035 . 1000 = 1035 г.
а) Массу С12Н22О11, содержащуюся в растворе, вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда

Концентрация вещества в г/л показывает число граммов (единиц массы), содержащихся в 1л раствора. Следовательно, концентрация сахарозы составляет 93,15г/л.
б) Молярная(объёмно-молярная) концентрация (СМ) показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Тогда

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов С12Н22О11 содержится в 1000 г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

Ответ: а) 93,15 г/л; б) 0,27 моль/л; в) 0,29 моль/кг.
Источник
