Какая масса углерода содержится в 110
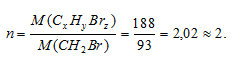
Ar(O) -? Ответ: Ar(O)=16
2. Вычислить относительную молекулярную массу Н2О
Дано: Решение:
Н2О Mr(H2O)= 2*Ar(H)+Ar(O)
Найти: Mr(H2O)
Ar(H)=1 Ar(O)=16
Mr(H2O)=2*1+16=18
Ответ: Mr(H2O)= 18
3. Вычислить относительную молекулярную массу воды, если mm(H2O)=2,99*10-23г, ma(C)= 1,99*10-23г.
Дано: Решение:
mm(H2O)=2,99*10-23г Mr(H2O)=mm(H2O): 1/12ma(С)
ma(C)= 1,99*10-23г. Mr(H2O)= 2,99*10-23г: 1/12*1,99*10-23г=18
Mr(H2O)
Ответ: Mr(H2O)=18
4. На весах отвесили 500г сульфата цинка 500 г. сульфата цинка. Какому количеству вещества это соответствует?
Дано: Решение:
m(ZnSO4)=500г n=m/M M(ZnSO4)=[ Mr(ZnSO4)]
n(ZnSO4)-? Mr(ZnSO4)=Ar(Zn)+Ar(S)+4*Ar(O)=61+32+4*16=161
M(ZnSO4)=161 г/моль
n(ZnSO4)=500г:161 г/моль=3,1 моль
Ответ: n(ZnSO4)=3,1моль
5. Сколько молекул содержится в Н2О массой 45г. Какова масса 1 молекулы Н2О?
Дано: Решение:
m(H2O)=54г N=n*NA
1)Находим n(вещества) массой 54г. воды
N(H2O) – ? N=m/M=54г:18г/моль=3моль
mm(H2O) – ?
2)Находим число молекул
N=3моль*6,02*1023моль-1=18,06*1023молекул
3)Находим массу 1 молекулы Н2О. Зная что 1 моль Н2О
содержит 6,02*1023молекул, их масса 18г, тогда масса
1 молекулы будет равна: mm(H2O)=18г/6,02*1023моль-1= 2,99*10-23г
2 способ: N=n*NA= m/M; m=M*N/NA
mm(X)=M(X)*N/NA; N=1, т. к. для 1 молекулы, тогда
mm(Н2О)=18г/моль*1/ 6,02*1023моль-1=2,99*10-23г.
Ответ: N=18,06*1023молекул
mm(H2O)= 2,99*10-23г
6.Определите массовые доли химических элементов в Н3РО4
Дано:
Н3РО4 ω(x)=X*Ar(x) / Mr(в-ва)
Mr(Н3РО4)=98
ω(н)=3*Ar(H)/Mr(Н3РО4)=3*1/98=0,0306 или 3,06%
ω(н)-? ω(P)=Ar(P)/ Mr(Н3РО4)=31/98=0,3163 или 31,63%
ω(P)-? ω(O)=4*Ar(O)/Mr(Н3РО4)=64/98=0,6531 или 65,31%
ω(O)-? Ответ: ω(н)= 3,06% ω(P)= 31,63% ω(O)= 65,31%
7.Массовая доля кислорода в оксиде трехвалентного металла равна 47,06%. Определите этот элемент и составьте формулу оксида.
Дано: Решение:
Ме2О3
ω(о)=47,06% Мr(Ме2О3)=2*Ar(Me)+48
ω(Me)=100-47,06=52,94%
Ме-? 48мас. част. – 47,06%
2*Ar(Me) – 52,94% 2* Ar(Me) = 48*52,94/47,06=54
Ar(Me)=54/2=27 – это алюминий
Ответ: Al
8. Массовая доля кристаллизационной воды в железном купоросе составляет 45,3%.
Определите число молекул воды в формуле железного купороса (FeSO4*nH2O)
дано: Решение:
FeSO4*nH2O 1) ωбез в(FeSO4)=100-45,3=54,7%
ω(Н2О)=45,3% 2)Mr(FeSO4)=152
152 мас ч соответствует 54,7%
Хмас. ч. —————– 45,3%
N-?
Х=152*45,3/ 54,7=126
Мr(nH2O)=126
3) n(H2O)=Mr(nH2O)/Mr(H2O)=126/18=7
Ответ: FeSO4*7H2O
9. Вычислите, какая масса углерода содержится в 90г этана С2Н6.
Дано: Решение:
m(C2H6) = 90г.
M(C2H6)=2*12+1*6=30г/моль
m(C)-? N(C2H6)=m/M=90г/30г/моль=3моль
1моль С2Н6 содержит 2 моль С, т. е. n(C)=2*n(С2Н6)=2*3=6 моль m(C)=n*M=6моль*12г/моль=72г.
Ответ: m(С)=72 г.
10. Вычислите, в какой массе оксида фосфора (III)Р2О3 содержится 6,2 г фосфора.
Дано: Решение:
Р2О3
M(Р2О3) = 110г/моль
m(P)=6,2г. n(P)/n(Р2О3)=2/1 n(Р2О3)=n(P)/2
n(P)=m/M=6,2/31=0,2моль
m(Р2О3) – ? n(Р2О3)=0,2/2=0,1моль
m(Р2О3)=n*M=0,1*110=11г.
Ответ: m(Р2О3)=11г.
11. Вычислите сколько молекул содержится в 36г. Н2О. В каком объеме метана (н. у.)столько же молекул.
Дано: Решение:
m(H2O)=36г. N=n*NA
N(H2O)-? n(H2O)=m/M=36/18=2моль
V(CH4)-? N(H2O)=6,02*1023моль-1*2моль=12,04*1023молекл
N(CH4)=12,04*1023молекул
n(CH4)=N/NA=12,04*1023/6,02*1023=2моль
V=n*Vm=2*22,4л/моль=44,8 л.
Ответ: N(H2O)= 12,04*1023молекл,
V(CH4)=44,8л.
12. Сколько молей атомов углерода в 15г. СН3СООН?
Дано: Решение:
m(СН3СООН) = 15г. n=m/M
n(C)=?
n(СН3СООН)=m(СН3СООН)/M(СН3СООН)=15г/60г/моль=0,25моль
1моль СН3СООН содержит 2 атома С, поэтому:
n(C)=2*n(СН3СООН)=2*0,25 моль=0,5 моль
Ответ: n(C)=0,5моль
13. Чему равно общее число атомов в 3г. этана?
Дано: Решение:
m(C2H6)=3г. n=m/M N=n*NA
N(атомов)-? Найдем n(C2H6)= m/M=3/30=0,1моль
N(C2H6)=0,1*6,02*1023моль-1=6,02*1022
молекула С2Н6 содержит всего 8 атомов (2С и 4Н) поэтому:
N(атомов)=8*6,02*1022=48,16*1022
Ответ: N(атомов)=48,16 *1022
Задачи для самостоятельного решения:
1. Найти относительную атомную массу кислорода, если один атом кислорода имеет массу 2,7*10-23г.
2. Вычислите относительную молекулярную массу веществ состава:
а)СО2 б)НNO3 в)СuSO4 г)Cu(OH)2
3.Рассчитайте массу 2 моль оксида меди (II); 0,5 моль серной кислоты; 0,1 моль хлорида натрия; 0,1 моль кислорода.
4.На одну чашку весов поместили 0,5 моль оксида меди (II). Какое количество оксида железа (III)необходимо поместить на другую чашку весов, чтобы они были в равновесии?
5.Какое вещество содержит больше составных частиц: бор массой 1г. или медь массой 1г? ответ подтвердите расчетами.
6. Какой должна быть масса магния, чтобы она содержала столько же атомов, сколько их содержится в веществе железа массой 28 г.?
7. Сколько молекул воды содержится в воде объемом 1 мл?
8. Какое вещество содержит больше молекул: вода массой 1г. или сероводород массой 1г? Ответ подтвердите расчетами.
9. Одинаковое ли число молекул в 1 л воды и в 1 л серной кислоты, плотность которой 1831 кг/м3? Ответ подтвердите расчетами.
10. Определите объем (н. у.) который займет при нормальных условиях газовая смесь, содержащая водород массой 1,4г. и азот массой 5,6 г.
11. Рассчитайте массу фосфина, содержащего столько же электронов, что и 8,96л бромоводорода.
Расчеты по химическим уравнениям
В основе расчетов по химическим уравнениям лежит закон сохранения массы (Ломоносов, Лавуазье), согласно которому общая масса всех веществ, вступивших в химическую реакцию, равна общей массе всех продуктов реакции.
Равенство этих масс обусловлено тем, что все атомы, из которых состоял реагенты, переходят в продукты реакции; «лишних» атомов в результате разрушения исходных веществ и образования новых не оказывается.
Равенства чисел атомов каждого элемента добиваются, находя коэффициенты, превращающие схему реакции в уравнение реакции:
Ca3P2+6H2O→3Ca(OH)2 + 2PH3
число атомов каждого элемента в правой и левой части одинаковы.
Коэффициенты в уравнении реакции показывает наименьшее число молекул (структурных единиц) вещества, вступающих в химическую реакцию и образующихся в результате неё. Поскольку число молекул пропорционально числу молей, то мольные соотношения участвующих в реакции веществ равны отношениям соответствующих коэффициентов.
n(Ca3P2):n(H2O):n(Ca(OH)2):n(PH3)=1:6:3:2
Очевидно, что, зная число молей одного из участвующих в реакции веществ (реагента или продукта)и составив уравнение данной реакции, легко рассчитать количество (число молей)любого вещества. поэтому именно в молях удобнее всего производить расчет по уравнениям реакций. Особенно целесообразен такой подход при решении задач, связанных с многостадийным превращением веществ.
1. Алюминий массой 13,5г. растворили в избытке НСl. Какой объем Н2 (при н. у) выделится при этом? Какую массу хлорида алюминия можно извлечь из полученного раствора?
Дано: Решение:
m(Al)=13,5г н. у. 2Al+6HCl → 2AlCl3 + 3H2
V(H2)-? 2моль 2моль 3моль
m(AlCl3)-? 1) n(Al)/n(AlCl3)=2/2, т. е. n(Al)=n(AlCl3)
n(Al)=m/M=13,5/27=0,5моль
N(AlCl3)=0,5моль, m(AlCl3)=n*M=0,5*133,5=66,75г.
2)n(Al)/n(H2)=2/3 n(H2)=n(Al)*3/2=0,5*3/2=0,75
V(H2)=n*Vm=0,75*22,4=16,8л.
Ответ: V(H2)=16,8л. m(AlCl3)=66,75г.
2. Н2S сожгли в избытке О2. Весь полученный сернистый газ окислили О2 до оксида S(VI), который растворили в Н2О. Минимальная масса NaOH, необходимая для полной нейтрализации полученного раствора, равна 10г. Какой V(H2S) н. у. был взят для сжигания?
Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 |
Источник
ГДЗ Химия 8 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2018, §11 МОЛЯРНЫЙ ОБЪЁМ ГАЗОВ
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1. Какие условия называются нормальными?
При температуре 0°С и давлении 760 мм рт.ст.
Упражнение 2. Сформулируйте закон Авогадро и следствия, вытекающие из этого закона.
Закон: «В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул».
Следствие 1: «Одинаковое число молекул разных газов при одинаковых условиях занимает одинаковый объём».
Следствие 2: «Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс».
Упражнение 3. Перечислите, какую информацию несёт формула газообразного вещества.
1 ) индивидуальное вещество;
2) тип вещества (простое или сложное);
3) одну молекулу вещества (для веществ, имеющих молекулярное строение), формульную единицу (для веществ, имеющих немолекулярное строение);
4) качественный состав вещества, т. е. какие химические элементы входят в его состав;
5) количественный состав вещества, т. е. число атомов каждого химического элемента в составе его одной формульной частицы.
6) формула показывает количество вещества, равное 1 моль.
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1. Какое количество вещества при нормальных условиях составляют указанные объёмы различных газов:
а) 11,2 л кислорода;
Дано: V(O2)=11,2 л
Найти: ʋ(O2)-?
Решение:
1-способ
ʋ(O2)=V(O2)/VM=11,2 л : 22,4 л/моль=0,5 моль
2-й способ
Для нахождения количества вещества кислорода составляем пропорцию и решаем её:
22,4 л O2 содержит 1 моль вещества,
11,2 л O2― х моль вещества
22,4 л / 11,2 л = 1 моль / х моль, отсюда по свойству пропорции
х моль • 22,4 л = 11,2 л • 1 моль
х = 11,2 л • 1 моль : 22,4 л=0,5 моль
Ответ: 0,5 моль
б) 5,6 л метана;
Дано: V(CH4)=5,6 л
Найти: ʋ(CH4)-?
Решение:
1-й способ
ʋ(CH4)=V(CH4)/VM=5,6 л : 22,4 л/моль=0,25 моль
2-й способ
Для нахождения количества вещества метана составляем пропорцию и решаем её:
22,4 л CH4 содержит 1 моль вещества,
5,6 л CH4 ― х моль вещества
22,4 л / 5,6 л = 1 моль / х моль, отсюда по свойству пропорции
х моль • 22,4 л = 5,6 л • 1 моль
х = 5,6 л • 1 моль : 22,4 л=0,25 моль
Ответ: 0,25 моль
в) 896 мл сероводорода;
Дано: V(H2S)=896 мл
Найти: ʋ(H2S)-?
Решение:
1-й способ
ʋ(H2S)=V(H2S)/VM=896 мл : 22,4 мл/ммоль=40 ммоль
2-й способ
Для нахождения количества вещества сероводорода составляем пропорцию и решаем её:
22,4 мл H2S содержит 1 ммоль вещества,
896 мл H2S ― х ммоль вещества
22,4 мл / 896 мл = 1 ммоль / х ммоль, отсюда по свойству пропорции
х ммоль • 22,4 мл = 896 мл • 1 ммоль
х = 896 мл • 1 ммоль : 22,4 мл=40 ммоль
Ответ: 40 ммоль
г) 1 м3 углекислого газа?
Дано: V(CO2)= 1 м3
Найти: ʋ(СO2)-?
Решение:
1-й способ
ʋ(СO2)= V(СO2)/VM=1 м3 : 22,4 м3/кмоль=0,04464 кмоль=44,64 моль
2-й способ
Для нахождения количества вещества углекислого газа составляем пропорцию и решаем её:
22,4 м3 CO2 содержит 1 кмоль вещества,
1 м3 CO2 ― х кмоль вещества
22,4 м3 / 1 м3 = 1 кмоль / х кмоль, отсюда по свойству пропорции
х кмоль • 22,4 м3 = 1 м3 • 1 кмоль
х = 1 м3 • 1 кмоль : 22,4 м3=0,04464 кмоль=44,64 моль
Ответ: 44,64 моль
Изменятся ли ответы, если в условии задания не указывать названия газов? Нет, не изменятся.
Поясните ответ. Любой газ в количестве вещества 1 моль при условиях, которые называются нормальными (н. у.), будет занимать один и тот же объём, который называют молярным объёмом.
Упражнение 2. Найдите плотности следующих газов (н.у.):
Объяснение. Поставим в формулу ρ=m/V выражения из формул вычисления массы и объёма: m=γ•M и V=γ•VM, получим формулу вычисления плотности газов при н.у.: ρ=m/V=(γ•M)/(γ•VM)=M/VM, следовательно ρ=M/VM.
а) углекислого газа СО2;
Дано: CO2
Найти: ρ(СO2)-?
Решение:
Mr(CO2)=Ar(C)+2•Ar(O)=12+2•16=44, M(CO2)=44 г/моль
ρ(СO2)=M(CO2):VM=44 г/моль : 22,4 моль/л=1,96 г/л
Ответ: 1,96 г/л
б) сернистого газа SO2;
Дано: SO2
Найти: ρ(SO2)-?
Решение:
Mr(SO2)=Ar(S)+2•Ar(O)=32+2•16=64, M(SO2)=64 г/моль
ρ(SO2)=M(SO2):VM=64 г/моль : 22,4 моль/л=2,86 г/л
Ответ: 2,86 г/л
в ) аммиака NН3;
Дано: NН3
Найти: ρ(NН3)-?
Решение:
Mr(NН3)=Ar(N)+3•Ar(H)=14+3•1=17, M(NН3)=17 г/моль
ρ(NН3)=M(NН3):VM=17 г/моль : 22,4 моль/л=0,76 г/л
Ответ: 0,76 г/л
г) метана СН4.
Дано: СН4
Найти: ρ(СН4)-?
Решение:
Mr(СН4)=Ar(C)+4•Ar(H)=12+4•1=16, M(СН4)=16 г/моль
ρ(СН4)=M(СН4):VM=16 г/моль : 22,4 моль/л=0,71 г/л
Ответ: 0,71 г/л
Упражнение 3. Найдите относительную плотность кислорода:
а) по водороду;
Дано: O2
Найти: DH2(O2)-?
Решение:
M(O2)=Mr(O2)=2•Ar(O)=2•16=32 г/моль
M(H2)=Mr(H2)=2•Ar(H)=2•1=2 г/моль
DH2(O2)=М(O2)/М(H2)= 32 г/моль : 2 г/моль=16
Ответ: DH2(O2)=16
б) по воздуху.
Дано: O2
Найти: Dвоздуха(O2)-?
Решение:
M(O2)=Mr(O2)=2•Ar(O)=2•16=32 г/моль
Dвоздуха(O2)=М(O2)/М(воздуха)=32 г/моль : 29 г/моль=1,103
Ответ: Dвоздуха(O2)=1,103
Упражнение 4. Одно из газообразных соединений углерода с кислородом массой 6,25 г занимает (н.у.) объём, равный 5 л. Определите молярную массу соединения.
Дано: m(соединения)=6,25 г, V(соединения)=5 л
Найти: М(соединения)-?
Решение:
Молярную массу газа легко рассчитать, имея массу 1 литра, т.е. плотность ρ=m/V.
ρ(соединения)=m(соединения)/V(соединения)=6,25 г : 5 л=1,25 г/л
M(соединения)=VМ•ρ(соединения)=22,4 л/моль•1,25 г/л=28 г/моль
Соединение СО: 12 + 16=28
Ответ: M(СО)=28 г/моль
Упражнение 5. Рассчитайте количество вещества, массу и объём (н.у.) порции азота N2 содержащей
а) 9,03•1023 атомов азота.
Дано: N(N)=9,03•1023 атомов
Найти: ʋ(N2)-?, m(N2)-?, V(N2)-?
Решение:
1. Количество вещества рассчитываем по формуле: ʋ=N/NА, где NА=6,02•1023моль-1 – число Авогадро.
ʋ(N)=N(N)/NА=9,03•1023 : 6,02•1023 моль-1= 1,5 моль
В 1 моль вещества азота N2 содержится 2 моль атомов азота N, тогда 1 моль атомов азота будут содержаться в 1/2 моль вещества азота, а 1,5 моль атомов азота будут содержаться в таком количестве вещества азота:
ʋ(N2)=1/2 • ʋ(N)=1/2 • 1,5 моль=0,75 моль
2. Массу вещества рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.
M(N2)=Mr(N2)=2•Ar(N)=2•14=28 г/моль
m(N2)=ʋ(N2)•M(N2)=0,75 моль • 28 г/моль=21 г
3. Объём вещества рассчитываем по формуле: V=ʋ•VM, где VM=22,4 л/моль – молярный объём.
V(N2)=ʋ(N2)•VM=0,75 моль • 22,4 л/моль=16,8 л
Ответ: 0,75 моль, 21 г, 16,8 л
б) 9,03•1023 молекул азота.
Дано: N(N2)= 9,03•1023 молекул
Найти: ʋ(N2)-?, m(N2)-?, V(N2)-?
Решение:
1. Количество вещества рассчитываем по формуле: ʋ=N/NА, где NА=6,02•1023моль-1 – число Авогадро.
ʋ(N2)=N(N2)/NА=9,03•1023: 6,02•1023 моль-1= 1,5 моль
2. Массу вещества рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.
M(N2)=Mr(N2)=2•Ar(N)=2•14=28 г/моль
m(N2)=ʋ(N2)•M(N2)=1,5 моль • 28 г/моль=42 г
3. Объём вещества рассчитываем по формуле: V=ʋ•VM, где VM=22,4 л/моль – молярный объём.
V(N2)=ʋ(N2)•VM=1,5 моль • 22,4 л/моль=33,6 л
Ответ: 1,5 моль, 42 г, 33,6 л
Упражнение 6. Какая масса углерода содержится:
а) в 2 моль углекислого газа;
Дано: ʋ(CO2)=2 моль
Найти: m(С)-?
Решение:
1. В 1 моль вещества CO2 содержится 1 моль атомов углерода С, тогда в 2 моль СО2 будет содержаться количество атомов углерода:
ʋ(С)=ʋ(СO2)=2 моль
2. Массу вещества рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.
M(С)=Ar(С) г/моль=12 г/моль
m(С)=ʋ(С)•M(С)=2 моль •12 г/моль=24 г
Ответ: 24 г
б) в 67,2 л угарного газа СО (н.у.);
Дано: V(CO)=67,2 л
Найти: m(С)-?
Решение:
1. Количество вещества рассчитываем по формуле: ʋ=V/VM, где VM=22,4 л/моль – молярный объём.
ʋ(СO)=V(СO)/VM=67,2 л : 22,4 л/моль=3 моль
В 1 моль вещества CO содержится 1 моль атомов углерода С, тогда в 3 моль СО будет содержаться такое количество атомов углерода:
ʋ(С)=ʋ(СO)=3 моль
2. Массу вещества рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.
M(С)=Ar(С) г/моль=12 г/моль
m(С)=ʋ(С)•M(С)=3 моль •12 г/моль=36 г
Ответ: 36 г
в) в 13 мг ацетилена С2Н2?
Дано: m(C2Н2)=13 мг
Найти: m(С)-?
Решение:
1. Количество вещества рассчитываем по формуле: ʋ=m/M, где M=Mr г/моль.
Mr(C2Н2)=2•Ar(С)+2•Ar(Н)=2•12+2•1=26, поэтому M(С2Н2)= 26 мг/ммоль
ʋ(С2Н2)=m(С2Н2)/M(С2Н2)=13 мг : 26 мг/ммоль=0,5 ммоль
В 1 моль вещества С2Н2 содержится 2 моль атомов углерода С, тогда в 0,5 ммоль С2Н2 будет содержаться такое количество атомов углерода:
ʋ(С)=2•ʋ(С2Н2)= 2•0,5 ммоль=1 ммоль
2. Массу вещества рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.
M(С)= Ar(С) г/моль =12 мг/ммоль
m(С)=ʋ(С)•M(С)=1 ммоль •12 мг/ммоль=12 мг
Ответ: 12 мг.
Упражнение 7. Расположите следующие газы в порядке возрастания их плотностей при н.у.: неон Ne, сернистый газ SO2, метан СН4, фтор F2, аммиак NН3.
Дано: Ne, SO2, СН4, F2, NН3
Найти: ρ(Ne)-?, ρ(SO2)-?, ρ(CH4)-?, ρ(F2)-?, ρ(NН3)-?.
Решение:
Рассчитываем плотность неона Ne.
M(Ne)=Ar(Ne)=20 г/моль
ρ(Ne)=M(Ne):VM=20 г/моль : 22,4 л/моль=0,893 г/л
Рассчитываем плотность сернистого газа SO2.
Mr(SO2)=Ar(S)+2•Ar(O)=32+2•16=64, M(SO2)=64 г/моль
ρ(SO2)= M(SO2):VM=64 г/моль : 22,4 л/моль = 2,86 г/л
Рассчитываем плотность метана СН4.
Mr(СН4)=Ar(C)+4•Ar(H)=12+4•1=16, M(СН4)=16 г/моль
ρ(СН4)= M(СН4):VM=16 г/моль : 22,4 л/моль = 0,71 г/л
Рассчитываем плотность фтора F2.
M(F2)=Mr(F2)=2•Ar(F)= 28 г/моль
ρ(F2)= M(F2):VM=28 г/моль : 22,4 л/моль = 1,25 г/л
Рассчитываем плотность аммиака NН3.
Mr(NН3)=Ar(N)+3•Ar(H)=14+3•1=17, M(NН3)=17 г/моль
ρ(NН3)= M(NН3):VM=17 г/моль : 22,4 л/моль = 0,76 г/л
ρ(СН4)<ρ(NН3)< ρ(Ne)<ρ(F2)<ρ(SO2)
Ответ: метан, аммиак, неон, фтор, сернистый газ.
Источник
Лев Грешилов
16 июня 2018 · 1,4 K
Так как у углерода есть несколько изотопов, то атомная масса его будет складываться как средневзвешенная масса всех существующих в природе изотопов с учетом распространенности их в земной коре и атмосфере
Как изменяется радиус атома в таблице менделеева?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️При движении по периоду слева направо радиус атома уменьшается. Почему?
????Число электронов на внешнем уровне возрастает
P. S. Число электронов равно номеру элемента в таблице Менделеева????
????Много электронов сильно давят на атомное ядро ➡️атом сжимается➡️радиус уменьшается
☘️По группе сверху вниз радиус возрастает, т. к.
????Возрастает число уровней, значит, для электронов больше свободного пространства в атоме
????Электроны всё меньше и меньше давят на ядро ➡️радиус увеличивается????
Прочитать ещё 1 ответ
Почему понятие “количества вещества” введено относительно именно 12 граммов, именно углерода и именно его нуклида (12 С)? Как удалось посчитать число Авогадро?
ALBA synchrotron, postdoc
Изначально атомную единицу массы ввели как массу атома водорода, что вполне логично, ибо он наиболее лёгкий. Но достаточно быстро оказалось, что такая атомная единица массы очень неудобна на практике, потому что далеко не все элементы образуют бинарные соединения с водородом, так что измерения чаще всего производились косвенным образом.
А вот с кислородом соединения образуют почти все элементы, и выходить на атомную массу через оксиды удобно. Поэтому на рубеже XIX-XX веков, когда требования к точности уже сильно выросли, было принято решение переопределить атомную единицу массы как 1/16 массы кислорода. Но примерно в это же время вовсю стала развиваться атомная физика и было открыто существование изотопов, в результате чего появилось сразу 2 шкалы – химическая, в которой атомная единица массы определялась через природную смесь изотопов кислорода, и физическая, в которой использовалась масса изотопа 16О.
В середине XX века возник метод масс-спектрометрии, который позволил определять массы атомов ещё точнее. При этом оказалось, что для него удобно брать в качестве стандарта не кислород, а углерод. Поэтому физическую шкалу переопределили через 12С. Одновременно оказалось, что такая шкала очень близка к действующей химической, поэтому IUPAC почти сразу поддержал эту идею и вместо двух шкал снова стала использоваться одна.
Примерно сколько атомов гелия содержится в 4 кг гелия?
Молодой-исследовать в области химии и ядерной физики ускорителей частиц, г. Падуя, Италия. · tele.click/real_italy
К уже правильному ответу предложу свое решение, для тех кто предпочитает формульные решения.
n = m/M = N / Na = V / Vm
где n – кол моль вещества
m – масса вещества – в г
M – молекулярная масса (в нашем случаи атомная масса) в г/моль
N – колл. составляющих (атомов или молекул)
Na – число Авгодаро 6,022 * 10^23
V – обьем в л
Vm – молекулярный обьем 22,4 л/моль
С помощью этой формулы можно решить очень много задач школьной химии
Подставляем известные и выражаем неизвестную величины:
N = (m * Na)/M = 4000г * 6,022 * 10^23 ) / 4 г/моль = 6,022 * 10^26
Прочитать ещё 2 ответа
Как определить молекулярную формулу углеводорода который содержит 85.7?
Меломан, киноман, самоучка – программист, любитель расширять свой кругозор.
В соединении массовая доля углерода – 85,7%, массовая доля водорода – 14,3%, плотность по водороду – 14. Вывести молекулярную формулу углеводорода.
Дано:
(C) = 85,7% (или 0,857),
(Н) = 14,3% (или 0,143),
D(H2) = 14.
Найти:
CxHy.
Решение
M(CxHy) = 14•2 = 28 г/моль.
Для 1 моль CxHy m(CxHy) = 28 г,
m(C) = 28 (г) •0,857 = 24 г,
n(C) = 24 (г) /12 (г/моль) = 2 моль,
m(Н) = 28 (г) •0,143 = 4 г,
n(Н) = 4 (г) /1 (г/моль) = 4 моль.
Формула углеводорода – С2Н4.
Делаем вывод, что молекула С2Н4 не насыщена атомами водород
Прочитать ещё 1 ответ
Источник
Задача 106.
При сгорании 4,3г углеводорода образовалось 13,2г СО2. Плотность пара углеводорода по водороду равна 43. Вывести молекулярную формулу вещества.
Решение:
Находим массу углерода, содержащуюся в образце углеводорода из пропорции:
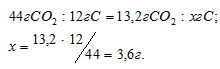
Теперь определим массу водорода, содержащуюся в образце углеводорода:
4,3 – 3,6 = 0,7г.
Обозначим числа атомов углерода и водорода в простейшей формуле углеводорода соответственно через атомные массы углерода и водорода равны соответственно 12 и 1. Поэтому массы углерода и водорода в составе углеводорода будут относиться как 12x : 1у. По условию задачи отношение масс углерода и водорода в образце углеводорода составляет: Следовательно, значения х и у можно найти из пропорции:
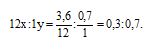
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
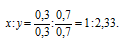
а затем умножим оба члена последнего отношения на 3, получим:
x : y = (1 . 3) : (2,33 . 3) = 3 : 7
Простейшая формула соединения будет иметь вид: С3Н7, которой отвечает молекулярная масса, равная 43. истинную молекулярную массу углеводорода находим исходя из его плотности по водороду:
M(СxНy) = D .M(H2) = 43 . 2 =86г/моль.
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
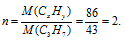
Теперь найденные значения x и y умножаем на 2, получаем: n(СxНy) = C6H14.
Истинная формула вещества будет иметь вид: C6H14.
Ответ: C6H14.
Задача 107.
При полном сгорании навески органического бромсодержащего вещества массой 1,88г получено 0,88г СО2 и 0,3г Н2O. После превращения всего брома, содержавшегося в навеске, в бромид серебра, получено 3,76г AgВr. Плотность паров вещества по водороду равна 94. Определить молекулярную формулу исследуемого вещества.
Решение:
Молекулярные массы углекислого газа, воды и бромида серебра соответственно равны 44, 18 и 187,8. Массы углерода, водорода брома, входящих в состав бромосодержащего органического вещества находим по массам образовавшихся углекислого газа, воды и бромида серебра. При этом учтём, что в одном моле СО2 содержится 12 г углерода, в одном моле Н2О – 2 г водорода, а в одном моле AgBr – 79,9 г брома. Находим массы углерода, водорода и брома, содержащихся СО2, Н2О и AgBr из пропорций:
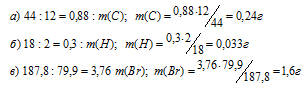
Таким образом, в сгоревшем образце бромосодержащего углеводорода содержится 0,24г углерода, 0,033г водорода и 1,6г брома. Так как сумма масс этих элементов равна массе навески сгоревшего вещества (1,88г), то кислорода в нём не содержится.
Обозначим числа атомов углерода, водорода и брома в простейшей формуле бромосодержащего углеводорода соответственно через Атомные массы углерода, водорода и брома равны соответственно 12, 1 и 79,9. Следовательно, значения можно найти из пропорции:
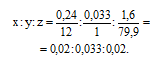
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
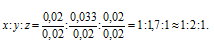
Простейшая формула соединения будет иметь вид: СН2Br, которой отвечает молекулярная масса, равная 93. Истинную молекулярную массу вещества находим исходя из его плотности по водороду:
M(СxНyBrz) = D . M(H2) = 94 . 2 =188г/моль.
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
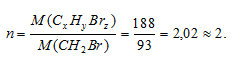
Теперь найденные значения x, y и z умножаем на 2, получаем: n(СxНyBrz) = С2Н4Br2).
Истинная формула вещества будет иметь вид: С2Н4Br2.
Ответ: С2Н4Br2.
Задача 108.
При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема СО2 и один объем N2. Найти молекулярную формулу газа.
Решение:
Обозначим один объём газа через и запишем схему уравнения реакции с учётом данных задачи, получим:
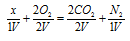
Из схемы вытекает, что газ, подвергшийся взрыву, состоит из двух атомов углерода (две молекулы СО2) и двух атомов азота (одна молекула N2). Формула будет иметь вид: С2N2. Уравнение реакции будет иметь вид:
С2N2 + 2O2 = 2CO2 + N2 .
Ответ: С2N2.
Задача 109.
Найти молекулярную формулу соединения бора с водородом, если масса 1ч чл этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2% (масс.).
Решение:
Известно, что один моль любого газа при нормальных условиях занимает объём 22,4 л. Молекулярная масса азота равна 28.
Так как массы соединения бора с водородом и азота равны, то можно вычислить массу 1 л этого соединения из пропорции:
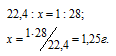
Здесь x – соединение водорода с бором.
Содержание водорода в веществе равно 21,8% (100 – 78,2 = 21,8).
Обозначим числа атомов бора и водорода в простейшей формуле исследуемого вещества соответственно через x и y. Атомные массы бора и водорода соответственно равны 10,8 и 1. Поэтому массы бора и водорода в веществе относятся как 10,8x : 1. По условию задачи отношение масс бора и водорода в исследуемом веществе равно 78,2 : 21,8. Следовательно, значения x и у можно найти из пропорции:
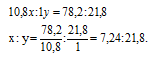
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
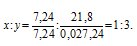
Простейшая формула соединения будет иметь вид: BH3. В обычных условиях существует гидрид бора состава B2H6.
Ответ: B2H6.
Задача 110.
Вычислить массу азота, содержащегося в 1 кг: а) калийной селитры KNO3; б) аммиачной селитры NH4NO3; в) аммофоса (NH4)2HPO4.
Решение:
а) M(KNO3) = 101,09 г/моль. Массу азота, входящую в состав 1 кг калийной селитры находим из пропорции:
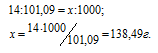
б) М(NH4NO3) = 80 г/моль. В молекуле аммиачной селитры содержится два атома азота. Массу азота, входящую в состав 1 кг аммиачной селитры находим из пропорции:
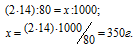
в) М[(NH4)2HPO4] = 132 г/моль. В молекуле аммофоса содержится два атома азота. Массу азота, входящую в состав 1 кг аммофоса находим из пропорции:
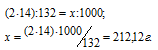
Ответ: а) 138,49 г; б) 350 г; в) 212,12 г.
Источник
