Какая масса уксусной кислоты содержится в 0 5 л

Опубликовано 1 год назад по предмету
Химия
от Anni18
масса уксусной кислоты которая содержится в 0,5 л раствора СН3СООН с массовой долей 80% (плотность 1,1г/мл).равно?
Не тот ответ, который вам нужен?
Найди нужный
Самые новые вопросы
![]()
Математика – 6 месяцев назад
Сколько здесь прямоугольников
![]()
История – 1 год назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
![]()
Литература – 1 год назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
![]()
Русский язык – 1 год назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
![]()
Русский язык – 1 год назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
![]()
Русский язык – 1 год назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
![]()
Физика – 1 год назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
Задачи на определение молярной концентрации вещества
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора. (2б)
В 100 мл раствора содержится 0,98 г серной кислоты. Определите молярную концентрацию данного раствора. (2б)
Из 2, 65 г карбоната натрия приготовили 250 мл раствора. Какова его молярная концентрация? (2б)
Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора? (2б)
Какая масса хлорида железа (lll) содержится в 150 мл 2М раствора? (2б)
Слили 300 мл 2 М и 200 мл 8 М раствора серной кислоты. Рассчитайте молярную концентрацию полученного раствора. (2б)
Какую массу нитрата аммония NН4NО3 надо взять для приготовления 5 л 2 М раствора? (2б)
Какой объем 38 % – го раствора HCL (р = 1,19 г/мл) надо взять, чтобы приготовить из него 2 л 2 М раствора? (3б)
Раствор серной кислоты с массовой долей H2SO4 30 % имеет плотность 1,219 г/мл. Какова молярная концентрация этого раствора? (3б)
Сульфат натрия массой 21,3 г растворили в 150 г воды, плотность полученного раствора 1,12 г/мл. Какова его молярная концентрация? (3б)
Какова молярная концентрация 10 % раствора гидроксида калия, плотность которого равна 1,09 г/мл? (3б)
Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массовой долей NaNO3 40 %, плотность которого 1,32 г/мл? (3б)
Какой объем раствора с массовой долей серной кислоты 9,3 % (p = 1,05 г/ мл) потребуется для приготовления 0,35 М раствора H2SO4 объемом 40 мл? (3б)
Какой объем раствора с массовой долей карбоната натрия 0,15 (плотностью1,16 г/мл) надо взять для приготовления раствора 0,45M Na2CO3 объемом120 мл? (3б)
В лаборатории имеется раствор 3М KCL. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCL 8% и плотностью 1,05 г/мл. (3б)
К воде массой 200 г прилили раствор 2М KCL объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCL в полученном растворе, если его плотность равна 1,015 г/мл. (4б)
Какой объем раствора 3 М Na CL плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCL 10 %? (4б)
К раствору 3,5 М NH4CL объемом 80 мл и плотностью 1,05 г/мл прилили воду
объемом 40 мл. Определите массовую долю соли в полученном растворе. (4б)
В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл. (4б)
Определите массовую долю хлорида кальция в растворе 1,4 М CaCL2, плотность которого равна 1,12 г/мл. (4б)
Упарили вдвое (по объему) 4 л 10 % -го раствора NaCL (р = 1,07 г/мл). Определите молярную концентрацию нового раствора. (4б)
Вычислите молярную концентрацию раствора с массовой долей серной кислоты
44 % и плотностью 1,34 г/мл. (4б)
Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 % – го раствора HNO3 (р= 1,5 г/мл) и 30 мл 48 % – го раствора HNO3(р= 1,3 г/мл), если полученный раствор имеет плотность р = 1,45 г/мл. (4б)
Эталоны ответов
1. Дано: Решение:
V р – ра = 500 мл n = 56 г/ 56г/моль = 1 моль
m кон = 56 г С = 1 моль / 0,5 л = 2 М
С – ? Ответ: 2 М
2. Дано: Решение:
V р – ра = 100 мл n = 0,98 г/ 98 г/моль = 0,01 моль
m н2SО4= 0,98 г С = 0,01 моль / 0,1 л = 0,1 моль
С – ? Ответ: 0,1 моль
3. Дано: Решение:
V р – ра = 250 мл n = 2,65 г/ 106 г/моль = 0,025 моль
m Na2CO3 = 2,65 г С = 0,025 моль / 0,25 л = 0,1 М
С – ? Ответ: 0,1 моль
4. Дано: Решение:
V р – ра = 200 мл n = С ∙ V = 0,2 М ∙ 0,2 л = 0,04 моль
С = 0,2 М m = n ∙ М = 0,04 моль ∙ 60 г/моль = 2,4 г
m сн3соон – ? Ответ: 2,4 г
5. Дано: Решение:
V р – ра = 150 мл n = С ∙ V = 2 М ∙ 0,15 л = 0,3 моль
С = 2 М m = n ∙ М = 0,3 моль ∙ 162,5 г/моль = 48,75 г
m FeCl3 – ? Ответ: 48,75 г
6. Дано: Решение:
V 1 = 300 мл 1.n1 = 2М ∙ 0,3 л = 0,6 моль


 С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
V2 = 200 мл 3. n3 = 0,6 моль + 1 ,6 моль = 2,2 моль
С 2 = 8 М 4.V3 = 0,3 л + 0,2 л = 0,5 л
С 3 -?
 5 . С 3 = 2,2 моль/0,5л =4,4 М
5 . С 3 = 2,2 моль/0,5л =4,4 М
Ответ: 4,4 М
7. Дано: Решение:
V р – ра =5 л n = С ∙ V = 2 М ∙ 5 л = 10 моль
С = 2 М m NH4NO3 = n ∙ М = 10 моль ∙ 80 г/моль = 800 г
m NH4NO3 – ? Ответ: 800 г
8.Дано: Решение:
ω р-ра = 38 % 1. n = 2М ∙ 2 л = 4 моль


 ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
Vр-ра 1 = 2 л 3. m р – ра = 146 г/0,38 = 384 г
m р – ра = 146 г/0,38 = 384 г
С = 2 М 4. V р-ра = 398 г / 1,19 г/мл = 322,6 мл
V -? Ответ: 322,6 мл
9. Дано: Решение:
m Na2 SO4 = 21,3г 1. m р-ра = 21,3 г + 150 г = 171,3 г
m

 воды = 150 г
воды = 150 г
ρ р-ра = 1,12 г/мл 2. n Na2SO4= 21,3 г /142г/моль = 0,15 моль
С – ? 3. V р-ра = 171,3 г /1,12г/мл ≈ 153 мл ≈ 0,153 л
4. С = 0,15 моль /0,153л ≈ 1М
Ответ: 1 М
10. Дано: Решение:
ωр-ра= 10 % 1.Берем объем раствора 1 л, тогда
ρ р-ра = 1,09 г/мл m р-ра = 1000 мл ∙ 1,09 г/мл = 1090 г
С – ? 

 2. m в-ва = 1090 г ∙ 0,1 = 109 г
2. m в-ва = 1090 г ∙ 0,1 = 109 г

3.n КОН = 109 г /56г/моль = 1,95 моль
4. С = 1,95 моль/1л = 1,95 М
Ответ: 1,95 М
11. Дано: Решение:
ω р-ра= 9,3 % 1.n = 0,35 М ∙ 0,04 л = 0,014 моль
ρ

 р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
С р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
V р-ра 1 = 40 мл = 0,04 л 4. V р-ра = 14,75 г / 1,05г/мл = 14 мл
Vр-ра – ? Ответ: 14 мл
12. Дано: Решение:
Vр-ра= 1 л 1.m р-ра = 1000мл ∙ 1,32 г/мл = 1320 г
ω

 р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
ρ р-ра= 1,32 г/моль 3. n NaNO3 = 528 г / 85г/моль = 6,2 моль
n NaNO 3 – ? Ответ: 6,2 моль
13. Дано: Решение:
С= 0,45 М 1.n = 0,45 М ∙ 0,12 л = 0,054 моль
V

 р-ра = 120 мл = 0,12 л
р-ра = 120 мл = 0,12 л
2. m в-ва = 0,054 моль ∙ 106 г/моль = 5,724 г
ω р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
ρ р-ра 1 = 1,16 г/мл 4. V р-ра = 38,16 г /1,16 г/мл = 32,9 мл
Vр-ра 1 – ? Ответ: 32,9 мл
14.Дано: Решение:
Vр-ра = 200 мл = 0,2 л 1.m р-ра = 200 мл ∙ 1,05 г/мл = 210 г
2. m в-ва = 0,08 ∙ 200 = 16,8 г
ω р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
ρ р-ра = 1,05 г/мл 4. 1 л р-ра – 223,5г в-ва
С= 3М х л – 16,8 г в-ва
x = (16,8 г∙ 1 л) /223,5г = 0,075 л = 75 мл
 V р-ра 1 – ?
V р-ра 1 – ?
Ответ: 75 мл
15.Дано: Решение:
m воды = 200 г 1.m р-ра = 40 мл ∙ 1,09 г/мл = 43,6 г
С = 2 М 2.n = 2 моль/л ∙ 0,04 л = 0,08 моль
V р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
ρ р-ра = 1,09 г/мл 4. m р-ра = 200 г+ 43,6 г = 243,6 г
ρ р-ра 1= 1,015 г/мл 5. V р-ра 1 = 243,6 г / 1,015г/мл = 240 мл = 0,24 л
С 1 – ? ω- ? 6. ωр-ра 1 = 5,96 г / 243,6 г ∙100 % = 2,45 %
 7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
Ответ: 0,33 М
16.Дано: Решение:
С = 3 М 1.n = 3М ∙ 1л = 3 моль
Ρ р-ра = 1,12 г/м 2. m в-ва = 3 моль ∙ 58,5 г/моль = 175,5 г
 m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
ω р-ра = 10 % 4. ωр-ра = 175,5 г / 1120г ∙100 % ≈ 15,7 %
V р-ра – ?
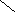
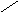 5. 15,7 % 10 м.ч
5. 15,7 % 10 м.ч
 10 %
10 %
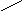

0 5,7 м.ч
6. 5,7 м.ч – 200 г 1 м.ч = 200 г/ 5,7 ≈ 35,1 г
10 м.ч = 351 г


 7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
Ответ: 314 мл
17. Дано: Решение:
С = 3,5 М 1.n = 3,5 М∙ 0,08 л = 0,28 моль
V р-ра = 80 мл = 0,08 л 2. m в-ва = 0,28 моль ∙ 53,5 г/моль = 14,98 г≈ 15 г
Р р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
Vводы = 40 мл 4. ω р-ра 1 = (15 г /124г) ∙ 100 % = 12,1 %
ω р-ра 1 – ? Ответ: 12,1 %
Дано: Решение:
m воды = 128 г 1.m сn. = 40 мл ∙ 0,8 г/мл = 32 г
V сn. = 40 мл 2. m р-ра = 128 г + 32 г = 160 г
 ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ р-ра = 0,97 г/мл 4.Vр-ра = 160 г /0,97 г/мл ≈ 165 мл = 0,165 л
С-? 5. С = 1 моль / 0,165 л ≈ 6,06 М
Ответ: 6,06 М
19. Дано: Решение:
С = 1,4 М 1.m р-ра = 1000 мл ∙ 1,12 г/мл = 1120 г
ρ р-ра = 1,12 г/мл 2.n = 1,4 М ∙ 1 л = 1,4 моль
ω  – ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
– ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
 4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
Ответ: 13,87 %
Дано: Решение:
V р-ра = 4 л 1.m р-ра = 4000 мл ∙ 1,07 г/мл = 4280 г
ω р-ра = 10 % 2. m в-ва = 4280 г ∙ 0,1 = 428 г
ρ р-ра = 1,07 г/мл 3.Vр-ра 1 = 4 л/ 2 = 2 л
С р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
5. С р-ра 1 = 7,3 моль / 2 л = 3,65 М
 Ответ: 3,65 М
Ответ: 3,65 М 
Дано: Решение:
ω р-ра = 44 % 1.m р-ра = 1000 мл ∙ 1,34 г/мл = 1340 г
ρ р-ра = 1,34 г/мл 2. m в-ва = 1340 г ∙ 0,44 = 589,6 г
С- ? 3. n = 589,6 г / 98 г/моль = 6 моль
 4. С = 6 моль / 1 л = 6 М
4. С = 6 моль / 1 л = 6 М
О твет: 6 М
твет: 6 М
Дано: Решение:
С = 2,1 М 1.m р-ра = 1000 мл ∙ 1,13 г/мл = 1130 г
ρ р-ра = 1,13 г/мл 2.n = 2,1 М ∙ 1 л = 2,1 моль
ω р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
 4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
Ответ: 18,2 %
Дано: Решение:
С= n/V
Vр-ра 1 = 40 мл 1.m р-ра 1 = 40 мл ∙ 1,5 г/мл = 60 г
ω р-ра 1 = 96 % 2.m в-ва 1 = 60 г ∙ 0,96 = 57,6 г
ρ р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
Vр-ра 2 = 30 мл 4. m в-ва 2 = 39 г ∙ 0,48 = 18,72 г
ω р-ра 2= 48 % 5. m р-ра 3 = 60 г + 39 г = 99 г
p р-ра 2 = 1,3 г/мл 6. Vр-ра 3 = 99 г / 1,45 г/мл = 68,3 мл = 0,0683 л
p р-ра 3 = 1,45 г/мл
С р-ра 3 – ? 7. n в-ва 3 = 57,6 г + 18,72 г = 1,21 моль
63,г/моль
 8.С = 1,21 моль / 0, 0683 л = 17,7 М
8.С = 1,21 моль / 0, 0683 л = 17,7 М
Ответ: 17,7 М
Источник
himikus27
Рада приветствовать всех читателей на канале о подготовке к ЕГЭ по химии. На канале Вы можете найти полезную инфографику, теорию, интересные задачи, тренировочные варианты, разборы задач для подготовки к ЕГЭ по химии. Воспользуйтесь путеводителем по каналу!
Очень часто при решении задач №27 их КИМов ЕГЭ по химии приходится встречаться со случаями приготовления растворов с определенной массовой долей растворенного вещества, смешением двух растворов разной концентрации или разбавлением раствора водой, упаривания раствора. Для решения подобных задач через формулу для массовой доли, часто необходимо провести объёмный арифметический расчет. Такие задачи на экзамене могут привести к ступору, увеличить вероятность математических ошибок. В подобных случаях незаменимым становится правило смешения («конверта Пирсона» или, что то же самое, правило креста). Оказалось, что многие дети с этим методом не знакомы, большинство учителей не уделяют ему внимание. Этот метод поможет решить задачи, которые дают как олимпиадные в 8-9 классах на химии, даже детям с очень слабым математическим аппаратом.
№27 Определите массу 14 %-го раствора соли, при добавлении к которому 10 г воды образуется раствор с массовой долей 8%. Ответ укажите в граммах с точностью до десятых.________________________________(ЕГЭ 2020. Основной период)
Если хочется больше пояснений, смотрим видео.
Ребята решали эту задачу тремя способами. Но смогли решить, у нас в регионе, только 56% от всех участников экзамена. В первом случае, за Х взяли массу раствора, за У массу вещества(см. картинку ниже). Составили систему уравнений, выразив массовые доли вещества в исходном и конечном растворах. Второй способ был более логичен, за Х взяли массу раствора, массу вещества выразили через массовую долю исходного раствора 0,14Х. Составили выражение для массовой доли конечного раствора. И только единицы воспользовались правилом креста.
При расчетах записывают одну над другой массовые доли растворенного вещества в исходных растворах, справа между ними – его массовую долю в растворе, который нужно приготовить, и вычитают по диагонали из большего меньшее значение. Разности их вычитаний показывают массовые доли для первого и второго растворов, необходимые для приготовления нужного раствора.
ЕГЭ по химии 2020
Даже не вооружённым глазом видно, какой из способов оказался более экономичным по времени и по силам на него затраченных. А на экзамене каждая минута дорога.
Я считаю, что ребята должны владеть всеми способами для решения этих задач. И подготовила подборку из 10 задач, которые легче решаются по правилу креста .
1.200 г горячего 30 %-го раствора соли охладили до комнатной температуры. Сколько граммов соли выпадет в осадок, если насыщенный при комнатной температуре раствор содержит 20 % соли по массе? Осадок представляет собой безводную соль.Ответ дайте в граммах и округлите до ближайшего целого числа.( Ответ: 25г)
2.При охлаждении 400 г горячего 50 %-го раствора нитрата калия выпал осадок, не содержащий кристаллизационной воды. Чему равна масса осадка, если раствор над осадком содержал 34 % нитрата калия по массе? Ответ дайте в граммах и округлите до ближайшего целого числа.(Ответ: 97г)
3.Вычислите массу 5 %-го раствора вещества, который надо добавить к 120 г 30 %-го раствора, чтобы получить 15 %-й раствор. Ответ дайте в граммах с точностью до целых. (Ответ: 180г)
4.Сколько граммов 63 %-го раствора азотной кислоты надо добавить к 244 г воды, чтобы получить 10 %-й раствор? Ответ округлите до ближайшего целого числа.(Ответ: 46 г)
5.Вычислите массу воды, которую нужно добавить к 50 г 20 %-го раствора соляной кислоты, чтобы уменьшить её концентрацию до 10 %. Ответ укажите в граммах с точностью до целых. (Ответ: 50 г)
6.Сколько граммов семиводного кристаллогидрата потребуется для приготовления 200 г 12 %-го раствора сульфата магния? Ответ приведите с точностью до десятых. (Ответ: 49,2 г)
7.Вычислите массу гидроксида калия, который необходимо растворить в 150 г воды для получения раствора с массовой долей щёлочи 25 %. (Ответ: 50г)
8.Сколько граммов 65 %-го раствора азотной кислоты надо смешать с 270 г 10 %-го раствора этого вещества, чтобы получить 20 %-й раствор? Ответ выразите в виде целого числа. (Ответ: 60г)
9.Вычислите массу воды, которую надо добавить к 200 г 63 %-й азотной кислоты, чтобы получить 15 %-ю кислоту. Ответ дайте в граммах с точностью до целых. (Ответ: 640г)
10.Вычислите массу 15 %-го раствора вещества, который можно получить разбавлением 200 г 36 %-го раствора. Ответ дайте в граммах с точностью до целых. (Ответ: 480г)
Задачи, представленные ниже, легче решать через формулу для массовой доли вещества.
1.Растворяя соль в горячей воде, приготовили 300 г 40 %-го раствора. При охлаждении раствора из него выпало 50 г осадка безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте в процентах с точностью до целых. (Ответ: 28%)
2.В 200 г воды растворили 85,8 г кристаллической соды (десятиводного карбоната натрия). Чему равна массовая доля карбоната натрия в полученном растворе? Ответ дайте в процентах и округлите до ближайшего целого числа. (Ответ: 11%)
3.Раствор массой 220 г, содержащий 21,0 % растворенной соли, упарили на водяной бане, в результате его масса уменьшилась на 45 г. Чему равна массовая доля соли в новом растворе? Ответ дайте в процентах и округлите до десятых. (Ответ: 26,4 %)
4.К 75 г раствора с массовой долей соли 14 % добавили 10 г той же соли и 10 мл воды. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до десятых. (Ответ: 21,6%)
5.Раствор массой 120 г, содержащий 17,0 % растворенной соли, оставили на некоторое время на открытом воздухе. За это время его масса уменьшилась на 16 г. Чему равна массовая доля соли в новом растворе? Ответ дайте в процентах и округлите до десятых. (Ответ: 19,6%)
В следующей статье разберём решение нескольких задач из этой подборки, а также готовится статья по 30-31 заданиям из реального ЕГЭ по химии 2020. Не пропустите. Буду рада вашим замечаниям, мои внимательные читатели, а также оценкам и комментариям, они помогают развитию канала.
Твой репетитор по химии ???? Намёткина Светлана Александровна
Источник
- Главная
химия
Gigabit123
23 дек. 2014 г., 4:20:38 (5 лет назад)
Ps281
23 дек. 2014 г., 5:04:01 (5 лет назад)
m(р-ра)=PV=1.1 *500=550 г
m(Ch3-COOH)=m(р-ра)*W(Ch3-COOH)=550 * 0.8=440 г
Ответить
Другие вопросы из категории
Chksyusha / 18 дек. 2014 г., 19:50:12
путём электронного баланса составьте уравнения
следующих окислительно востановительных реакций С+HNO3=CO2+NO+H2O,
H2S+H2SO3=S+H2O, KI+KIO3+H2SO4=
I2+K2SO4+H2O
Помогите пожалуйста очень надо…. Пожалуйста помогите
Faint1fix / 07 дек. 2014 г., 4:25:28
А 1. Общая формула алкадиенов: 1) Сn H2n 3) CnH2n-2 2) CnH2n+2 4) CnH2n-6 А 2. Название вещества, формула которого СН3─СН2─СН2─СН(СН3)─СОН 1)
2-метилпентаналь 3) 4-метилпентаналь 2) 2-метилпентанол 4) пентаналь А 3. Вид гибридизации электронных орбиталей атома углерода, обозначенного звёздочкой в веществе, формула которого СН3─С∗≡СН 1) sp3 3) sp 2) sp2 4) не гибридизирован А 4. Только σ-связи присутствуют в молекуле 1) ацетилена 3) 2-мтилбутена-2 2) изобутана 4) метилбензола А 5. Гомологами являются 1) этин и этен 3) циклобутан и бутан 2) пропан и бутан 4) этен и метан А 6. Изомерами являются: 1) пентан и пентадиен 3) этанол и этаналь 2) уксусная кислота и метилформиат 4) этан и ацетилен А 7. Окраска смеси белка с гидроксидом меди (ΙΙ) 1) голубая 3) красная 2) синяя 4) фиолетовая А 8. Анилин из нитробензола можно получить при помощи реакции: 1) Вюрца 3) Кучерова 2) Зинина 4) Лебедева А 9. Какие вещества можно использовать для последовательного осуществления следующих превращений С2Н5ОН → С2Н5Сl → С4Н10 1) O2, Na 3) HСl, NaОН 2) HСl, Na 4) NaCl, Na А 10. Объём этана, необходимый для получения 4 л углекислого газа 1) 2л 3) 10 л 2) 4 л 4) 6 л Б 1. Установите соответствие между молекулярной формулой органического вещества и классом, к которому оно относится А) С4Н6 1) арены Б) С4Н8О2 2) углеводы В) С7Н8 3) альдегиды Г) С5Н10О5 4) сложные эфиры 5) алкины Б 2. Фенол реагирует с 1) натрием 2) кислородом 3) гидроксидом натрия 4) оксидом кремния (ΙV) 5) бензолом 6) хлороводородом Б 3. И для метана, и для пропена характерны 1) реакции бромирования 2) sp-гибридизация атомов углерода в молекулах 3) наличие π-связей в молекулах 4) реакция гидрирования 5) горение на воздухе 6) малая растворимость в воде Б 4. Молекулярная формула углеводорода, массовая доля водорода в котором 15,79 %, а относительная плотность паров по воздуху 3, 93 ________ С 1. Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме СН4 → СН3Сl → С2Н6 → С2Н4 → С2Н5ОН → НСООС2Н5 ↓ СО2 С 2. Рассчитайте массу сложного эфира, полученного при взаимодействии 46 г 50% раствора муравьиной кислоты и этилового спирта, если выход продукта реакции составляет 80% от теоретически возможного.
Читайте также
Томаочка / 11 дек. 2014 г., 5:42:29
1. Рассчитайте объем хлоридоводорода, приведенный к нормальным условиям, который содержится в 200 г соляной кислоты с массовой долей HCI
14,6 %.
2. К 60 мл раствора соляной кислоты с массовой долей HCI 20 % и плотностью 1,1 г/мл добавили избыток цинка. Рассчитайте, какую массу хлорида цинка можно будет выделить из полученного раствора.
3. В лаборатории имеется раствор с массовой долей серной кислоты 0,1 (или 10 %). Какая масса этого раствора потребуется для растворения 1,8 г магния?
4. К 50 мл раствора с массовой долей H2SO4 12% (плотность 1,8 г/мл) добавили избыток раствора хлорида бария. Определите массу образовавшегося осадка.
5. Расчитатйте массу гидроксида кальция, который можно нейтрализовать с помощью 630 г раствора азотной кислоты, в которой массовая доля NHO3 равно 20 %.
6. В щелочных аккамуляторах используют раствор гидроксида калия (массовая доля КОН 30%, плотность 1,29 г/мл). Рассчитайте количество вещества гидроксида калия, который потребуется для приготовления такого раствора объемом 5 л.
7. В воде массой 250 г растворен гидроксид кальция. При действии избытка карбоната калия на этот раствор образовался осадок массой 3 г. Вычислите массовую долю гидроксида кальция в исходном растворе.
8. К водному раствору хромата натрия массой 50 г прилили избыток раствора хлорида бария. Образовался осадок массой 5,06 г. Вычислите массовую долю хромата натрия в исходном растворе.
Вы находитесь на странице вопроса “масса уксусной кислоты которая содержится в 0,5 л раствора СН3СООН с массовой долей 80% (плотность 1,1г/мл).равно?“, категории “химия“. Данный вопрос относится к разделу “10-11” классов. Здесь вы сможете получить ответ, а также обсудить вопрос с посетителями сайта. Автоматический умный поиск поможет найти похожие вопросы в категории “химия“. Если ваш вопрос отличается или ответы не подходят, вы можете задать новый вопрос, воспользовавшись кнопкой в верхней части сайта.
Источник

Ответ
Ответ дан
afdf
m(р-ра)=PV=1.1 *500=550 г
m(Ch3-COOH)=m(р-ра)*W(Ch3-COOH)=550 * 0.8=440 г