Какая масса уксусной кислоты содержится в 0 5 л раствора
Опубликовано 1 год назад по предмету
Химия
от Anni18
масса уксусной кислоты которая содержится в 0,5 л раствора СН3СООН с массовой долей 80% (плотность 1,1г/мл).равно?
Не тот ответ, который вам нужен?
Найди нужный
Самые новые вопросы
![]()
Математика – 6 месяцев назад
Сколько здесь прямоугольников
![]()
История – 1 год назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
![]()
Литература – 1 год назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
![]()
Русский язык – 1 год назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
![]()
Русский язык – 1 год назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
![]()
Русский язык – 1 год назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
![]()
Физика – 1 год назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
Задачи на определение молярной концентрации вещества
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора. (2б)
В 100 мл раствора содержится 0,98 г серной кислоты. Определите молярную концентрацию данного раствора. (2б)
Из 2, 65 г карбоната натрия приготовили 250 мл раствора. Какова его молярная концентрация? (2б)
Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора? (2б)
Какая масса хлорида железа (lll) содержится в 150 мл 2М раствора? (2б)
Слили 300 мл 2 М и 200 мл 8 М раствора серной кислоты. Рассчитайте молярную концентрацию полученного раствора. (2б)
Какую массу нитрата аммония NН4NО3 надо взять для приготовления 5 л 2 М раствора? (2б)
Какой объем 38 % – го раствора HCL (р = 1,19 г/мл) надо взять, чтобы приготовить из него 2 л 2 М раствора? (3б)
Раствор серной кислоты с массовой долей H2SO4 30 % имеет плотность 1,219 г/мл. Какова молярная концентрация этого раствора? (3б)
Сульфат натрия массой 21,3 г растворили в 150 г воды, плотность полученного раствора 1,12 г/мл. Какова его молярная концентрация? (3б)
Какова молярная концентрация 10 % раствора гидроксида калия, плотность которого равна 1,09 г/мл? (3б)
Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массовой долей NaNO3 40 %, плотность которого 1,32 г/мл? (3б)
Какой объем раствора с массовой долей серной кислоты 9,3 % (p = 1,05 г/ мл) потребуется для приготовления 0,35 М раствора H2SO4 объемом 40 мл? (3б)
Какой объем раствора с массовой долей карбоната натрия 0,15 (плотностью1,16 г/мл) надо взять для приготовления раствора 0,45M Na2CO3 объемом120 мл? (3б)
В лаборатории имеется раствор 3М KCL. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCL 8% и плотностью 1,05 г/мл. (3б)
К воде массой 200 г прилили раствор 2М KCL объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCL в полученном растворе, если его плотность равна 1,015 г/мл. (4б)
Какой объем раствора 3 М Na CL плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCL 10 %? (4б)
К раствору 3,5 М NH4CL объемом 80 мл и плотностью 1,05 г/мл прилили воду
объемом 40 мл. Определите массовую долю соли в полученном растворе. (4б)
В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл. (4б)
Определите массовую долю хлорида кальция в растворе 1,4 М CaCL2, плотность которого равна 1,12 г/мл. (4б)
Упарили вдвое (по объему) 4 л 10 % -го раствора NaCL (р = 1,07 г/мл). Определите молярную концентрацию нового раствора. (4б)
Вычислите молярную концентрацию раствора с массовой долей серной кислоты
44 % и плотностью 1,34 г/мл. (4б)
Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 % – го раствора HNO3 (р= 1,5 г/мл) и 30 мл 48 % – го раствора HNO3(р= 1,3 г/мл), если полученный раствор имеет плотность р = 1,45 г/мл. (4б)
Эталоны ответов
1. Дано: Решение:
V р – ра = 500 мл n = 56 г/ 56г/моль = 1 моль
m кон = 56 г С = 1 моль / 0,5 л = 2 М
С – ? Ответ: 2 М
2. Дано: Решение:
V р – ра = 100 мл n = 0,98 г/ 98 г/моль = 0,01 моль
m н2SО4= 0,98 г С = 0,01 моль / 0,1 л = 0,1 моль
С – ? Ответ: 0,1 моль
3. Дано: Решение:
V р – ра = 250 мл n = 2,65 г/ 106 г/моль = 0,025 моль
m Na2CO3 = 2,65 г С = 0,025 моль / 0,25 л = 0,1 М
С – ? Ответ: 0,1 моль
4. Дано: Решение:
V р – ра = 200 мл n = С ∙ V = 0,2 М ∙ 0,2 л = 0,04 моль
С = 0,2 М m = n ∙ М = 0,04 моль ∙ 60 г/моль = 2,4 г
m сн3соон – ? Ответ: 2,4 г
5. Дано: Решение:
V р – ра = 150 мл n = С ∙ V = 2 М ∙ 0,15 л = 0,3 моль
С = 2 М m = n ∙ М = 0,3 моль ∙ 162,5 г/моль = 48,75 г
m FeCl3 – ? Ответ: 48,75 г
6. Дано: Решение:
V 1 = 300 мл 1.n1 = 2М ∙ 0,3 л = 0,6 моль


 С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
V2 = 200 мл 3. n3 = 0,6 моль + 1 ,6 моль = 2,2 моль
С 2 = 8 М 4.V3 = 0,3 л + 0,2 л = 0,5 л
С 3 -?
 5 . С 3 = 2,2 моль/0,5л =4,4 М
5 . С 3 = 2,2 моль/0,5л =4,4 М
Ответ: 4,4 М
7. Дано: Решение:
V р – ра =5 л n = С ∙ V = 2 М ∙ 5 л = 10 моль
С = 2 М m NH4NO3 = n ∙ М = 10 моль ∙ 80 г/моль = 800 г
m NH4NO3 – ? Ответ: 800 г
8.Дано: Решение:
ω р-ра = 38 % 1. n = 2М ∙ 2 л = 4 моль


 ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
Vр-ра 1 = 2 л 3. m р – ра = 146 г/0,38 = 384 г
m р – ра = 146 г/0,38 = 384 г
С = 2 М 4. V р-ра = 398 г / 1,19 г/мл = 322,6 мл
V -? Ответ: 322,6 мл
9. Дано: Решение:
m Na2 SO4 = 21,3г 1. m р-ра = 21,3 г + 150 г = 171,3 г
m

 воды = 150 г
воды = 150 г
ρ р-ра = 1,12 г/мл 2. n Na2SO4= 21,3 г /142г/моль = 0,15 моль
С – ? 3. V р-ра = 171,3 г /1,12г/мл ≈ 153 мл ≈ 0,153 л
4. С = 0,15 моль /0,153л ≈ 1М
Ответ: 1 М
10. Дано: Решение:
ωр-ра= 10 % 1.Берем объем раствора 1 л, тогда
ρ р-ра = 1,09 г/мл m р-ра = 1000 мл ∙ 1,09 г/мл = 1090 г
С – ? 

 2. m в-ва = 1090 г ∙ 0,1 = 109 г
2. m в-ва = 1090 г ∙ 0,1 = 109 г

3.n КОН = 109 г /56г/моль = 1,95 моль
4. С = 1,95 моль/1л = 1,95 М
Ответ: 1,95 М
11. Дано: Решение:
ω р-ра= 9,3 % 1.n = 0,35 М ∙ 0,04 л = 0,014 моль
ρ

 р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
С р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
V р-ра 1 = 40 мл = 0,04 л 4. V р-ра = 14,75 г / 1,05г/мл = 14 мл
Vр-ра – ? Ответ: 14 мл
12. Дано: Решение:
Vр-ра= 1 л 1.m р-ра = 1000мл ∙ 1,32 г/мл = 1320 г
ω

 р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
ρ р-ра= 1,32 г/моль 3. n NaNO3 = 528 г / 85г/моль = 6,2 моль
n NaNO 3 – ? Ответ: 6,2 моль
13. Дано: Решение:
С= 0,45 М 1.n = 0,45 М ∙ 0,12 л = 0,054 моль
V

 р-ра = 120 мл = 0,12 л
р-ра = 120 мл = 0,12 л
2. m в-ва = 0,054 моль ∙ 106 г/моль = 5,724 г
ω р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
ρ р-ра 1 = 1,16 г/мл 4. V р-ра = 38,16 г /1,16 г/мл = 32,9 мл
Vр-ра 1 – ? Ответ: 32,9 мл
14.Дано: Решение:
Vр-ра = 200 мл = 0,2 л 1.m р-ра = 200 мл ∙ 1,05 г/мл = 210 г
2. m в-ва = 0,08 ∙ 200 = 16,8 г
ω р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
ρ р-ра = 1,05 г/мл 4. 1 л р-ра – 223,5г в-ва
С= 3М х л – 16,8 г в-ва
x = (16,8 г∙ 1 л) /223,5г = 0,075 л = 75 мл
 V р-ра 1 – ?
V р-ра 1 – ?
Ответ: 75 мл
15.Дано: Решение:
m воды = 200 г 1.m р-ра = 40 мл ∙ 1,09 г/мл = 43,6 г
С = 2 М 2.n = 2 моль/л ∙ 0,04 л = 0,08 моль
V р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
ρ р-ра = 1,09 г/мл 4. m р-ра = 200 г+ 43,6 г = 243,6 г
ρ р-ра 1= 1,015 г/мл 5. V р-ра 1 = 243,6 г / 1,015г/мл = 240 мл = 0,24 л
С 1 – ? ω- ? 6. ωр-ра 1 = 5,96 г / 243,6 г ∙100 % = 2,45 %
 7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
Ответ: 0,33 М
16.Дано: Решение:
С = 3 М 1.n = 3М ∙ 1л = 3 моль
Ρ р-ра = 1,12 г/м 2. m в-ва = 3 моль ∙ 58,5 г/моль = 175,5 г
 m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
ω р-ра = 10 % 4. ωр-ра = 175,5 г / 1120г ∙100 % ≈ 15,7 %
V р-ра – ?
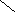
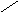 5. 15,7 % 10 м.ч
5. 15,7 % 10 м.ч
 10 %
10 %
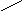

0 5,7 м.ч
6. 5,7 м.ч – 200 г 1 м.ч = 200 г/ 5,7 ≈ 35,1 г
10 м.ч = 351 г


 7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
Ответ: 314 мл
17. Дано: Решение:
С = 3,5 М 1.n = 3,5 М∙ 0,08 л = 0,28 моль
V р-ра = 80 мл = 0,08 л 2. m в-ва = 0,28 моль ∙ 53,5 г/моль = 14,98 г≈ 15 г
Р р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
Vводы = 40 мл 4. ω р-ра 1 = (15 г /124г) ∙ 100 % = 12,1 %
ω р-ра 1 – ? Ответ: 12,1 %
Дано: Решение:
m воды = 128 г 1.m сn. = 40 мл ∙ 0,8 г/мл = 32 г
V сn. = 40 мл 2. m р-ра = 128 г + 32 г = 160 г
 ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ р-ра = 0,97 г/мл 4.Vр-ра = 160 г /0,97 г/мл ≈ 165 мл = 0,165 л
С-? 5. С = 1 моль / 0,165 л ≈ 6,06 М
Ответ: 6,06 М
19. Дано: Решение:
С = 1,4 М 1.m р-ра = 1000 мл ∙ 1,12 г/мл = 1120 г
ρ р-ра = 1,12 г/мл 2.n = 1,4 М ∙ 1 л = 1,4 моль
ω  – ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
– ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
 4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
Ответ: 13,87 %
Дано: Решение:
V р-ра = 4 л 1.m р-ра = 4000 мл ∙ 1,07 г/мл = 4280 г
ω р-ра = 10 % 2. m в-ва = 4280 г ∙ 0,1 = 428 г
ρ р-ра = 1,07 г/мл 3.Vр-ра 1 = 4 л/ 2 = 2 л
С р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
5. С р-ра 1 = 7,3 моль / 2 л = 3,65 М
 Ответ: 3,65 М
Ответ: 3,65 М 
Дано: Решение:
ω р-ра = 44 % 1.m р-ра = 1000 мл ∙ 1,34 г/мл = 1340 г
ρ р-ра = 1,34 г/мл 2. m в-ва = 1340 г ∙ 0,44 = 589,6 г
С- ? 3. n = 589,6 г / 98 г/моль = 6 моль
 4. С = 6 моль / 1 л = 6 М
4. С = 6 моль / 1 л = 6 М
О твет: 6 М
твет: 6 М
Дано: Решение:
С = 2,1 М 1.m р-ра = 1000 мл ∙ 1,13 г/мл = 1130 г
ρ р-ра = 1,13 г/мл 2.n = 2,1 М ∙ 1 л = 2,1 моль
ω р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
 4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
Ответ: 18,2 %
Дано: Решение:
С= n/V
Vр-ра 1 = 40 мл 1.m р-ра 1 = 40 мл ∙ 1,5 г/мл = 60 г
ω р-ра 1 = 96 % 2.m в-ва 1 = 60 г ∙ 0,96 = 57,6 г
ρ р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
Vр-ра 2 = 30 мл 4. m в-ва 2 = 39 г ∙ 0,48 = 18,72 г
ω р-ра 2= 48 % 5. m р-ра 3 = 60 г + 39 г = 99 г
p р-ра 2 = 1,3 г/мл 6. Vр-ра 3 = 99 г / 1,45 г/мл = 68,3 мл = 0,0683 л
p р-ра 3 = 1,45 г/мл
С р-ра 3 – ? 7. n в-ва 3 = 57,6 г + 18,72 г = 1,21 моль
63,г/моль
 8.С = 1,21 моль / 0, 0683 л = 17,7 М
8.С = 1,21 моль / 0, 0683 л = 17,7 М
Ответ: 17,7 М
Источник
Формат ответа: цифра или несколько цифр, слово или несколько слов. Вопросы на соответствие “буква” – “цифра” должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Примеры ответов: 7 или здесьисейчас или 3514
Раскрыть
Скрыть
Какая масса азотной кислоты содержится в 1 л её 20%-ного раствора с плотностью 1,05 г/мл?
Для реакции 470 г фенола с образованием тринитрофенола потребуется 90%-ный раствор азотной кислоты массой ___ г. Запишите число с точностью до целых.
Масса 92%-ного раствора этанола, необходимого для получения 1,12 л этилена (н.у.), равна ___ г. Ответ округлите до целых.
Через раствор, содержащий 44,1 г серной кислоты, пропустили аммиак до образования средней соли. Объём (н.у.) прореагировавшего газа составил ___ л. Запишите число с точностью до сотых.
Через раствор, содержащий 29,4 г серной кислоты, пропустили аммиак до образования средней соли. Объём (н.у.) прореагировавшего газа составил ___ л. Запишите число с точностью до сотых.
Объем воздуха (н.у.), необходимый для полного сжигания 50 л метана (н.у.), равен ___ л. Запишите число с точностью до целых.
Объем воздуха (н.у.), необходимый для сжигания 32 л (н.у.) угарного газа, равен ___ л. Запишите число с точностью до целых.
Объем воздуха (н.у.), необходимый для полного сгорания 60 л (н.у.) этилена, равен ___ л. Запишите число с точностью до целых.
Объем газа (н.у.), который образуется при горении 40 л метана в 40 л кислорода, равен ___ л. Запишите число с точностью до целых.
Какая масса кислорода затратится на сжигание 16 г водорода? Запишите число с точностью до целых.
Какая масса осадка образуется при взаимодействии 4 г гидроксида натрия с достаточным количеством хлорида железа (II)? (Ответ округлите до десятых)
Какой объём кислорода (н.у.) требуется для окисления 7,8 г калия? Запишите число с точностью до целых.
Какой объём (н.у.) углекислого газа выделится при взаимодействии 0,25 моль карбоната натрия с избытком соляной кислоты? Запишите число с точностью до десятых.
Какой объём (н.у.) газа выделится при растворении 42 г карбоната магния в избытке соляной кислоты? Запишите число с точностью до десятых.
Какую массу йода можно получить при взаимодействии 0,5 моль йодида кальция с необходимым количеством хлора? Запишите число с точностью до целых.
Какой объём (н.у.) газа выделится при растворении 25 г карбоната кальция в избытке уксусной кислоты? Запишите число с точностью до десятых.
Какой объём хлороводорода может вступить в реакцию с 186 г анилина? Запишите число с точностью до десятых.
При растворении оксида меди(II) в серной кислоте образовалась безводная соль массой 40 г. Рассчитайте массу оксида меди, вступившего в реакцию. Запишите число с точностью до целых.
Какой объём аммиака (н.у.) вступил в реакцию с раствором серной кислоты, если при этом образовался сульфат аммония количеством вещества 0,3 моль? Запишите число с точностью до сотых.
Какой объём (н.у.) водорода выделится при взаимодействии 0,75 моль магния с избытком соляной кислоты? Запишите число с точностью до десятых.
При сливании раствора нитрата серебра с избытком раствора бромида натрия образовался осадок массой 37,6 г. Вычислите массу нитрата серебра в исходном растворе. Запишите число с точностью до целых.
211,2 г гидрофосфата аммония (80% от теоретического количества) были получены при взаимодействии необходимого количества ортофосфорной кислоты и аммиака. Вычислите, какой объём (н.у.) газа был использован. Запишите число с точностью до десятых.
Какой объём (н.у.) газа выделится при взаимодействии 128 г меди с концентрированной азотной кислотой? Запишите число с точностью до десятых.
Рассчитайте максимальный объём (н.у.) хлороводорода, который может присоединиться к 0,25 моль ацетилена. Запишите число с точностью до десятых.
Какой объём (н.у.) оксида серы(IV) выделяется при взаимодействии 0,4 моль сульфита натрия с избытком раствора серной кислоты? Запишите число с точностью до сотых.
Рассчитайте массу газа, выделяющегося при взаимодействии избытка воды на 1,5 моль карбида кальция. Запишите число с точностью до целых.
При растворении карбоната калия в избытке азотной кислоты выделилось 4,48 л (н.у.) газа. Сколько граммов карбоната калия вступило в реакцию. Запишите число с точностью до десятых.
Какая масса брома может выделиться при взаимодействии 0,3 моль бромида натрия с хлором? Запишите число с точностью до целых.
Какой объём хлороводорода (н.у.) необходим для получения 17,7 г. хлоропрена при взаимодействии с необходимым количеством винилацетилена? Запишите число с точностью до сотых.
Рассчитайте массу серной кислоты, необходимой для полной нейтрализации 120 г гидроксида натрия? Запишите число с точностью до целых.
Какой объём (н.у.) водорода выделится при взаимодействии 0,4 моль калия с избытком воды? Запишите число с точностью до сотых.
Вычислите массу осадка, который образуется при взаимодействии 9,4 г фенола с 40 г 20%-ного раствора брома в воде. Запишите число с точностью до десятых.
Какая масса алюминия потребуется для восстановления 0,6 моль железной окалины? Запишите число с точностью до десятых.
Какой объём ацетилена (н.у.) теоретически необходим для получения 376 г 1,1-дибромэтана? Запишите число с точностью до десятых.
Рассчитайте массу гидроксида натрия, необходимого для нейтрализации 300 г уксусной кислоты. Запишите число с точностью до целых.
При сливании раствора нитрата серебра с избытком раствора хлорида натрия образовался осадок массой 28,7 г. Рассчитайте массу нитрата серебра в исходном растворе. Запишите число с точностью до целых.
При растворении карбоната натрия в избытке соляной кислоты выделилось 4,48 л (н.у.) газа. Вычислите массу прореагировавшего карбоната натрия. Запишите число с точностью до десятых.
Какой объём газа (н.у.) выделится при полном разложении 183,75 г хлората калия в присутствии диоксида марганца? Запишите число с точностью до десятых.
Источник


Ответ
Ответ дан
afdf
m(р-ра)=PV=1.1 *500=550 г
m(Ch3-COOH)=m(р-ра)*W(Ch3-COOH)=550 * 0.8=440 г