Какая существует связь между структурой воды и ее свойствами

Вода – очень сложная и малоизученная система. Структура воды динамична. Слабые водородные связи объединяются в цепи. В воде ассоциаты молекул легко образуются, распадаются и переходят друг в друга. При этом они подвергаются воздействию многих факторов, которые раньше вообще не учитывались и не изучались традиционной наукой.
Память воды
Наукой доказано, что физические свойства воды и многочисленные кратковременные водородные связи соседних атомов кислорода и водорода в молекуле воды образуют особые структуры-ассоциаты (кластеры). Они способны воспринимать, хранить и передавать всевозможную информацию.
Кластер – это структурная единица воды. Он состоит из клатратов, природу которых определяют дальние кулоновские силы. Структура воды хранит закодированную информацию о взаимодействиях, которые происходили между водяными молекулами. Таким образом, вода, структура которой включает множество разнотипных кластеров, образует пространственную иерархическую жидкокристаллическую структуру, способную воспринимать и сохранять значительные объемы информации.
Структурирование воды
Подвергаясь воздействию многих факторов, вода структурируется, приобретая регулярное особое строение, например, в процессе замораживания и оттаивания обычной воды, при поляризации молекул, воздействии постоянного электромагнитного и магнитного поля. Структура воды и ее свойства изменяются также в результате биоэнергетического воздействия человека, механических воздействий (перемешивания, встряхивания, течения в различных режимах и т.д.), в том числе их всевозможных сочетаний. Она приобретает новые свойства и становится активной. Структурированная вода способна оказывать воздействие на организм. Ее еще называют «живой» водой.
Талая вода, по сравнению с водой обычной, состоит из огромного количества многомолекулярных кластеров, сохраняющих длительное время «снежинко-подобное» рыхлое состояние.
Структура воды, которая подвергалась замораживанию, придает жидкости внутреннюю динамику и эффект сильного «биологического воздействия». Оно сохраняется длительное время. Например, показатель рН талой воды становится 7,3, т.е. жидкость становится более щелочной, уменьшается электрическое сопротивление, уменьшается ОВП (окислительно-восстановительный потенциал).
Вода – это источник слабого и сверхслабого электромагнитного излучения. Такое излучение структурированной воды наименее хаотичное, что иногда приводит к индукции определенного электромагнитного поля. Поле влияет на структурно-информационные характеристики «живых» биологических объектов, распространяя заряд по молекулярной цепочке диполей воды.
В роли переносчиков информации могут выступать физические поля различной природы. Ученые установили, что структура воды способна взаимодействовать на информационном уровне при помощи акустических, электромагнитных и других полей с объектами, обладающими различными природными свойствами.
Структура воды, подвергшейся воздействию магнитного поля, улучшается. Она становится более структурированной. В жидкости возрастает скорость реакций, кристаллизуются растворенные вещества, процессы адсорбции становятся более интенсивными, улучшается выпадение в осадок примесей. Скорее всего, целительное биологическое воздействие, которое оказывает вода структурированная на человеческий организм, связано с тем, что насосы клеточных мембран тканей и органов пропускают молекулы «живой» воды с более высокой скоростью, потому что структура воды, в данном случае, напоминает структуру самой клеточной мембраны, т.е. высокоструктурированную органеллу.
Источник
![]()
1
2 ответа:
![]()
2
0
Вода – самое распространенное сложное вещество на планете Земля и самое удивительное, так как не подчиняется законам природы, т.е. аномальна. Если бы вода не обладала этими свойствами, то не было бы жизни на планете Земля. Эти свойства воды заключаются в строении молекулы воды. В ней образуются две сильно полярные связи -ОН, направленное в пространстве под углом 105 градусов, сама молекула тетраэдрическая, тк. атом кислорода находится spз-гибридизации, где в вершины тетраэдра направлены две сигма-связи -ОН и две орбитали с неподеленными парами электронов атома кислорода. Все связи в пространстве отталкиваются на угол 105 градусов, поэтому молекула воды полярная и представляет собой диполь. В жидкой воде , как и в твердой(лед) между молекулами образуются слабые водородные связи, образуя агрегаты состава (Н2О)n, где n= 2-9 число молекул воды в агрегате. Поэтому-то вода при обычных условиях жидкость, а не газ, как все водородные соединения неметаллов (СН4,SiH4, NHз, PHз, H2S,HF,HCl и т.д.) – газы, хотя молярная масса воды ниже многих этих газообразных соединений. И все остальные свойства воды тоже аномальны. Например: лед легче жидкой воды ( практически у всех веществ плотность твердых веществ больше плотности вещества в жидком состоянии), т.к. структура льда – это не плотная упаковка молекул, а благодаря, образующимся полостям, в результате образования межмолекулярных водородных связям, в этих полостях содержится воздух, что делает лед легче воды. Это имеет большое биологическое значение опять, т.к. водоемы не промерзают зимой до дна, что способствует сохранению флоры и фауны подо льдом зимой в морях, реках, озерах, прудах.
![]()
1
0
Структурированность воды – это и есть одно из свойств воды. К основным свойствам воды так же относятся РН уровень (должен быть не менее 7.5) и положительный или отрицательный заряд. Положительный заряд – это мертвая вода, а отрицательный заряд – это вода живая.
Читайте также
![]()
Как научиться? только практикой, решаешь оду задачу, затем ещё одну подобную, и так до тех пор, пока не научишься решать моментально, едва взглянув на задачу. Потом переходишь к другому типу задач, и так далее, пока не научишься решать все типы задач. Для этого конечно нужно хорошо усвоить, что такое моль, и химические свойства различных классов соединений.
Вот, конкретно, с этой задачей.
Металлический алюминий реагирует с соляной кислотой следующим образом:
2 Al + 6 HCl —–> 2 AlCl3 + 3 H2.
Из уравнения реакции видно, что количество молей образовавшегося водорода больше количества молей израсходованного алюминия в 3/2=1,5 раза.
По условию задачи (масса алюминия задана, а ни масса ни концентрация соляной кислоты не заданы) ясно, что соляная кислота имеется в избытке, поэтому расчёт нужно вести по алюминию.
Теперь посчитаем, сколько молей алюминия. Алюминия взято 540 мг. Из них 4 %, т.е. 540*0,04=21,6 мг – примеси. Значит самого алюминия 540-21,6=518,4 мг (или 540*(1-0,04)=540*0,96=518,4 мг) или 0,5184 г. Атомная масса алюминия 27 г. Значит взято 0,5184/27=0,0192 моль алюминия. Водорода образовалось в 1,5 раза больше, т,е, 0,0192*1,5=0,0288 моль.
Из газовых законов мы знаем, что 1 моль ЛЮБОГО ИДЕАЛЬНОГО ГАЗА в нормальных условиях занимает объем 22,4 л. А в школьных химических задачах почти всегда, если не оговорено особо, газы рассматриваются (пересчитываются) в идеальных условиях.
Значит объем водорода будет 22,4*0,0288=0,64512 л или 645,12 мл.
Из 1 моля алюминия образуется 1 моль хлорида алюминия AlCl3. Молярная масса хлорида алюминия составляет 27+3*35,5=133,5 г, а из 0,0192 молей алюминия 133,5*0,0192=2,5632 г хлорида алюминия.
![]()
В 1795 году немецкий химик Мартин Клапрот обнаружил, что кристаллы минерала рутила являются оксидом неизвестного ранее химического элемента. Новый элемент он назвал в честь персонажей древнегреческой мифологии – титанов. Среди титанов нам более знакомы Атлант, держащий на своих плечах небо; Фемида – богиня правосудия; Прометей – защитник людей от произвола богов, подаривший людям огонь.
Название для металла первооткрыватель выбрал не случайно. В Германии Клапрот был убеждённым противником главенствующей тогда ошибочной теории флогистона. Титаны, как известно, были соперниками богов-олимпийцев во главе с Зевсом, они олицетворяли, противостояние сложившимся устоям. Мартин Клапрот подобрал для элемента имя из мифологии (как и для урана, открытым им ранее) в противоположность традиционной химической школе, где новым элементам давали называние по его химическим свойствам.
Впервые ванадий был открыт в 1801 году мексиканским профессором минералогии Андресом Мануэлем Дель Рио. Если бы его открытие признали, то нынешний ванадий носил название “панхромий” или же “эритроний”. Но в 1830 году ванадий был открыт заново шведским химиком Нильсом Сефстрёмом.
Сефстрём и его коллега и соотечественник Йёнс Якоб Берцелиус дали новому элементу название в честь древнескандинавской богини любви и красоты Ванадис. По-видимому, химики увязали красоту окраски соединений ванадия с красотой легендарной богини, равной которой не было во всем мире, ни среди богов, ни среди людей.
![]()
В обычных условиях никакого взаимодействия между плавиковой кислотой и кислородом не будет.
![]()
sodium benzoate – бензоат натрия – натриевая соль бензойной кислоты С6Н5-С(=О)-О-Na. Бензоат натрия вводят в состав многих лекарств, а с какой целью я не знаю.
![]()
При соблюдении правил безопасности (которые обычно пишутся на этикетке) бытовая химия практически не наносит вред здоровью. Не больше, чем любая домашняя работа. Правда нужно еще иногда учитывать химические взаимодействия и не смешивать несовместимые средства (типа Белизны с чистящими средствами на основе щавелевой кислоты). Кроме того полезно знать собственную чувствительность к препаратам бытовой химии. Людям, склонным к аллергическим реакциям на средства бытовой химии, рекомендуется использовать усиленные средства защиты (перчатки, маски, респиратор).
Источник
![]()
3
1 ответ:
![]()
0
0
Свойства воды определяются структурой ее молекулы. Молекула воды биполярна, имеет форму диполя (полярная молекула). Благодаря этому между молекулами воды возникают водородные связи.
Из этого вытекают следующие свойства:
– вода – хороший растворитель; т.е. происходит гидролиз, в растворе молекулы и ионы вещества начинают быстрее двигаться
– вода обладает большой теплоемкостью и теплопроводностью
– большая теплота испарения (сопровожд. охлаждением организма)
– практически не сжимается (благодаря этому наша кожа упруга)
– большое поверхностное натяжение (н-р, используется насекомыми)
Читайте также
![]()
Ответ:
Воздействие человеческого общества на почвенный покров представляет собой одну из сторон общего влияния человека на окружающую среду.На протяжении истории воздействие человеческого общества на почвенный покров непрерывно возрастало. В отдаленные времена бесчисленными стадами была сведена растительность и вытоптана дернина на обширной территории аридных ландшафтов. Дефляция (разрушение почв под действием ветра) довершила уничтожение почв.
![]()
На нашей планете живые организмы освоили 4 среды обитания: водную, наземно-воздушную, почвенную и организменную. Водная среда была первой. Затем живые организмы освоили наземно-воздушную среду, создали и заселили почву. Под почвенной средой обитания подразумевают не только собственно почву, но и горные породы поверхностной части литосферы. Организменную среду освоили паразиты и симбионты.
1.Водная среда) Относительно однородная (гомогенная) в пространстве и стабильная во времени. У организмов возникли следующие адаптации к водной среде: обтекаемая форма тела, плавучесть, слизистые покровы, развитие воздухоносных полостей, осморегуляции.
2. Почвенная среда) создана живыми организмами. Дефицит или полное отсутствие света. Высокая плотность. Четырехфазная (фазы: твердая, жидкая, газообразная, живые организмы). Неоднородная (гетерогенная) в пространстве. У организмов, живущих в почве форма тела вальковатая, слизистые покровы или гладкая поверхность, у некоторых имеется копательный аппарат, развитая мускулатура. Для многих групп характерны микроскопические или мелкие размеры как приспособление к жизни в пленочной воде или в воздухоносных порах.
3 Наземно-воздушная) разреженная. Обилие света и кислорода. Гетерогенная в пространстве. Очень динамичная во времени. В результате эволюции у наземных организмов выработался опорный скелет, механизмы регуляции гидротермического режима. Освобождение полового процесса от жидкой среды.
4 Организменная)Очень древняя. Жидкая (кровь, лимфа) или твердая, плотная (ткани). Наибольшее постоянство среды во времени из всех сред обитания. Коадаптация паразита и хозяина, симбионтов друг к другу, выработка у паразита защиты от переваривания хозяином и системы заякоривания в среде, усиление полового размножения, редукция зрения, пищеварительной системы, синхронизация биоритмов.
![]()
Ароморфоз-улучшение усложнение организма,появление может сердца у рыб и т д а у бурового точто он может приспособится к таким условиям среды
![]()
В) сегментация тела и конечностей
![]()
Я не очень уверена в том, как лучше написать, но другое просто в голову не приходит. Один из частых типов безусловных рефлексов головного мозга является одергивание руки от какого-либо горячего предмета, мозг чувствует опасность и отдает команду, мышца срабатывает и рука одергивается.(можешь посмотреть по рисунку в учебнике). Чувство голода также является одним из безусловных рефлексов: ощущение голода является частыми сокращениями пустого желудка, которое воспринимается его механорецепторными стенками, также оно обусловлено снижением аминокислот в крови организма. Все это сказывается на снижение деятельности глюкорецепторов гипоталамуса и гипо-физиоральной системы организма. За снижение голода в организме отвечает гармон холецистокинин. Различают всего два типа насыщения: сенсорное(первичное) и обменное(второчиное). Первичное характеризуется возбуждением обонятельных, вкусовых рецепторов, что происходят во время еды, также кровь начинает вырабатывать глюкозу, которую получают с питанием. Вторичное насыщение происходит, когда в кровь и лимфу уже поступила еда-время ее всасывания. Допустим, если походу инерции поступление питания в организм теряет свою скорость, то головной мозг дает сигнал на ускорение процессов переваривания пищи и более быстрое его всасывание, но при этом, тело не сохраняет такой быстрый темп всегда, как только еда начала всасываться, то уже этот процесс будет идти постепенно.
Источник
Характерные особенности
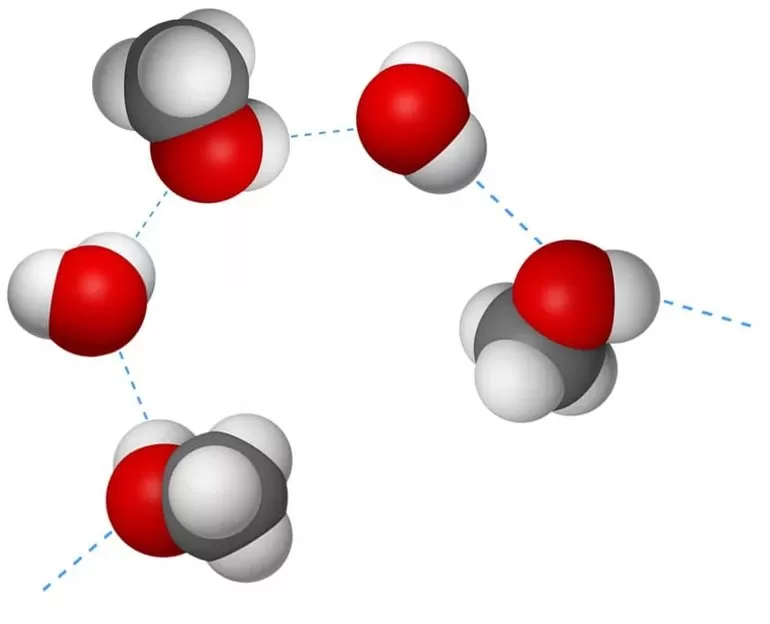
Этот тип связи возникает в молекулах, когда их атом водорода, поляризованный положительно, взаимодействует с атомом другой молекулы, имеющим заряд отрицательный. Расстояние между атомами-участниками процесса должно оказаться меньше, чем сумма их радиусов. Выделяют два вида H-связей:
- Межмолекулярная. Возникает между различными молекулами веществ: для этого необходимо присутствие водорода и одного из элементов с хорошей способностью притягивать электроны других атомов. Высокая электроотрицательность фтора (F), кислорода (O), азота (N), хлора (Cl) и серы (S) служит этому надёжной поддержкой. Общие пары взаимодействующих электронов смещаются к атомам отрицательно заряженных элементов, а положительные электрические заряды водорода концентрируются в малых объёмах. Протоны взаимодействуют с электронными парами соседних атомов, что приводит к их обобществлению.
- Внутримолекулярная. Образуется в пределах одной молекулы, для чего в ней наряду с положительно заряженными атомами водорода должны присутствовать отрицательно поляризованные группы. Явление обнаруживается в природе у многоатомных спиртов, белков, углеводов и ряда других органических соединений.
Энергия H-связи обладает низкими прочностными характеристиками: она в несколько раз ниже, чем у остальных подобных взаимодействий. Это позволяет ей существовать промежуточным звеном между основными химическими связями (ковалентной, ионной и металлической) и силами притяжения и отталкивания Ван-дер-Ваальса, стремящимися удержать частицы в твёрдом или жидком состоянии. Кристаллические решётки с молекулами в узлах — характерная особенность веществ с водородной связью. Примеры можно привести различные:

- вода H2O в виде льда;
- кристаллы йода I;
- хлор Cl;
- бром Br;
- диоксид углерода CO2 в форме «сухого льда»;
- твёрдый аммиак NH3;
- конденсированная органика (метан CH4, бензол C6H6, фенол C6H5OH, нафталин C10H8, различные белки).
Механизм образования водородной связи считается смешанным — одновременно электростатическим и донорно-акцепторным. Решающая роль в этом принадлежит повышению электроотрицательности одного атома (A), позволяющей оттягивать в свою сторону электронную пару другого атома (H), принимающего участие в этом взаимодействии. В результате:
- первый атом приобретает частично отрицательный заряд (d-);
- второй участник заряжается положительно (d+);
- происходит поляризация химической связи (Аd-) — (Hd+).
Образовавшиеся атомы водорода, заряд которых частично положителен, обладают способностями притягивать другие молекулы, содержащие электроотрицательные группы. Эти электростатические взаимодействия и обуславливают появление Н-связей, для формирования которых необходимы три обязательных элемента:
- атом-донор протона;
- атом-акцептор протона;
- атом водорода Н.

Такое донорство в обычных условиях никогда не осуществляется на все 100%. Атом-донор остается химически связанным с водородом. Графически это обозначается в виде линии из точек, указывающей, что сила взаимодействия слабее ковалентной связи. Схема записи структуры выглядит следующим образом: Б ··· Нd+ – Аd-.
Только три химических элемента полностью проявляют донорские способности, и их атомы поставляют протоны для образования Н-связей: азот (N), кислород (O) и фтор (F). В атомах-акцепторах недостатка не наблюдается. Низкомолекулярным соединениям H-связь придаёт способность в обычных условиях иметь жидкое агрегатное состояние, как это происходит у этанола (C2H5OH), метанола (CH3OH) и воды (H2O), или становиться сжижающимися при охлаждении газами — аммиаком (NH3) и гидрофторидом (HF).
Проявление в неорганической химии
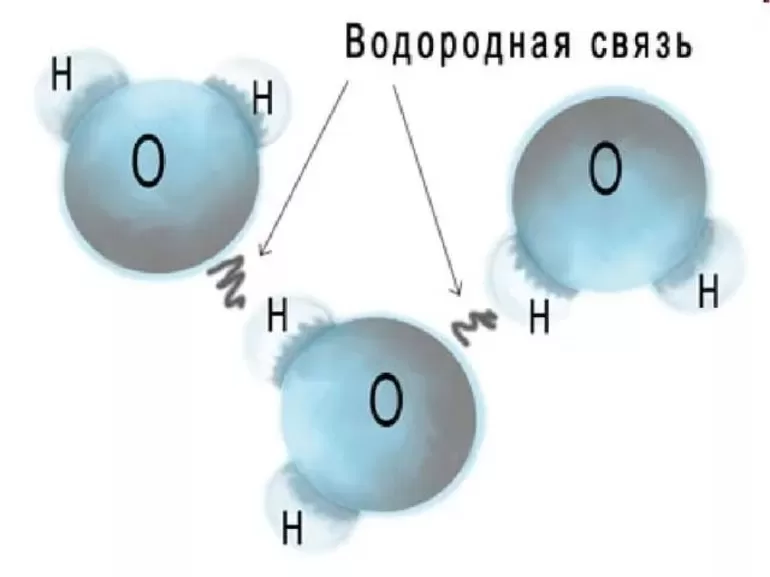
Определение «водородная связь» появилось в 1920 году. Его применили учёные Латимер и Родебуш для объяснения сущности аномалий, наблюдавшихся при кипении воды, предельных одноатомных спиртов и жидкого фтороводорода. При сопоставлении точек кипения в ряду водородсодержащих родственных соединений Н2O (вода), Н2S (сероводород), Н2Se (селеноводород) и Н2Te (теллуроводород) обнаружилось, что первый участник этого списка (H2O) переходит из жидкости в пар гораздо раньше, чем можно было бы ожидать, следуя закономерности, которой подчиняются остальные члены. Истинное значение точки кипения воды оказалось на 200° C выше ожидаемого.
Это справедливо и для другого ряда — NH3 (аммиак), PH3 (фосфин), H3As (арсин), Н3Sb (стибин), где фактическая (-33 °C) температура кипения аммиака на 80 градусов превышает ожидаемую. Если считать, что молекулы в жидкости удерживаются исключительно Ван-дер-Ваальсовыми силами, разрушающимися при переходе в газообразную фазу, то эти скачки не должны наблюдаться, а объяснить их невозможно.
Неожиданные повышения температур кипения привели к выводам о присутствии дополнительно связывающих молекулы сил, изменяющих физические свойства. Водородной связи принадлежит роль в создании аномальных температур кипения спиртов, если их сравнивать с аналогами без гидроксильных групп (-ОН). В перечне заслуг H-связей не только изменение точек кипения веществ, но и упрочнение их кристаллических решёток, вызывающее повышение температур плавления, поверхностного натяжения и вязкости.
Например, борная кислота с формулой H3BO3 имеет слоистую триклинную кристаллическую решётку, где каждая из молекул посредством H-связей крепится к трём другим. В результате образуются плоские слои, которые за счёт межмолекулярных связей создают кристаллическую структуру — «паркет» из шестиугольников.
При помощи инфракрасной спектроскопии сегодня можно достоверно выявить любой тип межмолекулярного взаимодействия: группы с Н-связями заметно отличаются по спектральным характеристикам от остальных случаев. Исследования структуры вещества помогают измерить дистанцию между водородом и атомом-акцептором, сравнить её с суммой радиусов и, если первое значение не превышает второе, доказать существование явления.
Понятие водных кластеров

Земля — чемпион по содержанию воды среди других планет Солнечной системы. Моря и океаны, реки и озёра, средние глубины которых достигают 6 тыс. метров, занимают 70% земной поверхности, а в областях полюсов сосредоточились огромные запасы влаги в виде снегов и льдов.
Трудно переоценить влияние воды на возникновение и существование жизни на нашей планете. Это связано с особенностями, нехарактерными для соединений, считающихся её близкими аналогами. Только вода находится в жидком и твёрдом состоянии при условиях, в которых водородные соединения серы или селена с большей атомной массой становятся газообразными.
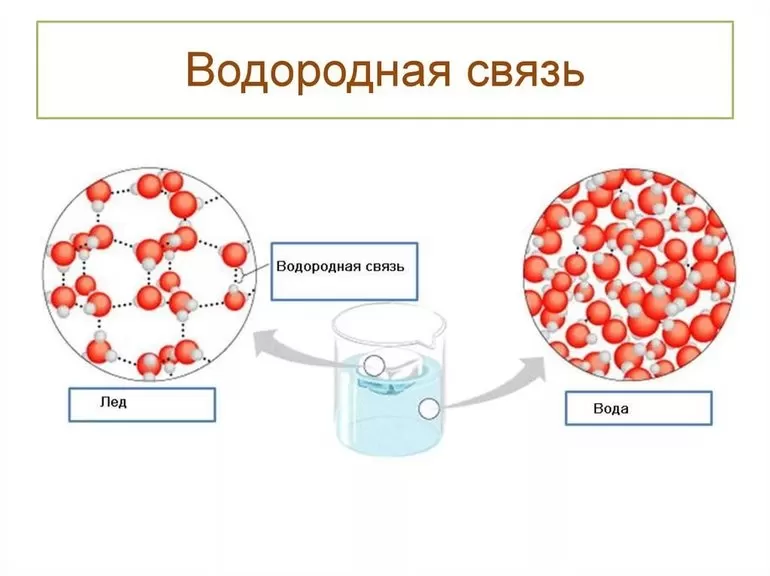
Присутствие H-связей в молекулах воды обуславливает образование водных кластеров или комплексов, а димеры воды служат их простейшими примерами. Энергия их водородных связей ненамного больше энергии броуновского движения при нормальных условиях, но сильно отличается от мощности ковалентных связей в гидроксильных группах, а они в 200 раз превышают тепловые показатели. Вода из простой жидкости превращается в сложную, «связанную» сетью H-связей, хотя они относительно слабы и неустойчивы, самопроизвольно возникают и исчезают при температурных изменениях.
Кристаллическая структура льда имеет объёмную сетку из этих связей, и молекулы H2O расположены так, чтобы атомы водорода одних молекул оказывались направленными к атомам кислорода соседей. В ледяном кристалле между молекулами обязательно присутствуют пустоты, их объёмы немного превышают размеры отдельных молекул воды. Именно благодаря таким «карманам» плотность льда меньше, чем у его жидкой фазы, а гигантские айсберги остаются дрейфовать на поверхности, в то время как замерзание большинства других веществ существенно увеличивает их плотность.
Водородные связи сообщают воде уникальную характеристику, обеспечивающую существование разнообразных форм жизни в областях, где окружающие температуры опускаются ниже нуля. Если на минуту представить, что лёд начнёт тонуть в воде, то моря зимой рано или поздно промёрзнут до самого дна, и рыбы будут обречены на вымирание. Люди могли бы растапливать лёд для получения живительной влаги, но это потребует больших энергозатрат.

Ещё одно проявление H-связей — голубая окраска чистой воды в её толще. Колебание одной молекулы воды вызывает движение соседних частиц, соединенных с ней водородными связями. Красные лучи из состава солнечного спектра будут расходоваться на поддержание этих колебаний, поскольку больше всего соответствуют им энергетически. Происходит фильтрация красных лучей — их энергия поглощается и рассеивается в виде тепла колеблющимися молекулами.
Начинает проступать голубой участок спектра, уравновешивающий отсутствие красного. Вода самостоятельно окрасится в волшебный небесный цвет. Для этого необходимо, чтобы солнечные лучи прошли через двухметровую толщу чистой воды и потеряли достаточное количество красного спектра.
Значение для органических соединений
Многие органические вещества не могут растворяться в воде. Но если это происходит, то процесс не обходится без активного участия H-связей. Кислород и азот, главные доноры протонов, часто играют роли акцепторов. Органические соединения, содержащие O и N, легко растворяются в воде: здесь кислород и азот выступают в качестве атомов-акцепторов, а атомом-донором является кислород из молекул воды. Возникающие H-связи перемещают органическое вещество в раствор, «растаскивая» его на молекулы.

Просматривается эмпирическая закономерность: органическое соединение будет легко растворяться в воде, если в составе его молекул на каждый атом кислорода приходится не более 3 атомов углерода. Например, бензол C6H6 в воде растворяется плохо, но замена одной группы (-СН) на (-N) даёт пиридин С5Н5N, смешивающийся с водой в любых пропорциях.
Для неводных растворов, в которых растворителями служат органические вещества, тоже характерны H-связи. В них водород частично положительно поляризован, а поблизости обнаруживается молекула с сильным акцептором — чаще всего это бывает кислород. Жирные кислоты приобретают полезную способность растворяться в хлороформе HCCl3, а растворённый в ацетоне ацетилен получил важное техническое применение. Горючий газ C2H2 под давлением чувствителен к сотрясениям и взрывоопасен, но его растворение в ацетоне C3H6O позволяет безопасно хранить и транспортировать любые объёмы.
Трудно переоценить роль H-связей в прочных полимерных и биополимерных структурах. Целлюлоза (клетчатка древесины) в строении молекулы располагает гидроксильные группы по бокам полимерной структуры, в которой чередуются циклические фрагменты. Невысокая энергия единичной Н-связи, умноженная на количество по всей длине молекулярной цепи, вызывает в итоге мощное притяжение. Из-за этого целлюлозу можно растворить только в высокополярных растворителях — дигидроксотетрааммиакате меди, известном как реактив Швейцера.
Карбонильные (=C=O) и аминогруппы (-NH2) в расположенных рядом полимерных цепочках капрона и нейлона тоже образуют связи этого типа и увеличивают механическую прочность веществ, поскольку в полиамидных структурах создаются кристаллические фрагменты. Аналогично ведут себя полиуретаны и белки: витки белковых спиралей закрепляются всё теми же H-связями, возникающими при взаимодействии функциональных групп.

Полимерная макромолекула ДНК — хранилище запасов информации о живом организме, зашифрованной в чередующихся фрагментарных циклах. Их карбонильные и аминогруппы имеют четыре типа азотистых оснований (аденин A, гуанин G, тимин T, цитозин C) и располагаются в форме боковых ответвлений по длине молекулы. От порядка их чередования зависят индивидуальные особенности всего живого на планете. Взаимодействия пар в составе аминогруппы и атома азота дают начало множеству Н-связей, которые удерживают 2 молекулы ДНК в виде классической двойной спирали.
Источник
