Какая существует зависимость между свойствами химических
Каждый элемент имеет свое строго уникальное строение, в соответствии с которым он и занимает свое постоянное, четко определенное место в периодической системе.
При рассмотрении периодической таблицы элементов, зная химические и физические свойства каждого элемента, можно сделать выводы о закономерностях изменения этих свойств.
Повторение свойств элементов
С увеличением атомной массы происходит периодическое повторение свойств элементов.
Так, одиннадцатый элемент ряда – натрий – имеет общие свойства с третьим химическим элементом – литием. В рамках ряда от лития до фтора металлические свойства соединений постепенно уменьшаются и при этом возрастают неметаллические свойства. И действительно, после активного щелочного металлического элемента лития четвертым размещен тоже металлический элемент бериллий, но уже с амфотерными свойствами соединений. Пятый, шестой, седьмой, восьмой, девятый и десятый элементы – неметаллические. Активность простых веществ и соединений этих элементов с увеличением порядкового номера возрастает и достигает максимума у фтора.
Причиной периодической повторяемости свойств химических элементов и образованных ими соединений является образование у элементов одинакового строения внешнего энергетического уровня (для элементов главных подгрупп) и предпоследнего энергетического уровня (для элементов побочных подгрупп).
Закономерности изменений свойств
Таким образом, рассмотрев свойства каждого из соединений и их изменения в группах и периодах можно составить определенные закономерности.
В рамках одного периода с увеличением порядковых номеров элементов (при движении вниз по периоду) прослеживаются закономерные изменения, характерные для всей таблицы.
При движении вниз по периоду металлические и основные свойства у простых веществ ослабляются, а неметаллические и кислотные – усиливаются.
Кроме размещения в горизонтальных рядах — периодах, элементы входят в состав вертикальных столбиков — групп. Рассмотренные свойства природных семей щелочных элементов, галогенов и инертных элементов дают возможность сделать вывод, что наиболее активные металлы размещены в группе под номером 1, то есть в начале периодов, а самые активные неметаллы — в группе под номером 7, то есть в конце периодов.
Инертным элементом 18 группы заканчивается каждый период.
Если провести воображаемую линию через элементы алюминий, германий, олово, стибий, свинец, полоний, которая разделит периодическую систему на две не равных части, то верхняя правая часть будет содержать неметаллы, нижняя левая — металлы, а элементы, образующие линию разделения, — это металлы с амфотерными свойствами оксидов и гидроксидов.
Зависимость от строения электронных оболочек атомов
На основе современной теории строения атома ученые объясняют, что характер химических свойств и его изменение в периодах находятся в зависимости от изменения строения электронных оболочек атомов. Чтобы понять, какие различия в строении электронных оболочек вызывают ослабление металлических и усиление неметаллических свойств, сравним электронные формулы атомов пары элементов — алюминия и фосфора.
Как видим, количество энергетических уровней у атомов алюминия и фосфора одинаково — их 3. Однако у каждого из них разное число электронов на внешнем (крайнем) энергетическом уровне, которое с увеличением порядкового номера элемента (13 у алюминия и 15 у фосфора) растет. Делаем вывод, что причиной ослабления металлических и усиления неметаллических свойств элементов одного периода является рост числа электронов на внешнем энергетическом уровне.
Итак, в зависимости от собственно строения атома элемента и, соответственно, в какой части периодической системы размещен этот элемент, его соединения проявляют или основные, или кислотные, или амфотерные химические свойства.
Рассмотренные зависимости еще раз подтверждают универсальный характер периодического закона и доказывают, что он является фундаментальным законом природы.
Источник
Причины образования химической связи
Известно, что электронные оболочки, содержащие восемь внешних электронов, два из которых находятся на s-орбитали, а шесть — на р-орбиталях, обладают повышенной устойчивостью. Они соответствуют инертным газам: неону, аргону, криптону, ксенону, радону (найдите их в периодической таблице). Еще более устойчив атом гелия, содержащий всего два электрона. Атомы всех других элементов стремятся приблизить свою электронную конфигурацию к электронной конфигурации ближайшего инертного газа. Это возможно сделать двумя путями — отдавая или присоединяя электроны внешнего уровня.
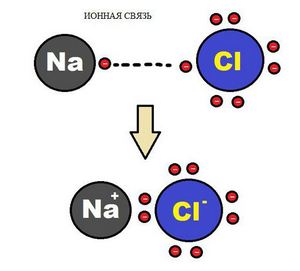
Атому натрия, имеющему всего один неспаренный электрон, выгоднее его отдать, тем самым атом получает заряд (становится ионом) и приобретает электронную конфигурацию инертного газа неона.
Атому хлора до конфигурации ближайшего инертного газа недостает всего одного электрона, поэтому он стремится приобрести электрон.
Каждый элемент в большей или меньшей степени обладает способностью притягивать электроны, которая численно характеризуется значением электроотрицательности. Соответственно, чем больше электроотрицательность элемента, тем сильнее он притягивает электроны и тем сильнее выражены его окислительные свойства.
Стремление атомов приобрести устойчивую электронную оболочку объясняет причину образования молекул.
Определение
Химическая связь — это взаимодействие атомов, обусловливающее устойчивость химической молекулы или кристалла как целого.
ТИПЫ химической связи
Различают 4 основных типа химической связи:

Рассмотрим взаимодействие двух атомов с одинаковыми значениями электроотрицательности, например двух атомов хлора. Каждый из них имеет по семь валентных электронов. До электронной конфигурации ближайшего инертного газа им не хватает по одному электрону.
Сближение двух атомов до определенного расстояния приводит к образованию общей электронной пары, одновременно принадлежащей обоим атомам. Эта общая пара и представляет собой химическую связь. Аналогично происходит и в случае молекулы водорода. У водорода всего один неспаренный электрон, и до конфигурации ближайшего инертного газа (гелия) ему не хватает еще одного электрона. Таким образом, два атома водорода при сближении образуют одну общую электронную пару.
Определение
Связь между атомами неметаллов, возникающая при взаимодействии электронов с образованием общих электронных пар, называется ковалентной.
В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной.
Определение
Ковалентная неполярная связь — химическая связь между атомами неметаллов с равными или близкими значениями электроотрицательности. При этом общая электронная пара одинаково принадлежит обоим атомам, смещения электронной плотности не наблюдается.
Ковалентная неполярная связь имеет место в простых веществах-неметаллах: О. При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора. Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример ковалентной полярной связи.
Определение
Связь, образованная элементами-неметаллами с разной электроотрицательностью, называется ковалентной полярной. При этом происходит смещение электронной плотности в сторону более электроотрицательного элемента.
Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов . Особенно много ковалентных полярных соединений среди органических веществ.
В случае если разница электроотрицательностей элементов будет велика, произойдет не просто смещение электронной плотности, а полная передача электрона от одного атома к другому. Рассмотрим это на примере фторида натрия NaF. Как мы видели ранее, атом натрия стремится отдать один электрон, а атом фтора готов его принять. Это легко осуществляется при их взаимодействии, которое сопровождается переходом электрона.
При этом атом натрия полностью передает свой электрон атому фтору: натрий лишается электрона и становится заряженным положительно, а хлор приобретает электрон и становится заряженным отрицательно.
Определение
Атомы и группы атомов, несущие на себе заряд, называют ионами.
В образовавшейся молекуле — хлориде натрия — связь осуществляется за счет электростатического притяжения разноименно заряженных ионов. Такую связь называют ионной. Она реализуется между типичными металлами и неметаллами, то есть между атомами с сильно различающимися значениями электроотрицательности.
Определение
Ионная связь образована за счет сил электростатистического притяжения между разноименно заряженными ионами — катионами и анионами.
Существует еще один тип связи — металлическая, характерная для простых веществ — металлов. Она характеризуется притяжением частично ионизованных атомов металлов и валентных электронов, образующих единое электронное облако («электронный газ»). Валентные электроны в металлах являются делокализованными и принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. Таким образом, связь является многоцентровой. В переходных металлах металлическая связь носит частично ковалентный характер, так как дополнена перекрыванием частично заполненных электронами d-орбиталей предвнешнего слоя. Металлы образуют металлические кристаллические решетки. О ней подробно рассказывается в теме «Металлическая связь и ее характеристики».
межмолекулярные взаимодействия
Примером сильного межмолекулярного взаимодействия
является водородная связь, образующаяся между атомом водорода одной молекулы и атомом с высокой электроотрицательностью (, , ). Примером водородной связи является взаимодействие молекул воды , молекул аммиака и воды , метанола и воды , а также различных частей молекул белков, полисахаридов, нуклеиновых кислот.

Другим примером межмолекулярного взаимодействия являются ван-дер-ваальсовы силы, которые возникают при поляризации молекул и образовании диполей. Они обусловливают связь между слоями атомов в слоистых кристаллах (таких как структура графита).

Характеристики химической связи
Химическая связь характеризуется длиной, энергией, направленностью и насыщаемостью (каждый атом способен образовать ограниченное число связей). Кратность связи равна числу общих электронных пар. Форма молекул определяется типом электронных облаков, участвующих в образовании связи, а также фактом наличия или отсутствия неподеленных электронных пар. Так, например, молекула является линейной (нет неподеленных электронных пар), а и – уголковыми (есть неподеленные пары). В случае если взаимодействующие атомы имеют сильно различающиеся значения электроотрицательностей, общая электронная пара практически полностью смещается в сторону атомов с наибольшей электроотрицательностью. Ионную связь, таким образом, можно рассматривать как предельный случай полярной ковалентной связи, когда электрон практически полностью перешел от одного атома к другому. В действительности полного смещения не происходит никогда, то есть абсолютно ионных веществ нет. Например, в реальные заряды на атомах составляют +0,92 и –0,92, а не +1 и –1.
Ионная связь реализуется в соединениях типичных металлов с неметаллами и кислотными остатками, а именно в оксидах металлов (, ), щелочах (, ) и солях (, , , , , ).
механизмы образования химической связи
Обменный.
Обменный механизм образования химической связи обусловлен обобществлением неспаренных электронов атомов. Подробно он был рассмотрен выше на примере образования молекулы хлора.Донорно-акцепторный.

Донор — элемент, предоставляющий пару электронов (например, азот или бор).
Акцептор — элемент, предоставляющий свободную орбиталь для пары электронов другого атома.
Источник
Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Что такое химическая связь
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы химических связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
- Ковалентная химическая связь (которая в свою очередь может быть полярной и неполярной)
- Ионная связь
- Водородная связь
- Химическая связь металлов
подобных людям.
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.

Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Водородная химическая связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
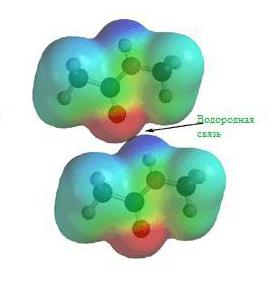
На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Химическая связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.
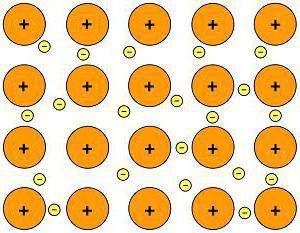
Так выглядит металлическая химическая связь.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
Как определить вид химической связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства химических связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
- длина,
- энергия,
- полярность,
- порядок связей.
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Химическая связь, видео
И в завершение познавательное видео об разных видах химической связи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Bonding: Definition, Types, Properties.
Источник
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.

Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная.
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2), то один из электронов практически полностью переходит к другому атому, с образованием ионов. Такая связь называется ионная.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь

Ковалентная связь – это химическая связь, образованная за счет образования общей электронной пары А:В. При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность,
- насыщаемость,
- полярность,
- поляризуемость.
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 108о28′.

Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.

Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ.
Пример. Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H. + .H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной.

Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры: H2 (H-H), O2 (O=O), S8.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент. Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO2, NH3.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А. + .В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH2+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь | Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь | Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь

Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.

Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na+, с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na )2)8)1 — 1e = +11Na+ )2)8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl )2 )8 )7 + 1e = +17Cl— )2 )8 )8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4+, сульфат-ион SO42- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na+Cl—, Na2+ SO42-.
Наглядно обобщим различие между ковалентными и ионным типами связи:

Металлическая химическая связь

Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одн?
