Какие белки обладают инфекционными свойствами
Шапероны – класс белков, защищающих другие белки от денатурации в условиях клетки и облегчающих формирование их нативной коиформации
В каждой клетке присутствуют белки – шапероны, обладающие высоким сродством к экспонированным гидрофобным участкам полипептидной цепи и способные связываться с белками, находящимися в неустойчивом, склонном к агрегации состоянии. В зависимости от массы, шапероны делят на 6 классов, например Ш-70 имеют массу от 66 до 90 кДа.
Шапероны подразделяются на конститутивные, синтез которых в клетке постоянен и не зависит от внешних факторов, и индуцибельные (белки теплового шока – их впервые выделили из клеток, подвергшихся воздействию высокой температуры), синтез которых в интактной клетке идет слабо, но при стрессовых воздействиях резко возрастает.
Пептидная цепь, растущая в процессе трансляции, формирует конформацию в результате многоступенчатого процесса, развернутого во времени. Для образования нативной конформации белка нужна его полная аминокислотная последовательность. Поэтому в процессе синтеза белка на рибосоме защиту пептида, еще не имеющего возможность сформировать правильную конформа-нию, выполняют специальные белки – шапероны Ш-70. Они сопровождают белки после трансляции в различные отсеки клетки и к месту образования макромолекулярных комплексов, что защищает белки от спонтанной агрегации.За направление синтезированных пептидов в различные клеточные компартменты (ядро, митохондрии, на поверхность клеточной мембраны, что характерно для многих рецепторных белков и т.д.) отвечает лидерная последовательность синтезированного пептида, которая также распознается шаперонами. После доставки пептида в нужный компартмент клетки лидерная последовательность отщепляется.
Фолдинг высокомолекулярных белков, имеющих сложную пространственную структуру, происходит при участии шаперонов другого класса- Ш-60, функционирующих в составе олигомерного комплекса. Шапероновый комплекс включает 14 субъединиц, каждая из которых состоит из трех доменов (один из них обладает АТФ-азной активностью). Белок, на поверхности которого экспонированы гидрофобные радикалы, попадает в полость шаперонового комплекса, где формируется энергетически наиболее выгодная (с минимальной свободной энергией) нативная конформация белка. Высвобождение готового белка требует расхода энергии, получаемого в результате гидролиза АТФ.
При действии различных стрессовых факторов (высокая температура, изменении рН, действие токсических веществ, гипоксия и т.д.), вызывающих денатурацию белков, в клетке усиливается синтез шаперонов – белков теплового шока, Самопроизвольный процесс восстановления конформации и функции частично денатурированных белков (ренативация) затруднен из-за их склонности к агрегации. Шапероны, обладая высоким сродством к гидрофобным участкам поврежденных белков, предотвращают их полную денатурацию и восстанавливают нативную конформацию белковой молекулы.
Роль шаперонов состоит в контроле за конформационным состоянием внутриклеточных белков. При невозможности исправить массивные повреждения белков клетки, вызванные неблагоприятными факторами среды, шапероны запускают процесс апоптоза (программированной клеточной гибели).
Апоптоз. Программированная клеточная гибель (апоптоз) представляет собой процесс поглощения одной клетки другими клетками, который происходит без разрыва плазматической мембраны (как при некрозе) и не сопровождается воспалением. Апоптоз сложный активный многокомпонентный процесс, включающий в себя:
1. получение сигнала через поверхностные рецепторы плазматической мембраны или от внутриклеточных структур;
2. преобразование сигнала программированной клеточной гибели в активацию цитозольных протеаз со специфичностью Цистеин-Аспартат (Суs-Asp), получивших название каспаз;
3. активацию внутриклеточных нуклеаз и протеаз под влиянием каспаз, ведущих нуклеосомальную фрагментацию ядерной ДНК и белков клетки;
4. экспрессию рецепторов фагоцитоза на герметизированной плазматической мембране;
5. фрагментацию клетки на мембранные везикулы, внутри которых продолжаются гидролитические процессы распада белков и ДНК;
6. поглощение везикул соседними клетками (макрофагами и другими клетками с фагоцитарной активностью).
Благодаря апоптозу поддерживается тканевой гомеостаз, а его нарушения лежат в основе многих заболеваний. Нарушения апоптоза либо приводят к заболеваниям, либо являются главным патологическим фактором, вызывающим утяжеление заболеваний и развитие осложнений. Апоптоз играет важную роль во многих физиологических процессах и, особенно, в иммунной системе. Недостаточность апоптоза обнаружена при опухолевых и аутоиммунных процессах, а его явная избыточность в лимфоцитах человека сопровождает СПИД.
Апоптоз активируют различные виды излучения (гамма- и ультрафиолетовое), препараты химеотерапии и другие неблагоприятные воздействия. На ранних этапах программированной клеточной гибели происходит инверсия плазматической мембраны, связанная с пероксидным окислением фосфатидилсерина и выходом окисленных продуктов на её наружную поверхность. Затем цитоплазма клетки дробится на большое число везикул, клеточное ядро распадается на фрагменты, хроматин конденсируется, а ДНК подвергается интенсивной деградации. В заключительной стадии апоптоза гибнущая по этому механизму клетка подвергается фагоцитозу.
Первый путь внутриклеточной инициации апоптоза имеет митохондриаль-ное происхождение и включается при нарушении процесса нормального двух-электронного переноса на кислород – инициируется цитохромом С, который поступает из митохондрий в цитозоль. Второй путь инициируется конститутивными и индуцибельными шаперонами (белками теплового шока) и связан с утратой клеточного контроля над конформационным состоянием цитоплазматических белков.
Прионы. Класс белков, обладающих инфекционными свойствами, называется прионами. (от англ. proteinaceous infectious particle- белковая инфекционная частица).
Прионы- новейший класс инфекционных агентов (расшифровка их природы относится к началу 80-х годов) – мельчайшие белковые структуры, лишенные нуклеиновых кислот, способные при определенных условиях трансформироваться и, в свою очередь, трансформировать сходные белки. Прионы могут приобретать высокую устойчивость к действию ферментов, физических и химических факторов и проявляют свои инфекционные свойства, повреждая нервную ткань с образованием так называемых губчатых структур (амилоида) без классической воспалительной реакции. Они являются причиной особых “медленных инфекций” (очень длительный инкубационный период – месяцы, годы; прогрессирующее течение; необычность поражения тканей и неизбежный смертельный исход). У людей описано четыре прионовых заболевания. Наиболее известны:
– болезнь куру – прионовая болезнь аборигенов Новой Гвинеи , ее эпидемический характер обусловлен традицией каннибализма (в настоящее время практически исчезла).
– болезнь Кройтцфельдта-Якоба. Считалось, что прионы, от которых заболевают представители одного вида, могут оказаться для представителей другого вида совершенно безобидными (прионы овец и коров различаются по семи аминокислотным остаткам, между прионами коровы и человека значительно больше различий – в тридцати аминокислотах), однако встречаются примеры прорыва через этот “межвидовой барьер”, например болезнь Кройтцфельдта-Якоба, которой заражались люди, употреблявшие в пищу мясо коров – носителей при-онов, вызывающих “коровье бешенство”.
– болезнь Герстманна-Штройсслера-Шейнкера (Gerstmann-Stranssler-Scheinker),
– фатальная семейная инсомния (нарушение сна, бессонница).
Прионовые заболевания – группа быстро прогрессирущих заболеваний, характеризующихся спектром клинических симптомов, включающих нарушения когнитивных функций, атаксию, миоклонии, нарушение зрения, пирамидную и экстрапирамидную симптоматику. Им в свое время давали название медленных инфекций нервной системы, однако инфекционный фактор обнаружен не был. Прионовые заболевания характеризуются вакуолярной дегенерацией нейронов и формированием вариабельных амилоидных бляшек головного мозга.
В основе заболеваний, вызываемых ими, лежат нарушения фолдинга прионового белка. Все млекопитающие, включая и человека, продуцируют прионовый белок (prion protein – PrP). У больных людей и млекопитающих животных обнаруживается этот же белок в иной патологической конформации (misfolded state -PrPsc – иногда его называют так, что означает – прионовый белок в скрепи форме, sc = scrapie). Скрепи – прионовое заболевание овец – было выявлено одним из первых в 80 годах 20 в.
Нативная форма прионового белка (РгР) отличается от его патологической формы (PrPsc) своей пространственной структурой – конформацией).
Нормальный нативный прионовый белок человека (РгР) имеет много а-спиральных участков, а патологический характеризуется высоким содержание Р-слоев. Особенность нативного прионового белка заключена в его кон-формации, которая характеризуется наличием спиральных участков и значительных (около половины) участков с нерегулярной структурой. Это делает нативный прионовый белок нестабильным. Под влиянием прионовых белков . в инфекционной форме или иных неблагоприятных факторов он переходит в патологическую конформацию (PrPsc), которая характеризуется повышенным содержанием Р-слоев, очень стабильна и является инфекционной. Обратный конформационный переход от PrPsc к РгР невозможен. Контактное взаимодействие инфекционной формы (PrPsc) с нативным прионовым белком (РгР) вызывает обязательный переход нативного белка в инфекционную форму.
Прионовые белки в инфекционной форме склонны к агрегации и формируют внутриклеточную структуру амилоида, не поддающегося расщеплению протеолитическими ферментами, выдерживают длительно нагревание (кипячение) и нарушают функционирование нейронов.
В настоящее время механизм, запускающий начальную (инициальную), но достаточно редкую конформацию (PrPsc), неизвестен. Полагают, что под действием неблагоприятных факторов среды, в том числе банальных инфекций, в организме могут возникать инфекционные прионовые белки.
Иньекция PrPsc генетически измененным мышам, которые не способны продуцировать свой собственный РгР белок заболевания не вызывает.
Date: 2016-05-24; view: 2016; Нарушение авторских прав
Источник
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
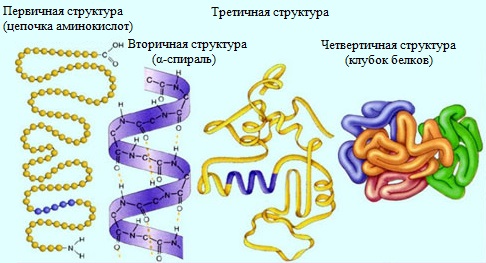
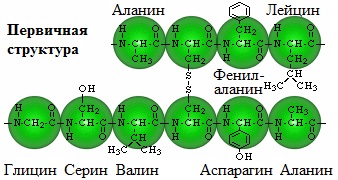
Первичная структура белка – определенная последовательность a-аминокислотных остатков в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
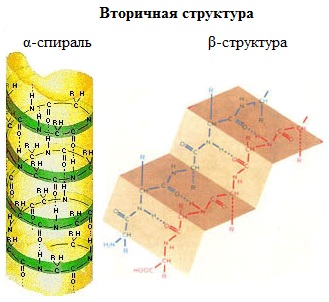
Вторичная структура белка – конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О.
В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль.
Существует два основных способа укладки цепи.
Одна из моделей вторичной структуры – a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи.
В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Большинство белков содержит как α-спирали, так и β-структуры.
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.

Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S- , водородных связей, гидрофобных и ионных взаимодействий.
Третичная структура – это трехмерная пространственная конфигурация закрученной α-спирали или β-структуры в пространстве.
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу».
Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие — от греч. гидро – вода, фобос – страх) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи.
В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп (солевые мостики) NH3+ и COO— .

Интересно знать!
В составе волос содержится белок кератин. В его молекуле имеется большое количество дисульфидных связей. С помощью химической завивки волосам можно придать другую форму. Для этого волосы сначала накручивают на бигуди, затем обрабатывают раствором реагента-восстановителя, разрушающего дисульфидные связи, и прогревают. В результате этого кератин приобретает иную пространственную структуру. Далее волосы промывают и обрабатывают реагентом-окислителем, при этом происходит образование новых дисульфидных связей. Вследствие этого вновь приобретенная структура кератина стабилизируется. Волосы приобретают другую форму.
Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами.
Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом.
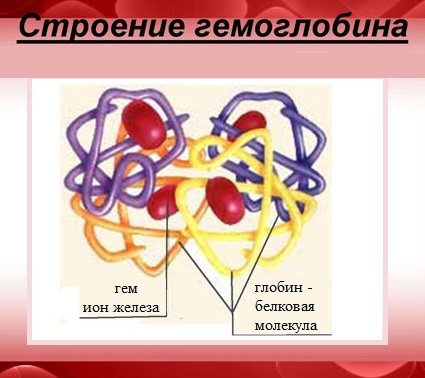
Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема.

Гемоглобин — сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет.
В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода.
Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
Белки
Источник
Белки — природные линейные гетерополимеры, состоящие из мономеров — аминокислот. Главная особенность белков как молекулярных машин — способность специфически связывать другие белки, иные биополимеры и малые молекулы и взаимодействовать с ними. Благодаря этой способности белки выполняют большинство функций клеток и организмов. Одна из важных функций белков — защитная. Обычно к защитным белкам относят прежде всего белки, участвующие в иммунной защите организма. Однако многие другие
Белки способствуют ороговеванию верхних слоев кожи. Таким белком в клетках эпидермиса наземных позвоночных является кератин. Слой мертвых клеток, заполненных кератином, обеспечивает механическую защиту, защищает организм от потерь воды и проникновения болезнетворных бактерий и других паразитов.
Сходную функцию физической защиты выполняют структурные белки, из которых состоят клеточные стенки некоторых протистов (например, зеленой водоросли хламидомонады) и капсидов вирусов.
К физическим защитным функциям белков можно отнести способность крови свертываться, что обеспечивает белок фибриноген, содержащийся в плазме крови. Фибриноген бесцветен; когда кровь начинает свертываться, он расщепляется ферментом. После расщепления образуется мономер — фибрин, который, в свою очередь, полимеризуется и выпадает белыми нитями. Фибрин, выпадая в осадок, делает кровь не жидкой, а студенистой. В процессе свертывания крови основополагающим белком — после того, как он образовал осадок, из нитей фибрина и эритроцитов при сжатии фибрина образует прочный красный тромб.
Химическая защитная функция[править | править код]
Связывание токсинов белковыми молекулами может обеспечивать их детоксикацию. Особенно важную роль в детоксикации у человека играют ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению
В защите клеток от вредных веществ могут принимать участие также транспортные белки, многие белки суперсемейства АВС-транспортеров. Эти белки, имеющиеся у всех живых организмов, транспортируют через клеточную мембрану различные вещества (липиды, многие ксенобиотики и др.). АВС-транспортеры обеспечивают защиту бактерий от действия многих антибиотиков, отвечают за явление множественной лекарственной устойчивости раковых клеток.
Иммунная защитная функция[править | править код]
Иммунная функция белков играет очень важную роль в организме животных. В тот момент, когда в организм попадают возбудители — вирусы или бактерии, в специализированных органах начинают вырабатываться специальные белки — антитела, которые связывают и обезвреживают возбудителей. Особенность иммунной системы заключается в том, что за счет антител она может бороться с почти любыми видами возбудителей.
В иммунной системе играют важную роль не только белки-антитела, но и лизоцимы и белки системы комплемента. Лизоцимы — белки-ферменты, которые разрушают стенки бактерий путём гидролиза их компонентов. Белки комплемента запускают каскад реакций, в результате которых образуется белок МАК (мембраноатакующий комплекс). МАК атакует бактерию, разрушая её клеточную мембрану. Если этого не произошло, другие белки системы комплемента помечают эту клетку для последующего её уничтожения фагоцитами.
К защитным белкам иммунной системы относятся также интерфероны. Эти белки производят клетки, зараженные вирусами. Их воздействие на соседние клетки обеспечивает противовирусную устойчивость, блокируя в клетках-мишенях размножение вирусов или сборку вирусных частиц. Интерфероны обладают и иными механизмами действия, например, влияют на активность лимфоцитов и других клеток иммунной системы.
Активная защитная функция[править | править код]
Белковые яды животных[править | править код]
Белки могут служить также для защиты от хищников или нападения на добычу. Такие белки и пептиды содержатся в ядах большинства животных (например, змей, скорпионов, стрекающих и др.). Содержащиеся в ядах белки имеют различные механизмы действия. Так, яды гадюковых змей часто содержат фермент фосфолипазу, который вызывает разрушение клеточных мембран и, как следствие, гемолиз эритроцитов и геморрагию. В яде аспидов преобладают нейротоксины; например, в яде крайтов содержатся белки α-бунгаротоксин (блокатор никотиновых рецепторов ацетилхолина и β-бунгаротоксин(вызывает постоянное выделение ацетилхолина из нервных окончаний и тем самым истощение его запасов); совместное действие этих ядов вызывает смерть от паралича мышц.
Бактериальные белковые яды[править | править код]
Бактериальные белковые яды — ботулотоксин, токсин тетаноспазмин, вырабатываемый возбудителями столбняка, дифтерийный токсин возбудителя дифтерии, холерный токсин. Многие из них являются смесью нескольких белков с разным механизмом действия. Некоторые бактериальные токсины белковой природы являются очень сильными ядами; компоненты ботулотоксина — наиболее ядовитое из известных природных веществ.
Токсины патогенных бактерий рода Clostridium, видимо, требуются анаэробным бактериям для воздействия на весь организм в целом, чтобы привести его к смерти — это дает бактериям «безнаказанно» питаться и размножаться, а уже сильно увеличив свою популяцию покидать организм в виде спор.
Биологическое значение токсинов многих других бактерий точно не известно.
Белковые яды растений[править | править код]
У растений в качестве ядов обычно используются вещества небелковой природы (алкалоиды, гликозиды и др.). Однако у растений встречаются и белковые токсины. Так, в семенах клещевины (растения семейства молочайные) содержится белковый токсин рицин. Этот токсин проникает в цитоплазму клеток кишечника, и его ферментативная субъединица, воздействуя на рибосомы, необратимо блокирует трансляцию.
Ссылки[править | править код]
- Иммунология
- Белки — функции в клетке
Источник
