Какие буферные системы содержаться в организме человека
Буферные растворы
Цель занятия:
Сформировать у студентов системные знания о буферных растворах, их свойствах, механизме действия, их взаимосвязи и роли в поддержании кислотно – основного гомеостаза организма, наиболее важных показателях кислотно – основного гомеостаза, механизмах его поддержания.
Научить студентов прогнозировать влияние различных факторов на величину рН и буферной ёмкости буферных систем и биологических жидкостей и механизмы действия буферных растворов в зависимости от их типа, количественно рассчитывать величину рН буферных растворов и буферной ёмкости.
Обоснование темы.
Для живых организмов характерно поддержание кислотно-основного гомеостаза на определенном уровне. Это находит выражение в достаточно постоянных значениях рН биологических сред и способности восстанавливать нормальные значения рН при воздействии протолитов. В процессе метаболизма в организме постоянно происходит синтез, распад и взаимодействие огромного количества химических соединений. Все эти процессы осуществляются при помощи ферментов, активность которых связана с определённым значением рН.
Обеспечение постоянства рН крови и других органов и тканей является одним из важнейших условий нормального существования организма. Это обеспечение достигается наличием в организме многочисленных регулирующих систем, важнейшими из которых являются буферные системы. Последние играют основную роль в поддержании КОР в организме как в условиях физиологии, так и патологии.
Кроме того, материал данной темы необходим для изучения последующих тем предмета (потенциометрия, свойства растворов ВМС и т.д.) и таких дисциплин как биохимия, микробиология, гистология, гигиена, физиология, в практической деятельности врача при оценке типа и тяжести нарушений КОР.
Буферные растворы
Одним из основных свойств живых организмов является поддержание кислотно-основного гомеостаза на определенном уровне. Протолитический гомеостаз – постоянство рН биологических жидкостей, тканей и органов. Это находит выражение в достаточно постоянных значениях рН биологических сред (крови, слюны, желудочного сока и т.д.) и способности организма восстанавливать нормальные значения рН при воздействии протолитов. Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы (легочную и почечную компенсацию), но и физико-химические: буферное действие, ионный обмен и диффузию.
Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы.
Различают в основном протолитические буферные растворы двух типов:
· Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa – ацетатный буфер
СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного
кислота
основания
СН3СООNa → Na+ + CH3COO-
· Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O ↔ OH- + NH4+ избыток
Основание
сопряженной
NH4Cl → Cl- + NH4+ кислоты
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:
рН = рК + ℓg , pOH = pK + ℓg ,
где рК = -ℓg КД.
С – молярная или эквивалентная концентрация электролита (C = V N)
Механизм действия буферных растворов
Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
1. При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием СН3СОО- в слабый электролит СН3СООН.
CH3COO‾ +H + ↔ CH3COOH (1)
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
рН = рК + ℓg
2. При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾:
CH3COOН + OH ‾ ↔ CH3COO‾ + H2O (2)
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В.Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
рН = рК + ℓg
3. При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными.
Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
Для количественной характеристики буфера вводится понятие буферной ёмкости.
Буферная ёмкость
Это способность буферной системы противодействовать изменению рН среды.
Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия.
Она равна рН = рК ± 1
Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
В =
В – буферная ёмкость,
nЭ – количество моль-эквивалента сильной кислоты или щелочи,
рНН – начальное значение рН ( до добавления кислоты или щелочи)
рНК – конечное значение рН (после добавления кислоты или щелочи)
ΔрН – изменение рН.
На практике буферная ёмкость рассчитывается по формуле:
В =
V – объём кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи,
Vбуф.- объём буферного раствора,
Δ рН – изменение рН.
О противодействии изменению рН крови свидетельствуют следующие данные. Чтобы сдвинуть рН крови на единицу в щелочную область, нужно прибавить в кровь в 70 раз больше количества NaOH, чем в такой же объём чистой воды. Для изменения рН на единицу в кислую область, следует в кровь добавить в 320 раз больше количества соляной кислоты, чем к такому же объёму чистой воды.
Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице.
Буферная ёмкость артериальной крови 25,3 ммоль/л, венозной – 24,3 ммоль/л, слюна обладает буферной ёмкостью и определяется бикарбонатной, фосфатной и белковой системами. Буферная ёмкость слюны изменяется под влиянием ряда факторов: углеводистая диета снижает буферную ёмкость слюны, высокобелковая диета – повышает её. Поражаемость зубов кариесом меньше у лиц с высокой буферной ёмкостью.
В организме человека действуют белковый, гемоглобиновый, фосфатный и бикарбонатный буферы.
Буферные системы организма.
Бикарбонатный буфер.
Он составляет 53 % буферной ёмкости и представлен:
Н2СО3
NaHCO3 Соотношение 1 : 20
Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
Механизм действия.
1. В случае накопления кислот в крови уменьшается количество НСО3- и происходит реакция: НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑. Избыток удаляется лёгкими. Однако значение рН крови остаётся постоянным, так как увеличивается объём лёгочной вентиляции, что приводит к уменьшению объёма СО2
2. При увеличении щелочности крови концентрация НСО3- увеличивается: Н2СО3 + ОН- ↔ НСО3- + Н2О.
Это приводит к замедлению вентиляции лёгких, поэтому СО2 накапливается в организме и буферное соотношение остаётся неизменным.
Гемоглобиновый буфер
Составляет 35 % буферной ёмкости.
Главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови.
Она представлена двумя слабыми кислотами – гемоглобином и оксигемоглобином и сопряженными им основаниями – соответственно гемоглобинат- и оксигемоглобинат-ионами:
HHb ↔ H+ + Hb-
HHbO2 ↔ H+ HbO2-
Оксигемоглобин – более сильная кислота (рКа = 6,95), чем гемоглобин (рКа = 8,2). При рН = 7,25 (внутри эритроцитов) оксигемоглобин ионизирован на 65%, а гемоглобин – на 10%, поэтому присоединение кислорода к гемоглобину уменьшает значение рН крови, так как при этом образуется более сильная кислота. С другой стороны, по мере отдачи кислорода оксигемоглобином в тканях значение рН крови вновь увеличивается.
Буферные свойства ННb прежде всего обусловлены возможностью взаимодействия кислореагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb + Н2СО3 ↔ КНСО3 + ННb.
Образующийся гидрокарбонат (КНСО3) уравновешивает количество поступающей Н2СО3, рН сохраняется, так как происходит диссоциация потенциальных молекул Н2СО3 и образовавшихся гемоглобиновых кислот.
Именно таким образом поддерживается рН крови в пределах нормы, несмотря на поступление в венозную кровь огромного количества СО2 и других кислореагирующих продуктов обмена.
В капиллярах лёгких гемоглобин (ННb) поглощает кислород и превращается в HHbO2, что приводит к некоторому подкислению крови, вытеснению некоторого количества Н2СО3 из бикарбонатов и понижению щелочного резерва крови, а в тканях отдает его и поглощает СО2.
В лёгких: ННb + O2 ↔ HHbO2;
HHbO2 + HCO3- ↔ HbO2 + H2O + CO2 ↑
В тканях: HbO2 ↔ Hb- + O2; Hb- + Н2СО3 ↔ ННb + HCO3-
Кроме того, гемоглобиновый буфер является сложным белком и действует как белковый буфер.
Фосфатный буфер
Составляет 5 % буферной ёмкости. Содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4 и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат ион Н2РО4- и гидрофосфат ион НРО42-.
Отношение [HPO4 2- ]/[H2PO4-] в плазме крови (при рН = 7,4) равно 4 : 1. Следовательно, эта система имеет буферную ёмкость по кислоте больше, чем по основанию.
Например, при увеличении концентрации катионов Н+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами НРО4 2- :
Н + + НРО42- ↔ Н2РО41-
Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи.
При увеличении концентрации оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами Н2РО41-:
ОН ‾ + Н2РО41- ↔ НРО42- + Н2О
Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается.
Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи – от 4,8 до 7,5. Фосфатная буферная система крови характеризуется меньшей буферной ёмкостью, чем гидрокарбонатная, из-за малой концентрации компонентов крови. Однако эта система играет решающую роль не только в моче, но и в других биологических средах – в клетке, в соках пищеварительных желез, в моче.
Белковый буфер
Составляет 5 % буферной ёмкости. Он состоит из белка-кислоты и его соли, образованной сильным основанием.
Pt – COOH – белок-кислота
Pt – COONa – белок-соль
1. При образовании в организме сильных кислот они взаимодействуют с солью белка. При этом получается эквивалентное количество белок-кислоты: НС1 + Pt-COONa ↔ Pt-COOH + NaCl. По закону разбавления В.Оствальда увеличение концентрации слабого электролита уменьшает его диссоциацию, рН практически не меняется.
2. При увеличении щелочных продуктов они взаимодействуют с
Pt-СООН: NaOH + Pt-COOH ↔ Pt-COONa + H2O
Количество кислоты уменьшается. Однако концентрация ионов Н+ увеличивается за счет потенциальной кислотности белок-кислоты. поэтому практически рН не меняется.
Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие.
Рассмотрим взаимодействие буферных систем в организме по стадиям:
1. В процессе газообмена в легких кислород поступает в эритроциты, где протекает реакция:
ННb + O2 ↔ HHbO2 ↔ Н+ + HbO2-
2. По мере перемещения крови в периферические отделы кровеносной системы происходит отдача кислорода ионизированной формой HbO2-
HbO2-↔ Нb- + О2
Кровь при этом из артериальной становится венозной. Отдаваемый в тканях кислород расходуется на окисление различных субстратов, в результате чего образуется СО2, большая часть которого поступает в эритроциты.
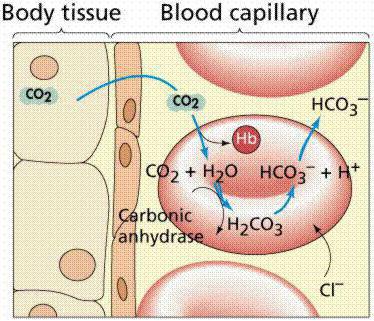
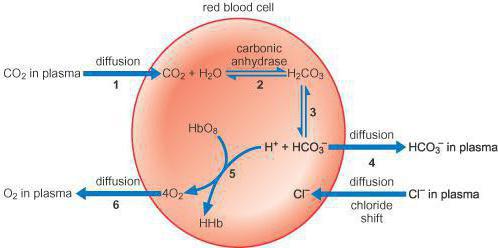
3. В эритроцитах в присутствии карбоангидразы со значительной скоростью протекает следующая реакция:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-
4. Образующийся избыток протонов связывается с гемоглобинат-ионами:
Н+ + Нb- → HHb
Связывание протонов смещает равновесие реакции стадии (3) вправо, вследствие чего концентрация гидрокарбонат ионов возрастает и они диффундируют через мембрану в плазму. В результате встречной диффузии ионов, отличающихся кислотно-основными свойствами (хлорид-ион протолитически неактивен; гидрокарбонат ион в условиях организма является основанием), возникает гидрокарбонатно-хлоридный сдвиг. Этим объясняется более кислая реакция среды в эритроцитах (рН = 7,25) по сравнению с плазмой (рН = 7,4).
5. Поступающие в плазму гидрокарбонат-ионы нейтрализуют накапливающийся там избыток протонов, возникающий в результате метаболических процессов:
НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2
6. Образовавшийся СО2 взаимодействует с компонентами белковой буферной системы:
СО2 + Рt-NH2 ↔ Pt-NHCOOH ↔ H+ + Pt-NHCOO-
7. Избыток протонов нейтрализуется фосфатным буфером:
Н+ + НРО4- ↔ Н2РО4-
8. После того как кровь вновь попадает в легкие, в ней увеличивается концентрация оксигемоглобина (стадия 1), который реагирует с гидрокарбонат-ионами, не диффундировавшими в плазму:
НСО3- + ННbО2 ↔ НbО2- + СО2 + Н2О
Образующийся СО2 выводится через легкие. В результате уменьшения концентрации НСО3- ионов в этой части кровеносного русла наблюдаются их диффузия в эритроциты и диффузия хлорид-ионов в обратном направлении.
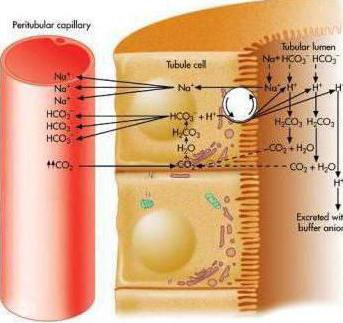
9. В почках также накапливается избыток протонов в результате реакции:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-,
который нейтрализуется гидрофофат-ионами и аммиаком (аммиачный буфер): H+ + NH3 ↔ NH4+
Таким образом, гемоглобиновая система участвует в двух процессах:
· Связывание протонов, накапливающихся в результате метаболических процессов;
· Протонирование гидрокарбонат-ионов с последующим выделением СО2
Гемоглобиновую буферную систему можно рассматривать как одно из важнейших звеньев в транспорте СО2 из тканей в легкие.
Следует отметить, что на поддержание постоянства рН различных жидких систем организма оказывают влияние не столько буферные системы, сколько функционирование ряда органов и систем: легких, почек, кишечника, кожи и др.
Источник
Огромную роль для нормального функционирования человеческого организма играет кислотно-основное равновесие. Циркулирующая в организме кровь представляет собой смесь живых клеток, которые находятся в жидкой среде обитания. Первой чертой охраны, что контролирует уровень pH в крови, выступает буферная система. Это физиологический механизм, который обеспечивает сохранение параметров кислотно-основного баланса, препятствуя перепадам pH. Что он собой представляет и какие имеет разновидности, узнаем ниже.
Описание
Буферная система – это уникальный механизм. В организме человека существует их несколько, и все они состоят из плазмы и клеток крови. Буферы представляют собою основания (белки и неорганические соединения), которые связывают или отдают Н+ и ОН-, уничтожая сдвиг pH в течение тридцати секунд. Способность буфера поддерживать кислотно-основный баланс зависит от количества элементов, из которых он слагается.
Виды буферов крови
Кровь, которая постоянно движется, представляет собой живые клетки, которые существуют в жидкой среде. pH в норме составляет 7,37-7,44. Связка же ионов происходит определенным буфером, классификация буферных систем приведена ниже. Сам же он состоит из плазмы и кровяных клеток и может быть фосфатным, белковым, бикарбонатным или гемоглобиновым. Все эти системы имеют достаточно простой механизм действия. Их деятельность нацелена на урегулирование уровня ионов в крови.
Особенности буфера гемоглобинового
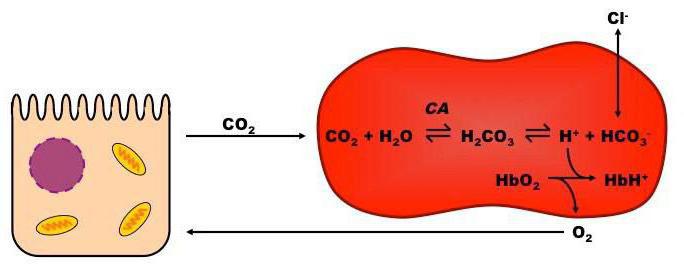
Гемоглобиновая буферная система является самой мощной из всех, она представляет собой щелочь в капиллярах тканей и кислоту в таком внутреннем органе, как легкие. На ее долю приходится около семидесяти пяти процентов всей буферной емкости. Этот механизм участвует во множестве процессах, что происходят в крови человека, и имеет в своем составе глобин. При переходе гемоглобинового буфера в другую форму (оксигемоглобин), наблюдается изменение этой формы, изменяются и кислотные свойства действующего вещества.
Качество восстановленного гемоглобина меньшее, чем у угольной кислоты, но становится намного лучше, когда он окисляется. Когда приобретается кислотность pH, гемоглобин соединяет ионы водорода, получается так, что он уже восстановленный. Когда происходит очищение углекислого газа в легких, pH получается щелочным. В это время гемоглобин, который окислился, выступает донором протонов, при помощи чего происходит уравновешивание кислотно-основного баланса. Так, буфер, что состоит из оксигемоглобина и его калиевой соли, способствует выделению из организма углекислоты.
Эта буферная система выполняет немаловажную роль в дыхательном процессе, так как совершает транспортную функцию по переносу к тканям и внутренним органам кислорода и удалению из них углекислоты. Кислотно-основное равновесие внутри эритроцитов при этом придерживается на постоянном уровне, следовательно, в крови также.
Таким образом, когда кровь насыщается кислородом, гемоглобин превращается в сильную кислоту, а когда кислород он отдает, то превращается в достаточно слабую органическую кислоту. Системы оксигемоглобина и гемоглобина – взаимопревращающиеся, они существуют как одно целое.
Особенности бикарбонатного буфера
Бикарбонатная буферная система выступает также мощной, но и самой управляемой в организме. На ее долю приходится около десяти процентов всей буферной емкости. Она имеет универсальные свойства, которые обеспечивают ее двухстороннюю эффективность. В состав этого буфера входит сопряженная кислотно-щелочная пара, что состоит из таких молекул, как угольная кислота (источник протона) и бикарбонат аниона (акцептор протона).
Так, бикарбонатная буферная система способствует протеканию систематического процесса, где в кровь попадает мощная кислота. Этот механизм связывает кислоту с бикарбонатом анионов, образуя кислоту угольную и ее соль. При попадании щелочи в кровь буфер связывается с угольной кислотой, образуя бикарбонатную соль. Так как гидрокарбоната натрия в крови человека больше, чем угольной кислоты, данная буферная емкость будет иметь высокую кислотность. Другими словами, гидрокарбонатная буферная система (бикарбонатная)очень хорошо проводит компенсацию веществ, которые повышают кислотность крови. К ним относится и молочная кислота, концентрация которой увеличивается при интенсивных физических нагрузках, а данный буфер очень быстро реагирует на изменения кислотно-основного баланса в крови.
Особенности фосфатного буфера
Фосфатная буферная система человека занимает близко двух процентов всей буферной емкости, что связано с содержанием в крови фосфатов. Этот механизм поддерживает показатель pH в моче и жидкости, что находится внутри клеток. Буфер состоит из неорганических фосфатов: одноосновного (выполняет роль кислоты) и двухосновного (выполняет роль щелочи). При нормальном показателе pH соотношение кислоты и основания равняется 1:4. При увеличении количества ионов водорода фосфатная буферная система связывается с ними, образуя кислоту. Этот механизм больше кислотный, чем щелочной, поэтому он отлично нейтрализует поступающие в кровь человека кислые метаболиты, например, молочную кислоту.
Особенности белкового буфера
Белковый буфер играет не такую особую роль в стабилизации кислотно-щелочного баланса, по сравнению с другими системами. На его долю приходится около семи процентов всей буферной емкости. Белки состоят из молекул, которые объединяются в кислотно-щелочные соединения. В кислой среде они выступают щелочами, которые связывают кислоты, в щелочной среде все происходит наоборот.
Это приводит к тому, что образуется белковая буферная система, которая достаточно эффективна при значении pH от 7,2 до 7,4. Большая доля белков представлена альбуминами и глобулинами. Так как белковый заряд нулевой, то при нормальном показателе pH он находится в виде щелочи и соли. Эта буферная емкость зависит от количества белков, их структуры и свободных протонов. Данный буфер может нейтрализовать и кислые, и щелочные продукты. Но емкость она имеет больше кислотную, чем щелочную.
Особенности эритроцитов
В норме эритроциты имеют постоянный показатель pH – 7,25. Здесь оказывают действие гидрокарбонатный и фосфатный буферы. Но по мощности они отличаются от тех, что находятся в крови. В эритроцитах белковый буфер играет особую роль в обеспечении органов и тканей кислородом, а также удалению из них углекислоты. Кроме этого, он поддерживает постоянное значение внутри эритроцитов pH. Белковый буфер в эритроцитах тесно связан с гидрокарбонатной системой, так как соотношение кислоты и соли здесь меньшее, чем в крови.
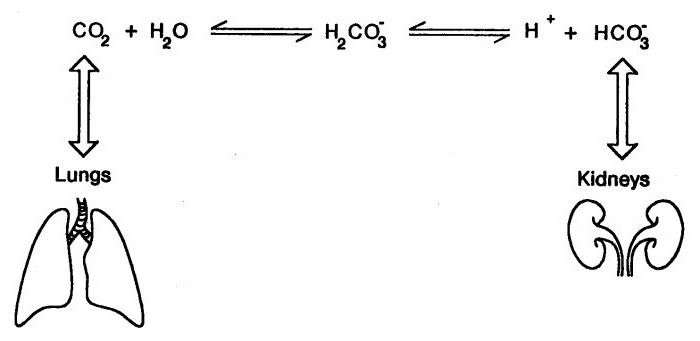
Пример буферной системы
Растворы сильных кислот и щелочей, которые обладаю слабыми реакциями, имеют непостоянный показатель pH. Но смесь кислоты уксусной с ее солью сохраняет имеет стабильное значение. Даже если к ним добавить кислоту или щелочь, кислотно-основное равновесие не изменится. В качестве примера можно рассмотреть ацетатный буфер, который состоит из кислоты СН3СООН и ее соли СН3СОО. Если добавить сильную кислоту, то основание соли свяжет ионы Н+ и превратится в кислоту уксусную. Снижение уровня анионов соли уравновешивается увеличением молекул кислоты. В результате этого наблюдается незначительное изменение в соотношении кислоты и ее соли, поэтому pH изменяется совсем незаметно.
Механизм действия буферных систем
При поступлении в кровь кислых или щелочных продуктов буфер обеспечивает постоянное значение pH до тех пор, пока поступившие продукты не выведутся или не используются в процессах метаболизма. В крови человека представлены четыре буфера, каждый из которых состоит из двух частей: кислоты и ее соли, а также сильной щелочи.
Эффект буфера обуславливается тем, что он связывает и нейтрализует ионы, которые поступают соответствующим ему составом. Поскольку в природе организм больше всего сталкивается с недоокисленными продуктами обмена, свойства буфер имеет антикислотные больше, чем антищелочные.
Каждая буферная система имеет свой принцип работы. При снижении уровня pH ниже отметки 7,0 начинается их активная деятельность. Они начинают связывать излишки свободных ионов водорода, образуя комплексы, которые перемещают кислород. Он, в свою очередь, перемещается к системе пищеварения, легким, коже, почкам и так далее. Такая транспортировка кислых и щелочных продуктов способствует их разгрузке и выведению.
В организме человека только четыре буферные системы играют важные роли в сохранении кислотно-основного равновесия, но существуют и другие буферы, например, ацетатная буферная система, которая имеет слабую кислоту (донор) и ее соль (акцептор). Способность этих механизмов противостоять изменениям pH при попадании кислоты или соли в кровь является ограниченной. Они поддерживают кислотно-щелочное равновесие только в том случае, когда сильная кислота или щелочь поступают в определенном количестве. Если оно будет превышено, pH резко изменится, буферная система прекратит свое действие.
Эффективность буферов
Буферы крови и эритроцитов имеют различную эффективность. У последних она выше, так как здесь присутствует гемоглобиновый буфер. Уменьшение количества ионов происходит по направлению от клетки до межклеточной среды, а затем до крови. Это говорит о том, что самая большая буферная емкость у крови, а меньшую имеет внутриклеточная среда.
При метаболизме в клетках появляются кислоты, которые проходят в межклеточную жидкость. Это происходит тем легче, чем их больше появляется в клетках, поскольку переизбыток ионов водорода увеличивает проницаемость мембраны клетки. Нам уже известна классификация буферных систем. В эритроцитах они имеют более эффективные свойства, так как здесь еще играют роль коллагеновые волокна, которые реагируют набуханием на накопление кислоты, они ее поглощают и освобождают от ионов водорода эритроциты. Такая его способность обуславливается свойством абсорбции.

Взаимодействие буферов в организме
Все механизмы, которые находятся в организме, взаимосвязаны между собой. Буферы крови состоят из нескольких систем, вклад которых в поддержание кислотно-щелочного баланса различный. При попадании крови в легкие она получает кислород путем его связывания в эритроцитах гемоглобином, образуя оксигемоглобин (кислоту), что поддерживает уровень pH. При содействии карбоангидразы происходит параллельное очищение крови легких от углекислоты, которая в эритроцитах представлена в виде слабой двухосновной угольной кислотой и карбаминогемоглобином, а в крови – углекислотой и водой.
При уменьшении в эритроцитах количества слабой двухосновной угольной кислоты происходит проникновение ее из крови в эритроцит, и очищение крови от углекислоты. Таким образом, из клеток в кровь постоянно проходит слабая двухосновная угольная кислота, а из крови в эритроциты для соблюдения нейтральности поступают неактивные анионы хлорида. В результате этого в красных клетках крови среда более кислотная, чем в плазме. Все системы буферов обосновываются отношением донор-акцептор протона (4:20), что связано с особенностями метаболизма организма человека, который образует большее число кислотных продуктов, чем щелочных. Очень важным здесь является показатель кислотных буферных емкостей.

Обменные процессы в тканях
Кислотно-основной баланс поддерживается буферами и метаболическими превращениями в тканях организма. Этому помогают биохимические и физико-химические процессы. Они способствуют потере кислотно-щелочных свойств продуктов обмена веществ, их связыванию, образованию новых соединений, которые быстро выводятся из организма. Например, большое количество молочной кислоты выводится в гликоген, органические кислоты нейтрализуются солями натрия. Сильные кислоты и щелочи растворяются в липидах, а органические кислоты подвергаются окислению, образуя угольную кислоту.
Таким образом, буферная система – это первый помощник при нормализации кислотно-щелочного баланса в организме человека. Стабильность pH нужна для нормальной работы биологических молекул и структур, органов и тканей. При нормальных условиях буферные процессы поддерживают равновесие между появлением и удалением ионов водорода и углекислого газа, что способствует обеспечению в крови постоянного уровня pH.
Если происходит сбой в работе буферных систем, то у человека появляются такие патологии, как алкалоз или ацидоз. Все буферные системы взаимосвязаны и направлены на поддержание стабильного кислотно-основного равновесия. В организме человека постоянно образуется большое число кислых продуктов, которое эквивалентно тридцати литрам сильной кислоты.
Постоянство реакций внутри организма обеспечивают мощные буферы: фосфатный, белковый, гемоглобиновый и бикарбонатный. Существуют и другие буферные системы, но эти являются основными и самыми нужными для живого организма. Без их помощи у человека начнут развиваться различные патологии, которые могут привести к коме или летальному исходу.
Источник
