Какие частицы обуславливают такие свойства

Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира. Вещества, существующие в природе, постоянно претерпевают различные изменения.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, не сопровождающиеся превращениями одних веществ, в другие (обычно изменяется агрегатное состояние веществ или их форма).
Химические явления – явления, в результате которых из данных веществ образуются другие.
Иначе химические явления называют химическими реакциями.
Каждое вещество обладает строго определёнными свойствами.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.
Физические свойства:
m – масса, V – объём, ρ – плотность.
Масса может быть выражена в граммах, объем в миллилитрах (если это жидкость) или литрах (если это газ).
1 мл = 1 см3, 1 л = 1 дм3, 1000 л = 1 м3
Поэтому плотность измеряют в г/мл, г/см3 (если это жидкость), или в г/л, г/дм3 (если это газ).
Если принять V = 1, то плотность – это масса единичного объёма вещества.
Химические свойства – это те химические реакции, в которые вступает данное вещество.
Так же можно сказать, что химические свойства – это те химические реакции, которые характеризуют группу веществ (класс веществ). Например, мы будем в дальнейшем изучать свойства воды, свойства класса оксидов, свойства класса алканов и т.д.
ООсновы атомно – молекулярного учения
Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Существование атомов было доказано эмпирическим путём в конце 16 – начале 17 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились. Его суть можно свести к ряду важных положений, которые необходимо запомнить.
Все вещества, существующие в природе, представляют собой совокупность очень большого числа частиц (атомов, молекул или ионов). В зависимости от типа частиц все вещества условно подразделяют на две группы: вещества молекулярного строения и вещества немолекулярного строения (атомного или ионного).
Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула.
Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии.
В твёрдом агрегатном состоянии вещества, составляющие его частицы находятся относительно упорядоченно (кристаллическое состояние), их кинетическая энергия (энергия движения) существенно меньше чем потенциальная (энергия покоя). В газообразном состоянии, частицы свободно движутся в предоставленном им объёме и их кинетическая энергия существенно выше чем потенциальная.
В жидкости же потенциальная энергия частиц примерно равна их кинетической энергии. Это связано с тем, что часть частиц жидкости находится относительно упорядоченно в составе так называемых кластеров(англ. cluster— скопление). Другие же частицы свободно перемещаются по объёму жидкости. Чем ниже температура жидкости, тем больше в ней кластеров и наоборот.
Рис. Кластеры воды, где число молекул 20-220
Следует отметить, что существуют еще два дополнительные “состояния”. Это жидкокристаллическое состояние и состояние плазмы.
Цитоплазматическая мембрана клетки – типичный пример жидкого кристалла. Молекулы фосфолипидов в биологической мембране относительно упорядоченно распределяются в двух слоях, но при этом могут в пределах слоя свободно перемещаться, а также “перескакивать” из одного слоя в другой.
Жидкие кристаллы имеют широкое применение в технике (напр., ЖК-мониторы компьютеров).
Плазма (от греч. πλάσμα «вылепленное», «оформленное») — ионизованный газ.
Плазма в своём составе содержит свободные электроны, катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы).
Так как плазма содержит заряженные частицы, то она проводит электрический ток и на неё можно воздействовать внешним магнитным полем. Различают низкотемпературную и высокотемпературную плазму.
Изучает свойства плазмы наука физика.
Вещество из одного агрегатного состояния может переходить в другие агрегатные состояния при изменении внешних условий – температуры (T) и давления (P). Такие переходы принято называть фазовыми переходами.
Так, при повышении температуры, твердое вещество превращается в жидкость, а жидкость при ещё большей температуре превращается в газ. Дальнейшее повышение температуры переводит газ в плазму. При таких переходах вещество в другие вещества не превращается. Напомним, что такие явления мы называем физическими. Поэтому фазовые переходы – это физические явления.
При понижении температуры происходят обратные фазовые переходы – газ превращается в жидкость, а жидкость переходит в твердое состояние.
Фазовые переходы имеют названия.
Твердое —> Жидкое (плавление, обратный переход – кристаллизация)
Жидкое —> Газообразное (испарение, обратный переход – конденсация)
Газообразное —> Плазма (ионизация, обратный переход – деионизация)
Твердое —> Газообразное (сублимация или возгонка, обратный переход – десублимация)
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии в зависимости от условий (температуры и давления).
Поэтому, например, такая фраза как: “Вода – жидкое вещество”, является некорректной. Если мы говорим об агрегатном состоянии вещества, то следует обязательно уточнить условия в которых находится вещество – температуру и давление. Такая фраза как: “При нормальном атмосферном давлении и комнатной температуре, вода – жидкое по агрегатному состоянию вещество”, является правильной.
С точки зрения физики, что более точно, вещество – это форма материи, состоящая из частиц, обладающих массой покоя. Существуют частицы, не обладающие массой покоя, например, фотоны. Материя, состоящая из частиц, не обладающих массой покоя называется поле.
Протоны, нейтроны, электроны – это частицы, обладающие массой покоя, следовательно это частицы вещества. Но химия не изучает вещество, состоящее, к примеру, из электронов (электронный газ), или вещество, состоящее из нейтронов (нейтронный газ). Это удел физики.
Химия изучает вещества, состоящие из атомов, молекул или ионов.
Ввиду этого вещество условно можно подразделить на физическое (электронный газ в проводнике, нейтронный газ и т.д.) и химическое (состоящее из атомов, молекул, ионов, свободных радикалов).
Источник
Глава 2. Металлы
Из курса химии 9 класса вы уже имеете представление о природе химической связи, существующей в кристаллах металлов, — металлической связи. Напомним, что в узлах металлических кристаллических решёток располагаются атомы и положительные ионы металлов, связанные посредством обобществлённых внешних электронов, принадлежащих всему кристаллу. Эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решётки.
Металлическая связь обусловливает все важнейшие физические свойства металлов: пластичность, электро- и теплопроводность, металлический блеск и другие свойства, характерные для этого класса простых веществ.
Пластичность — это свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. Оно лежит в основе такой уважаемой большинством народов мира профессии, как профессия кузнеца. Недаром покровителем кузнечного дела у разных народов был бог огня: у греков — Гефест, у римлян — Вулкан, у славян — Сварог.
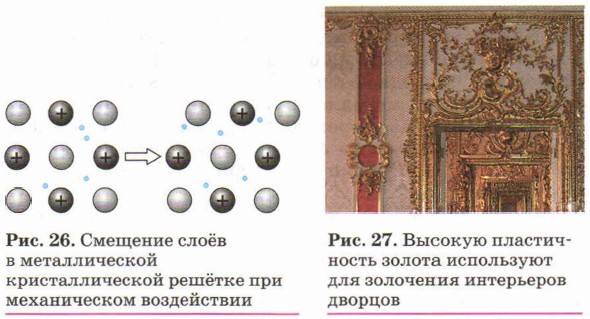
Пластичность металлов обусловлена способностью одних слоёв атом-ионов в кристаллах под внешним воздействием легко смещаться (как бы скользить) по отношению к другим слоям без разрыва связей между ними (рис. 26). Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий (рис. 27).
Высокая электропроводность большинства металлов обусловлена присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются под действием электрического поля (рис. 28).
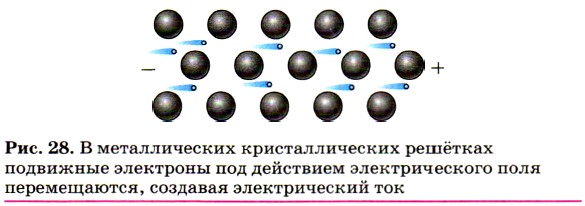
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. При охлаждении электропроводность металлов увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, наименьшую — марганец, свинец, ртуть и вольфрам.
Такое свойство, как теплопроводность металлов, также связано с высокой подвижностью свободных электронов: сталкиваясь с колеблющимися в узлах решётки ионами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов при посредстве электронов передаются другим ионам, и температура всего металлического предмета быстро выравнивается.
Для гладкой поверхности металлов характерен металлический блеск — результат отражения световых лучей. В порошкообразном состоянии большинство металлов теряет блеск, приобретая чёрную или серую окраску, и только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала, в том числе и применяемые в прожекторах.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для всех металлов (кроме ртути) при обычных условиях характерно твёрдое агрегатное состояние. Однако твёрдость их различна. Наиболее твёрдые — металлы побочной подгруппы VI группы (VIB группы) Периодической системы Д. И. Менделеева. Так, хром по твёрдости приближается к алмазу. Самые мягкие — металлы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева — щелочные металлы. Например, натрий и калий легко режутся ножом.

По плотности металлы делят на лёгкие (плотность меньше 5 г/см3) и тяжёлые (плотность больше 5 г/см3). К лёгким относят щелочные, щёлочноземельные металлы и алюминий. Из переходных металлов сюда включают скандий, иттрий и титан. Эти металлы, благодаря лёгкости и тугоплавкости, всё шире применяют в различных областях техники.
Самый лёгкий металл — это литий (р = 0,53 г/см3). Самый тяжёлый — осмий (р = 22,6 г/см3).
Лёгкие металлы обычно легкоплавки, галлий может плавиться уже на ладони руки, а тяжёлые металлы — тугоплавки. Наибольшей температурой плавления, которая равна 3380 °С, обладает вольфрам. Это свойство вольфрама используют для изготовления ламп накаливания (рис. 29, 2). Кроме него в конструкцию лампы входят ещё семь металлов.
В Российской Федерации в настоящее время, как и ранее в Евросоюзе и США, на государственном уровне принято решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например галогенные, люминесцентные и светодиодные. Галогенная лампа (рис. 29, 2) — это та же лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или иода).

Люминесцентные (рис. 29, 3) — это хорошо знакомые вам лампы дневного света, имеющие один существенный недостаток — они содержат ртуть, а потому нуждаются в соблюдении особых правил утилизации на специальных пунктах приёма. Светодиодные лампы (рис. 29, 4) — самые экономичные и самые долговечные (срок работы до 100 тыс. ч), но пока и самые дорогие из ламп.
В технике, как вы уже знаете, металлы делят на чёрные (железо и его сплавы) и цветные (все остальные, более подробно о них будет рассказано в следующем параграфе) (рис. 30). Золото, серебро, платину и некоторые другие металлы относят к драгоценным металлам (рис. 31). 1


1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.

1. Назовите самый легкоплавкий металл.
2. Какие физические свойства металлов используют в технике?
3. Фотоэффект, т. е. свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например для цезия. Почему? Где это свойство находит применение?
4. Какие физические свойства вольфрама лежат в основе его применения в лампах накаливания?
5. Какие свойства металлов лежат в основе образных литературных выражений: «серебряный иней», «золотая заря», «свинцовые тучи»?
- Физические свойства металлов. Ответы
Источник
Кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионная решетка
Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. Примеры: КОН, СаСО$_3$, СН$_3$СООК, NH$_4$NO$_3$, [CH$_3$NH$_3$]Cl, С$_2$Н$_5$ОК. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.

Свойства ионных кристаллов:
твердые, но хрупкие;
отличаются высокими температурами плавления;
нелетучи, не имеют запаха;
расплавы ионных кристаллов обладают электропроводностью;
многие растворимы в воде. При растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Атомная решетка
В узлах решетки — атомы, связанные ковалентными связями. Химическая связь — ковалентная полярная или неполярная. Атомная кристаллическая решетка характерна для углерода (алмаз, графит — рисунок), бора, кремния, германия, оксида кремния SiO$_2$ (кремнезем, кварц, речной песок), карбида кремния SiC (карборунд), нитрида бора BN. Свойства: высокая твердость, высокие температуры плавления, нерастворимость, нелетучесть, отсутствие запаха.
Свойства веществ с атомной кристаллической решеткой:
высокая твердость;
высокие температуры плавления;
нерастворимость;
нелетучесть;
отсутствие запаха.
Металлическая решетка
Реализуется в простых веществах — металлах и их сплавах. В узлах решетки — атомы и катионы металла, при этом электроны металла обобществляются и образуют так называемый электронный газ, который движется между узлами решетки, обеспечивая ее устойчивость.

Молекулярные решетки
В узлах — молекулы веществ, которые удерживаются в узлах решетки с помощью слабых межмолекулярных сил.
Молекулярное строение имеют:
все органические вещества (кроме солей);
вещества — газы и жидкости;
легкоплавкие и летучие твердые вещества, в молекулах которых ковалентные связи (полярные и неполярные).
Подобные вещества часто имеют запах.
Обобщающая таблица
Кристаллические решетки, вид связи и свойства веществ
| Тип решетки | Виды частиц в узлах решетки | Вид связи между частицами | Примеры веществ | Физические свойства веществ |
| Ионная | Ионы | Ионная — связь прочная | Соли, галогениды (IA, IIA), оксиды и гидроксиды щелочных и щел.-зем. металлов | Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток |
| Атомная | Атомы | 1. Ковалентная неполярная — очень прочная 2. Ковалентная полярная связь — очень прочная. Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si) | Сложные вещества:оксид алюминия (Al$_2$O$_3$), оксид кремния (IV) SiO$_2$ | Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде |
| Молекулярная | Молекулы | Между молекулами слабые силы межмолекулярного притяжения, внутри молекул прочная ковалентная связь | При обычных условиях – газы, жидкости или летучие твердые вещества (О$_2$, Н$_2$, Cl$_2$, N$_2$, Br$_2$, H$_2$O, CO$_2$, HCl); сера, белый фосфор, иод; органические вещества | Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость |
| Металлическая | Атом-ионы | Металлическая разной прочности | Металлы и сплавы | Ковкие, обладают блеском, пластичностью, тепло- и электропроводны |
Источник


Похожие вопросы:

Химия, 12.03.2019 14:40
Некое вещество имеет атомную кристаллическую решетку. охарактеризуйте предположительно его свойства по плану : а) твердость; б) электропроводимость; в) пластичность или хрупкость; г) металлический блеск; д) температура плавления
Ответов: 1

Другие предметы, 16.04.2019 23:10
Укажите свойство металлов, которое используется при производстве зеркал 1) пластичность 2) металлический блеск
Ответов: 2

Другие предметы, 17.04.2019 07:30
Дополните. Химическая связь, обусловливающая металлический блеск и пластичность металлов, – … .
Ответов: 2

Химия, 25.05.2019 22:20
1. ионная связь возникает в результате а. образования общих электронных пар б. обобществления электронов внешнего энергетического уровня многих атомов в. взаимного притяжения разноименно заряженных ионов г. различие в электроотрицательности атомов 2. какие частицы обуславливают такие свойства, металлов, как пластичность, металлический блеск, электрическая проводимость, теплопроводность а. атомы б. ионы в. молекулы г. обобществленные электроны (электронный газ)
Ответов: 1

Химия, 04.07.2019 02:00
Где применяется теплопроводность металлов, металлический блеск, и пластичность
Ответов: 3

Химия, 08.07.2019 12:20
Стестом по а4. оцените следующие утверждения: а) для атомов металлов характерны восстановительные и окислительные свойства; б) на внешнем энергетическом уровне атомов металлов от 4 до 8 электронов. 1) верно только а 2) верно только б 3) верны оба суждения 4) оба суждения неверны а5. металлы, встречающиеся в природе только в виде сложных соединений: 1) золото и алюминий 2) натрий и кальций 3) медь и железо 4) серебро и золото а6. тип связи в простом веществе кальции: 1) ионная 2) ковалентная неполярная 3) ковалентная полярная 4) металлическая а7. к свойствам металлов не относят: 1) пластичность 2) металлический блеск 3) электропроводность 4) растворимость в воде
Ответов: 1

Химия, 10.07.2019 22:50
Что не является общим свойством металлов? а)тугоплавкость б)пластичность в)высокая электропроводность г)металлический блеск
Ответов: 2

Химия, 15.07.2019 14:00
Какое свойство нехарактерно для простых веществ- металлов? a)хорошая теплопроводность b)хрупкость c)пластичность d)металлический блеск
Ответов: 3

Химия, 13.08.2019 19:40
Какие утверждения верны 1) металлическая связь обуславливает общие свойства металлов 2) металлический блеск металлов являются результатом отражения от их поверхности световых лучей 3) железо самый тугоплавкий металл 4) основы сна принадлежностей железо и его сплавы металлы делятся на черные и цветные 5) самый легкий металл относится к семейству щелочноземельных металлов 6) способность отдавать электроны в реакциях это характерно свойство металлов за .
Ответов: 2

Химия, 13.09.2019 08:50
Ксвойствам металлов не относят: a. пластичность b. металлический блеск c. электропроводность d. растворимость в воде
Ответов: 3

Физика, 02.10.2019 17:10
Увсех металлов компактном состоянии есть металлический блеск. большинство металлов при переходе в стружку опилки или пыль утрачивает это свойство. а какие два металла великолепной семерки сохраняют блеск даже в таком состоянии? а)золото, б)железо, в)медь, г)свинец, д)серебро.
Ответов: 2

Химия, 23.10.2019 11:31
а
1. охарактеризуйте эпохи металлов в человечества (8 7):
– век медный – .
– век бронзовый – .
– век железный – .
і. свойства металлов
1.заполните таблицу “строение и свойства металлов” (8 9)
шедев
vll, po na
свойство
cacau,
особенность строения | примеры металлов, у
кристаллической решётки которых свойство наиболее
выражено
пластичность
электропроводность
теплопроводность
металлический блеск
твердость
arme zou
плотность
– твердые – .
– мягкие –
– лёгкие –
– тяжёлые –
– лёгкоплавкие . .
– тугоплавкие —
температура плавления
в технике металлы
черные . .
– цветные – .
– драгоценные . .
Ответов: 1
У тебя есть свой ответ?
Какие частицы обусловливают такие свойства металлов, как пластичность, металлический блеск, электрич…
Отправлено
Вопросы по другим предметам:

Математика, 17.07.2019 12:50

Русский язык, 17.07.2019 12:50

Математика, 17.07.2019 12:50

Русский язык, 17.07.2019 12:50

Математика, 17.07.2019 12:50

Математика, 17.07.2019 12:50

География, 17.07.2019 12:50

Литература, 17.07.2019 12:50

Математика, 17.07.2019 12:50

Алгебра, 17.07.2019 12:50
У тебя есть свой ответ?
Какие частицы обусловливают такие свойства металлов, как пластичность, металлический блеск, электрич…
Отправлено
Источник
