Какие есть физические свойства у углерода

Углерод – важнейший химический элемент периодической таблицы Менделеева. Без него, как и без кислорода и водорода немыслимой была бы сама Жизнь. Можно без преувеличения сказать, что жизнь всех живых существ от амебы до человека построена именно из соединений углерода. Углерод – биогенный элемент составляющий основу жизни на нашей планете. Будучи структурной единицей огромного числа различных органических соединений, он участвует и в построении живых организмов и в обеспечении их жизнедеятельности. Даже возникновение самой Жизни рассматривается учеными как сложный процесс эволюции углеродных соединений. А какие химические и физические свойства этого чудесного элемента, история его открытие и современное применение в химии, читайте об этом далее.
История открытия углерода
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.

Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Углерод в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
- Природный углерод состоит из смеси двух стабильных изотопов 12С (98,892%) и 13С (1,108%)
- Помимо этого известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14С с периодом полураспада 5,73*103 лет в небольших количествах образуется в верхних слоях атмосферы нашей планеты под действием космического излучения.
Строение атома углерода
Атом углерода имеет 2 оболочки (как впрочем, и все элементы, расположенные во втором периоде) и 6 электронов: 1s22s22p2. Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных p-орбиталях, при этом они являются неспаренными.
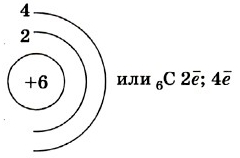
Так на картинке изображена схема электронного строения атома углерода.
Физические свойства углерода
Своими физическими свойствами углерод типичный неметалл. При этом он образует множество аллотропных модификаций («аллотропные» означает существование двух и более разных веществ из одного химического элемента): наиболее популярными из них являются алмаз, графит, уголь, сажа. При этом алмаз – одно из самых твердых веществ, представляющих углерод.
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
Химические свойства углерода
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O угарный газ
— со фтором
С + 2F2 = CF4
— с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
Вступая в реакцию с водородом, углерод образует метан:
C0 + 2H2 = CH4
Углерод в природе
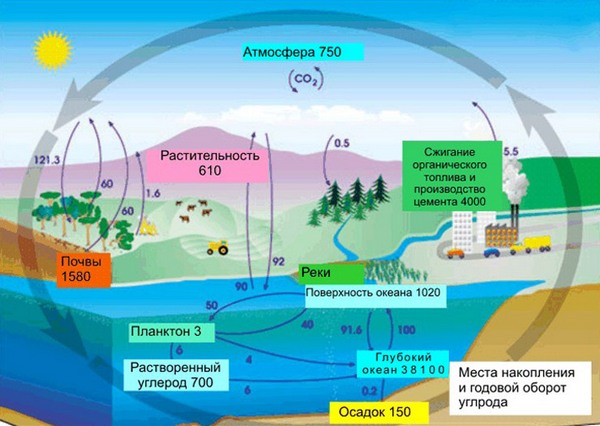
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
Применение углерода
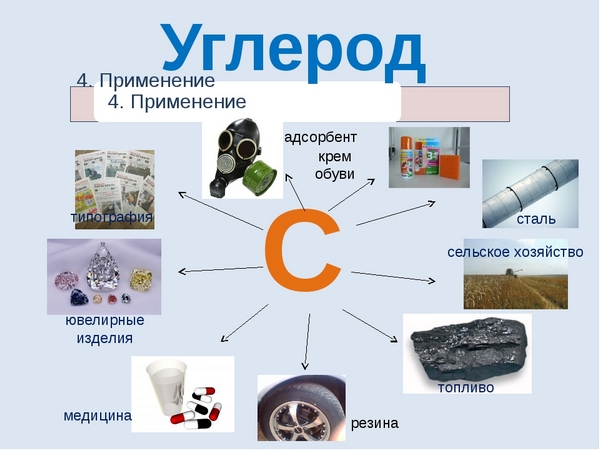
Можно сказать, что углерод неразрывно связан с самим развитием человеческой цивилизации. Именно из соединений с участием углерода образованы основные топлива, благодаря которым ездят машины, летают самолеты, вы можете приготовить себе еду и обогреть свой дом в холодную пору – это нефть и газ. Помимо этого соединения углерода активно используются в химической и металлургической промышленности, в фармацевтике и строительстве. Алмазы, будучи аллотропной модификацией углерода используются в ювелирном деле и ракетостроении. В целом промышленность современности не может обойтись без углерода, он необходим практически везде.
Рекомендованная литература и полезные ссылки
- Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ChemNet. Углерод: история открытия элемента.
- Лейпунский О. И. Об искусственных алмазах (рус.) // Успехи химии. — Российская академия наук, 1939. — Вып. 8. — С. 1519—1534.
- Seal M. The effect of surface orientation on the graphitization of diamond. // Phis. Stat. Sol., 1963, v. 3, p. 658.
Углерод, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник

Углерод – это, наверное, один из самых впечатляющих элементов химии на нашей планете, который обладает уникальной способностью образовывать огромное множество различных органических и неорганических связей.
Одним словом, углеродные соединения, которые обладают уникальными характеристиками – основа жизни на нашей планете.
…
Что такое углерод

В химической таблице Д.И. Менделеева углерод находится под шестым номером, входит в 14 группу и носит обозначение «С».
Физические свойства
Это водородное соединение, входящее в группу биологических молекул, молярная масса и молекулярная масса которого – 12,011, температура плавления составляет 3550 градусов.

Степень окисления данного элемента может быть: +4, +3, +2, +1, 0, -1, -2, -3, -4, а плотность составляет 2,25 г/см3.
В агрегатном состоянии углерод — твердое вещество, а кристаллическая решетка — атомная.
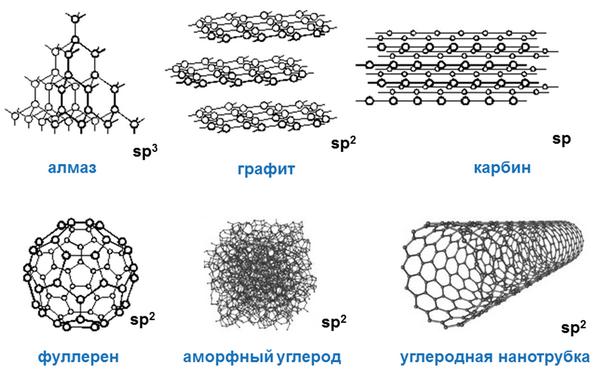
Углерод имеет следующие аллотропные модификации:
- алмаз;
- графит;
- фуллерен;
- карбин.
Строение атома
Атом вещества имеет электронную конфигурацию вида — 1S22S22P2. На внешнем уровне у атома 4 электрона, находящиеся на двух разных орбиталях.

Если же брать возбужденное состояние элемента, то его конфигурация становится 1S22S12P3.
К тому же атом вещества может быть первичным, вторичным, третичным и четвертичным.
Химические свойства

Пребывая в нормальных условиях, элемент инертен и во взаимодействие с металлами и неметаллами вступает при повышенных температурах:
- взаимодействует с металлами, вследствие чего образуются карбиды;
- вступает в реакцию с фтором (галоген);
- при повышенных температурах взаимодействует с водородом и серой;
- при повышении температуры обеспечивает восстановление металлов и неметаллов из оксидов;
- при 1000 градусах вступает во взаимодействие с водой;
- при повышении температуры горит.
Получение углерода
Углерод в природе можно найти в виде черного графита либо же, что очень редко, в виде алмаза. Ненатуральный графит получают с помощью реакции кокса с кремнеземом.

А ненатуральные алмазы получают, применяя тепло и давление вместе с катализаторами. Так металл расплавляется, а получившийся алмаз выходит в виде осадка.

Добавление азота приводит к получению желтоватых алмазов, а бора – голубоватых.
История открытия
Углерод использовался людьми с давних времен. Грекам был известен графит и уголь, а алмазы впервые нашлись в Индии. К слову, в качестве графита люди часто принимали схожие по виду соединения. Но даже несмотря на это, графит широко использовался для письма, ведь даже слово «графо» с греческого языка переводится как «пишу».

В настоящее время графит используется так же в письме, в частности его можно встретить в карандашах. В начале 18 века в Бразилии началась торговля алмазами, были открыты многие месторождения, а уже во второй половине 20 века люди научились получать ненатуральные драгоценные камни.
На настоящий момент ненатуральные алмазы используются в промышленности, а настоящие – в ювелирной сфере.
Роль углерода в организме человека
В тело человека углерод попадает вместе с пищей, в течение суток – 300 г. А общее количество вещества в человеческом организме составляет 21% от массы тела.

Из данного элемента состоят на 2/3 мышцы и 1/3 костей. А выводится из тела газ вместе с выдыхаемым воздухом либо же с мочевиной.
Стоит отметить: без этого вещества жизнь на Земле невозможна, ведь углерод составляет связи, помогающие организму бороться с губительным влиянием окружающего мира.
Таким образом, элемент способен составлять продолжительные цепи либо же кольца атомов, которые представляют собой основу для множества других важных связей.
Нахождение в природе углерода
Элемент и его соединения можно встретить повсюду. В первую очередь отметим, что вещество составляет 0,032% от общего количества земной коры.

Одиночный элемент можно встретить в каменном угле. А кристаллический элемент находится в аллотропных модификациях. Также в воздухе постоянно растет количество углекислого газа.
Большую концентрацию элемента в окружающей среде можно встретить в качестве соединений с различными элементами. Например, двуокись углерода содержится в воздухе в количестве 0,03%. В таких минералах как известняк или же мрамор, содержатся карбонаты.
Все живые организмы несут в себе соединения углерода с иными элементами. К тому же остатки живых организмов становятся такими отложениями, как нефть, битум.
Применение углерода

Соединения этого элемента широко используются во всех сферах нашей жизни и перечислять их можно бесконечно долго, поэтому мы укажем несколько из них:
- графит используется в грифелях карандашей и изготовлении электродов;
- алмазы нашли свое широкое применение в ювелирной сфере и в буровом деле;
- углерод используют как восстановитель для выведения таких элементов, как железная руда и кремний;
- активированный уголь, состоящий в основном из этого элемента, широко используется в медицинской области, промышленности и в быту.
Источник
Таблица
=>>
v
:
src=”” width=160 height=132 border=0>
| |
| |
| Поделиться в | |
История открытия:
Углерод известен с глубокой древности.
В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом,
как и при нагревании угля с селитрой, выделяется углекислый газ.
Химический состав алмаза был установлен в результате опытов А.Лавуазье
(1772) по изучения горения алмаза на воздухе и исследований С.Теннанта
(1797), доказавшего, что одинаковые количества алмаза и угля дают при
окислении равные количества углекислого газа. Углерод как химический
элемент был признан только в 1789 А.Лавуазье. В начале XIX в. старое слово уголь в русской химической литературе иногда заменялось словом “углетвор” (Шерер, 1807; Севергин, 1815); с 1824 г. Соловьев ввел название углерод. Латинское название сarboneum углерод получил от сarbo — уголь.
Получение:
Неполное сжигание метана : СН4 + О2 = С + 2Н2О (сажа);
Сухая перегонка древесины, каменного угля (древесный уголь, кокс).
Физические свойства:
Известны несколько кристаллических модификаций углерода: графит,алмаз, карбин, графен.
Графит – серо-черная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. При
комнатной температуре и нормальном давлении (0,1 Мн/м2, или 1кгс/см2)
графит термодинамически стабилен. При
атмосферном давлении и температуре около 3700°С графит возгоняется.
Жидкий углерод может быть получен при давлении выше 10,5 Мн/м2 (1051
кгс/см2) и температурах выше 3700°С. Cтруктура мелкокристаллического
графита лежит в основе строения “аморфного” углерода, который не представляет собой самостоятельной модификации (кокс, сажа, древесный уголь). Нагревание некоторых разновидностей “аморфного” углерода выше
1500-1600°С без доступа воздуха вызывает их превращение в графит.
Физические свойства “аморфного” углерода очень сильно зависят от
дисперсности частиц и наличия примесей. Плотность, теплоемкость,
теплопроводность и электропроводность “аморфного” углерода всегда выше,
чем графита.
Алмаз – очень твердое, кристаллическое
вещество. Кристаллы имеют кубическую гранецентрированную решетку:
а=3,560. При комнатной температуре и нормальном давлении алмаз
метастабилен. Заметное превращение алмаза в графит наблюдается при
температурах выше 1400°С в вакууме или в инертной атмосфере.
Карбин получен искусственно. Он представляет собой
мелкокристаллический порошок черного цвета (плотность 1,9 – 2 г/см3).
Построен из длинных цепочек атомов С, уложенных параллельно друг другу.
Графен – мономолекулярный слой (слой, толщиной в одну молекулу) атомов углерода, которые плотно упакованы в двухмерную решетку, по форме напоминающую пчелиные соты. Графен был впервые получен и исследован Александром Геймом и Константином Новоселовым, которые стали за это открытие лауреатами Нобелевской премии по физике 2010 года.
Химические свойства:
Углерод малоактивен, на холоду реагирует только с F2 (образуя CF4). При нагревании реагирует со многими неметаллами и сложными веществами, проявляя восстановительные свойства:
CO2 + C = CO выше 900°С
2H2O + C = CO2 + H2 выше 1000°С или H2O + C = CO + H2 выше 1200°С
CuO + C = Cu + CO
HNO3 + 3C = 3 CO2 + 4 NO + 2 H2O
Слабые окислительные свойства проявляются в реакциях с металлами, водородом
Ca + С = CaС2 карбид кальция
Si + С = CSi карборунд
CaO + C = CaC2 + CO
Важнейшие соединения:
Оксиды СО, СО2
Угольная кислота Н2СО3, карбонаты кальция (мел, мрамор, кальцит, известняк),
Карбиды СаС2
Органические вещества, например углеводороды, белки, жиры
Применение:
Графит используется в карандашной промышленности, также исполузется как смазка при особо высоких или низких температурах. Алмаз используется в качестве абразивного материала, драгоценных камней в ювелирных украшениях . Алмазным напылением обладают шлифовальные насадки бормашин. В фармакологии и медицине используются соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и др. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ). Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.
Карпенко Д.
ХФ ТюмГУ 561гр.
Источники:
Углерод // Википедия. Дата обновления: 18.01.2019. URL: https://ru.wikipedia.org/?oldid=97565890 (дата обращения: 04.02.2019).
Источник
147N + 10n = 146C + 11H.
Углерод расположен в группе IVA, во втором периоде периодической системы. Конфигурация внешнего электронного слоя атома в основном состоянии 2s2p2. Важнейшие степени окисления +2 +4, –4, валентности IV и II. Радиус нейтрального атома углерода 0, 077 нм. Радиус иона C4+ 0, 029 нм (координационное число 4), 0, 030 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома равны 11, 260, 24, 382, 47, 883, 64, 492 и 392, 09 эВ. Электроотрицательность по Полингу 2, 5.
Углерод известен с глубокой древности. Древесный уголь использовали для восстановления металлов из руд, алмаз — как драгоценный камень. В 1789 французский химик А.Л. Лавуазье сделал вывод об элементарной природе углерода. Искусственные алмазы впервые были получены в 1953 шведскими исследователями, но результаты они не успели опубликовать. В декабре 1954 искусственные алмазы получили, а в начале 1955 опубликовали результаты сотрудники компании «Дженерал электрик».
В СССР искусственные алмазы впервые были получены в 1960 группой ученых под руководством В. Н. Бакуля и Л. Ф. Верещагина. В 1961 группой советских химиков под руководством В. В. Коршака была синтезирована линейная модификация углерода — карбин. Вскоре карбин был обнаружен в метеоритном кратере Рис (Германия). В 1969 в СССР были синтезированы нитевидные кристаллы алмаза при обычном давлении, обладающие высокой прочностью и практически лишенные дефектов. В 1985 Г. Крото обнаружил новую форму углерода —фуллерены С60 и С70 в масс-спектре испаряемого при облучении лазером графита. При высоких давлениях получен лонсдейлит.
Содержание в земной коре 0, 48% по массе. Накапливается в биосфере: в живом веществе 18% угля, в древесине 50%, торфе 62%, природных горючих газах 75%, горючих сланцах 78%, каменном и буром угле 80%, нефти 85%, антраците 96%. Значительная часть угля литосферы сосредоточена в известняках и доломитах. Углерод в степени окисления +4 входит в состав карбонатных пород и минералов (мел, известняк, мрамор, доломиты). Углекислый газ CO2 (0, 046% по массе) постоянный компонент атмосферного воздуха. Углекислый газ в растворенном виде всегда присутствует в воде рек, озер и морей. В атмосфере звезд, планет и в метеоритах обнаружены вещества, содержащие углерод.
С древности уголь получали при неполном сгорании древесины. В 19 веке древесный уголь в металлургии заменили каменным углем (коксом). В настоящее время для промышленного получения чистого углерода используют крекинг природного газа метана СН4:
СН4 = С + 2Н2
Уголь для медицинских целей готовят сжиганием кожуры кокосовых орехов. Для лабораторных нужд чистый уголь, не содержащий несгораемых примесей, получают неполным сжиганием сахара.
Углерод — неметалл. Многообразие соединений углерода объясняется способностью его атомов связываться между собой, образуя объемные структуры, слои, цепи, циклы. Известны четыре аллотропические модификации углерода: алмаз, графит, карбин и фуллерит. Древесный уголь состоит из мельчайших кристалликов с неупорядоченной структурой графита. Его плотность 1, 8-2, 1 г/см3 . Сажа представляет собой сильно измельченный графит.
Алмаз — минерал с кубической гранецентрированной решеткой. Атомы С в алмазе находятся в sp3-гибридизованном состоянии. Каждый атом образует 4 ковалентные s-связи с четырьмя соседними атомами С, расположенными по вершинам тетраэдра, в центре которого находится атом С. Расстояния между атомами в тетраэдре 0, 154 нм. Электронная проводимость отсутствует, ширина запрещенной зоны 5, 7 эВ. Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объема. Его плотность 3, 51 г/см3.. Твердость по минералогической шкале Мооса принята за 10. Алмаз можно поцарапать только другим алмазом; но он хрупок и при ударе раскалывается на куски неправильной формы. Термодинамически устойчив лишь при высоких давлениях. Однако, при 1800 °C превращение алмаза в графит происходит быстро. Обратное превращение графита в алмаз происходит при 2700°C и давлении 11-12 ГПа.
Графит — слоистое темно-серое вещество с гексагональной кристаллической решеткой. Термодинамически устойчив в широком интервале температур и давлений. Состоит из параллельных слоев, образованных правильными шестиугольниками из атомов С. Углеродные атомы каждого слоя расположены против центров шестиугольников, находящихся в соседних слоях; положение слоев повторяется через один, а каждый слой сдвинут относительно другого в горизонтальном направлении на 0, 1418 нм. Внутри слоя связи между атомами ковалентные, образованы sp2-гибридными орбиталями. Связи между слоями осуществляются слабыми ван-дер-ваальсовыми силами, поэтому графит легко расслаивается. Такое состояние стабилизирует четвертая делокализованная π-связь. Графит обладает хорошей электрической проводимостью. Плотность графита 2, 1-2, 5 кг/дм3.
Во всех аллотропических модификациях при обычных условиях углерод химически малоактивен. В химические реакции вступает только при нагревании. При этом химическая активность углерода убывает в ряду сажа—древесный уголь—графит—алмаз. Сажа на воздухе воспламеняется при нагревании до 300°C, алмаз — при 850-1000°C. При горении образуется углекислый газ СО2 и CO. Нагревая СО2 с углем, также получают оксид углерода (II) CО:
СО2+ С = 2СО
С + Н2О (перегретый пар) = СО +Н2
Синтезирован оксид углерода С2О3. СО2 — кислотный оксид, ему отвечает слабая неустойчивая, существующая только в сильно разбавленных холодных водных растворах угольная кислота Н2СО3. Соли угольной кислоты — карбонаты (К2СО3, СаСО3) и гидрокарбонаты (NaHCO3, Са(НСО3)2).
С водородом графит и древесный уголь реагируют при температуре выше 1200°C, образуя смесь углеводородов. Реагируя со фтором при 900°C, образует смесь фторуглеродных соединений. Пропуская электрический разряд между угольными электродами в атмосфере азота, получают газ циан (CN)2; если в газовой смеси присутствует водород, образуется синильная кислота HCN. При очень высоких температурах графит реагирует с серой, кремнием, бором, образуя карбиды — CS2, SiC, В4С.
Карбиды получают взаимодействием графита с металлами при высоких температурах: карбид натрия Na2C2, карбид кальция CaC2, карбид магния Mg2C3, карбид алюминия Al4C3. Эти карбиды легко разлагаются водой на гидроксид металла и соответствующий углеводород:
Al4C3 + 12Н2О = 4Al(ОН)3 + 3СН4
С переходными металлами углерод образует металлоподобные химически стойкие карбиды, например, карбид железа (цементит) Fe3C, карбид хрома Cr2C3, карбид вольфрама WС. Карбиды — кристаллические вещества, природа химической связи может быть различной. При нагревании уголь восстанавливает многие металлы из их оксидов:
FeO + C = Fe + CO,
2CuO+ C = 2Cu+ CO2
При нагревании восстанавливает серу(VI) до серы(IV) из концентрированной серной кислотой:
2H2SO4+ C = CO2+ 2SO2+ 2H2O
При 3500°C и нормальном давлении углерод сублимирует.
Свыше 90% всех первичных источников потребляемой в мире энергии приходится на органическое топливо. 10% добываемого топлива используется в качестве сырья для основного органического и нефтехимического синтеза, для получения пластмасс.
Углерод — важнейший биогенный элемент, является структурной единицей органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, витамины, гормоны, медиаторы и другие). Содержание углерода в живых организмах в расчете на сухое вещество составляет 34, 5-40% у водных растений и животных, 45, 4-46, 5% у наземных растений и животных и 54% у бактерий. В процессе жизнедеятельности организмов происходит окислительный распад органических соединений с выделением во внешнюю среду CO2. Углекислый газ, растворенный в биологических жидкостях и природных водах, участвует в поддержании оптимальной для жизнедеятельности кислотности среды. В составе CaCO3 углерод образует наружный скелет многих беспозвоночных, содержится в кораллах, яичной скорлупе. При различных производственных процессах частицы угля, сажи, графита, алмаза попадают в атмосферу и находятся в ней в виде аэрозолей. ПДК для углеродной пыли в рабочих помещениях 4, 0 мг/м3, для каменного угля 10 мг/м3.
- Сюняев З. И. Нефтяной углерод. М., 1980.
- Химия гиперкоординированного углерода. М., 1990.
- Углерод в лесном фонде и сельскохозяйственных угодьях России. – Москва: Товарищество научных изданий КМК, 2005.
- Морган Ричард. Видоизмененный углерод. – М.: АСТ: Люкс, 2005.
- Углерод: минералогия, геохимия и космохимия. – Сыктывкар: Геопринт, 2003.
- Фиалков А. С. Углерод, межслоевые соединения и композиты на его основе. – М.: Аспект-пресс, 1997.
- Фенелонов В. Б. Пористый углерод. – Новосибирск: Ин-т катализа, 1995.
Источник

