Какие есть химические свойства неметаллов

В химических реакциях неметаллы могут проявить себя и как восстановители, и как окислители. Из общих химических свойств неметаллов отметим их способность взаимодействовать с металлами, с водородом и кислородом.
Взаимодействие неметаллов с металлами
В реакциях с металлами неметаллы проявляют себя как окислители.
А. Особенно активно с металлами взаимодействуют галогены. В результате реакций соединения образуются соли — галогениды.
Например, при взаимодействии алюминия с иодом образуется иодид алюминия AlI3 :
2Al0+3I20⟶H2O2Al+3I3−1.
Вода в этой химической реакции является катализатором.
Видеофрагмент:
Взаимодействие алюминия с иодом
Железо активно реагирует с хлором, образуя хлорид железа((III)) FeCl3:
2Fe0+3Cl20⟶to2Fe+3Cl3−1.
Видеофрагмент:
Взаимодействие железа с хлором
Б. Металлы реагируют с серой, образуя сульфиды.
Реакция соединения алюминия с серой начинается после того, как смесь веществ нагрели. Продуктом реакции является сульфид алюминия AlS32:
2Al0+3S0⟶toAl2+3S3−2.
Видеофрагмент:
Взаимодействие алюминия с серой
Химическое взаимодействие между натрием и серой протекает при простом механическом смешивании. В результате образуется сульфид натрия NaS2:
2Na0+S0→Na2+1S−2.
Видеофрагмент:
Взаимодействие натрия с серой
Взаимодействие неметаллов с водородом
По сравнению с другими неметаллами водород имеет невысокую электроотрицательность. В силу этой причины в реакциях с другими неметаллами, как правило, данный химический элемент будет восстановителем, а другие неметаллы — окислителями.
В таких реакциях образуются летучие водородные соединения, состав молекул которых отвечает общей формуле RHx, где (R) — неметалл, а (х) — индекс, указывающий число атомов водорода в молекуле образовавшегося вещества. Этот индекс численно совпадает с валентностью неметалла, с которым водород соединяется.
Например, в реакции соединения водорода с хлором образуется газ хлороводород (HCl):
H20+Cl20⟶to2H+1Cl−1.
Видеофрагмент:
Взаимодействие водорода с хлором
Взаимодействие водорода с азотом происходит при выcокой температуре и давлении. В промышленности для ускорения данного процесса используют катализатор. Продуктом взаимодействия этих двух неметаллических веществ является газ аммиак NH3:
N20+3H20⇄to,p2N−3H3+1.
Взаимодействие неметаллов с кислородом
Кислород имеет высокую электроотрицательность, поэтому в реакциях с другими неметаллами он является окислителем, а другие неметаллы — восстановителями.
В результате соединения кислорода с другими неметаллами образуются оксиды.
Например, сера сгорает в кислороде, образуя сернистый газ или оксид серы((IV)) SO2:
S0+O20→S+4O2−2.
Фосфор энергично cгорает в кислороде ярким пламенем. В ходе реакции образуются белые клубы оксида фосфора((V)) PO52:
4P0+5O20→2P2+5O5−2.
Видеофрагмент:
Горение фосфора в кислороде
В то же самое время взаимодействие кислорода с химически малоактивным азотом протекает медленно и начинается только при очень высокой температуре. Продуктом реакции является газообразный оксид азота((II)) NO:
N20+O20⟶to2N+2O−2.
Такая химическая реакция протекает в атмосфере при разряде молнии, а также в цилиндрах двигателей при сгорании топлива.
Источник
Атомы неметаллов, а также простые вещества, образованные неметаллами, могут проявлять, как окислительные, так и восстановительные свойства – всё зависит от того, с какими веществами неметаллы вступают в реакцию.
Окислительные свойства неметаллов проявляются при их взаимодействии:
- с металлами:
- Подгруппа углерода (IV):
- Общая схема реакций:
Me+C → карбиды;
Me+Si → силициды - Примеры:
4Al0+3C0=Al4+3C3-4
- Общая схема реакций:
- Подгруппа азота (V):
- Общая схема реакций:
Me+N → нитриды;
Me+P → фосфиды - Примеры:
2Al0+N20=2Al+3N-3
- Общая схема реакций:
- Халькогены(VI):
- Общая схема реакций:
Me+O2 → оксиды;
Me+S → сульфиды
Me+Se → селениды;
Me+Te → теллуриды - Примеры:
4Al0+3O20=2Al2+3O3-2
- Общая схема реакций:
- Галогены (VII):
- Общая схема реакций:
Me+F2 → фториды;
Me+Cl2 → хлориды
Me+Br2 → бромиды;
Me+I2 → йодиды - Примеры:
2Al0+3F20=2Al+3F3-1
- Общая схема реакций:
- Подгруппа углерода (IV):
- с водородом с образованием летучих водородных соединений:
H20+S0 ↔ H2+1S-2 – сероводород
H20+Cl20 ↔ 2H+1Cl-1 – хлороводород
3H20+N20 ↔ 2N-3H3+1 – аммиак - с другими неметаллами, у которых более низкая электроотрицательность (см. таблицу электроотрицательности) – фтор самый сильный окислитель из всех неметаллов, т.к. имеет самую высокую электроотрицательность:
2P0+5S0=P2+5S5-2
H20+F20=2H+1F-1 - с некоторыми сложными веществами:
- кислород при взаимодействии со сложными веществами выступает в роли окислителя:
C-4H4+2O20 → C+4O2-2+2H2O-2;
2S+4O2+O20 → 2S+6O3-2 - хлор окисляет хлорид железа (II в III):
2Fe+2Cl2-1+Cl20 = 2Fe+3Cl3-1 - хлор вытесняет йод в свободном виде из раствора йодида калия:
2K+1I-1+Cl20 = K+1Cl-1+I20 - реакция галогенирования метана:
C-4H4+Cl20 → C-2H3Cl-1+HCl-1
- кислород при взаимодействии со сложными веществами выступает в роли окислителя:
Восстановительные свойства неметаллов проявляются при их взаимодействии:
- по отношению к фтору все неметаллы проявляют восстановительные свойства;
- все неметаллы, кроме фтора, являются восстановителями при реакции с кислородом, образуя оксиды неметаллов:
S0+O20 → S+4O2-2
N20+O20 → 2N+2O-2
C0+O20 → C+4O2-2 - многие неметаллы выступают в роли восстановителя в реакциях со сложными веществами-окислителями:
H20+Cu+2O → Cu0+H2+1O
6P0+5KCl+5O3 → 5KCl-1+3P2+5O5
C0+4HN+5O3 → C+4O2↑+4N+4O2+2H2O
В некоторых реакциях один и тот же неметалл выступает и в роли окислителя, и в роли восстановителя – такие реакции носят название диспропорционирования:
- Cl20+H2O ↔ HCl-1+HCl+1O
- 3S0+6NaOH = 2Na2S-2+Na2S+4O3+3H2O
- 3Cl20+6KOH = 5KCl-1+KCl+5O3+3H2O
Оксиды неметаллов
- несолеобразующие оксиды: SiO, N2O, NO, CO;
- солеобразующие оксиды (кислотные оксиды) – все остальные оксиды неметаллов:
- газы: SO2, CO2, NO2 и др.;
- жидкости: SO3, N2O3 и др.;
- твердые в-ва: P2O5, SiO2 (единственный расвторимый в воде кислотный оксид).
Кислотные оксиды являются ангидридами кислот, например, P2O5 является ангидридом кислоты H3PO4.
При растворении в воде кислотных оксидов образуются гидроксиды, являющиеся кислотами:
N2+5O5+H2O = 2HN+5O3
В случае, если неметалл образует несколько кислородсодержащих кислот, то с увеличением степени окисления неметалла увеличивается и сила кислоты:
H2S+4O3
H2S+6O4
Вторая кислота более сильная
Водородные соединения неметаллов
| Группы | IV | V | VI | VII |
|---|---|---|---|---|
| Общие формулы водородных соед-й | ЭН4 | ЭН3 | ЭН2 | ЭН |
| 2 период | CH4 метан | NH3 аммиак | H2O вода | HF фторо- водород |
| 3 период | SiH4 силан | PH3 фосфин | H2S серо- водород | HCl хлоро- водород |
| 4 период | AsH3 арсин | H2Se селено- водород | HBr бромо- водород | |
| 5 период | H2Te теллуро- водород | HI йодо- водород |
Все водородные соединения неметаллов образованы ковалентными связями, имеют молекулярное строение и являются газами при н.у. (за исключением воды).
Кислотные свойства водородных соединений, образованных неметаллами, в одном периоде увеличиваются с возрастанием группы неметалла (HCl более сильная кислота, чем PH3). Это обстоятельство объясняется увеличением полярности связи неметалл-водород.
Если брать кислотно-основные свойства в группах, то, кислотные свойства будут увеличиваться с увеличением периода – HF является самой слабой кислотой в VII группе, а HI – самой сильной. Это обстоятельство объясняется снижением прочности связи неметалл-водород по причине ее удлинения.
В заключение осталось сказать как ведут себя водородные соединения неметаллов в реакциях с водой:
- Метан и силан плохо растворяются в воде;
- Аммиак и фосфин, взаимодействуя с водой, образуют гидроксид аммония и гидроксид фосфония, являющиеся слабыми основаниями;
- Сероводород, селеноводород, теллуроводород и все галогеноводороды (от фтороводорода до йодоводорода) – образуют кислоты той же формулы, что и сами водородные соединения.
И последнее – водородные соединения неметаллов в окислительно-восстановительных реакциях всегда являются восстановителями, поскольку здесь неметаллы имеют низшую степень окисления.
См. далее: Физические свойства неметаллов.
Источник
1. Галогены
1) С кислородом из галогенов реагирует только фтор:
F2 + O2 → O2F2 (или OF2)
Cl2 + O2 → реакция не идет.
2) С водой реагируют все галогены, но по-разному: фтор окисляет воду, другие галогены диспропорционируют в ней:
2F2 + 2H2O → 4HF + O2
Cl2 + H2O → HCl + HClO
3) Все галогены взаимодействуют с водородом:
H2 + F2 → 2HF
H2 + Cl2 → 2HCl
H2 + Br2 → 2HBr
4) Из солей галогены реагируют: 1) с галогенидами (если галоген в простом веществе является более сильным окислителем, чем галоген в соли) и 2) с сульфидами:
Cl2 + CaBr2 → CaCl2 + Br2
Cl2 + CaF2 → реакция не идет, так как Cl2 обладает менее выраженными окислительными свойствами, чем F2.
С сульфидами:
Br2 + Na2S → 2NaBr + S.
Если можем окислить металл:
Cl2 + 2FeCl2 → 2FeCl3
5) Все галогены реагируют с металлами:
3F2 + 2Fe → 2FeF3
3Br2 + 2Fe → 2FeBr3
Cl2 + Cu → CuCl2
Окислительный свойства йода выражены слабее, чем у других галогенов, поэтому с такими металлами, как Fe и Cu, он взаимодействует по-другому:
I2 + Fe → FeI2
I2 + 2Cu – > 2CuI
6) Галогены – сильные окислители, окисляют такие сложные вещества, как H2S, H2O2, NH3, SO2 и др:
Br2 + H2S → S + 2HBr
H2O2 + Cl2 → 2HCl + O2
3Cl2 + 8NH3 → N2 + 6NH4Cl
Cl2 + 2FeCl2 → 2FeCl3
7) Не реагируют с оксидами
8) Не реагируют с кислотами за исключением одной реакции (только I2 и только с концентрированной азотной кислотой):
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t)
9) Диспропорционируют в растворах щелочей:
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2. Сера (желтое вещество, плавает на поверхности воды, не смачиваясь ею)
1) реагирует с кислородом:
S + O2 → SO2
2) Реагирует с водородом:
S + H2 <=> H2S
3) Реагирует с металлами
S + Fe → FeS (t)
2Na + S → Na2S
4) Реагирует со всеми неметаллами, кроме N2, I2 и благородных газов:
S + N2 → реакция не идет
S + I2 → реакция не идет
5S + 2P → P2S5
2S + C → CS2
S + 3F2 → SF6
S + Br2 → SBr2
5) Реагирует с кислотами-окислителями:
S + 6HNO3(конц.)  → H2SO4 + 6NO2 + 2H2O
S + 2HNO3(разб.) → H2SO4 + 2NO
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
3. Азот (прочная тройная связь)
Реагирует только с O2, H2, F2 (со фтором реакции на ЕГЭ не встречаются) и металлами.
1) Реагирует с кислородом (электрический разряд или 2000ºС)
N2 + O2 → 2NO
2) Реагирует с водородом (обратимая, экзотермическая реакция):
N2 + 3H2 <=> 2NH3
3) Реагирует с металлами с образованием нитридов (с Li без нагревания, с остальными – только при нагревании):
N2 + 2Al → 2AlN (t)
N2 + 3Mg → Mg3N2 (t)
4) Не реагирует с H2O, кислотами, оксидами, солями.
4. Фосфор
Основные аллотропные модификации: красный (атомная кристаллическая решетка) и белый (P4, молекулярная кристаллическая решетка). Белый фосфор – ядовитое вещество, самовоспламеняется на воздухе. Красный фосфор стабилен и ядовитым не является.
1) Реагирует с кислородом:
4P + 3O2 → 2P2O3 (недостаток O2)
4P + 5O2 → 2P2O5 (избыток O2)
2) Не реагирует с водородом:
P + H2 → реакция не идет.
3) Диспропорционирует в растворах щелочей:
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
4) Реагирует с кислотами-окислителями:
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
5HNO3(разб.) + 3P +2H2O → 3H3PO4 + 5NO
5) Окисляется сильными окислителями:
6P + 5KClO3 → 3P2O5 + 5KCl
6) Реагирует с металлами с образованием фосфидов:
P + Na → Na3P
2P + 3Ca → Ca3P2
7) Реагирует с серой, галогенами:
2P + 3Cl2  → 2PCl3 (недостаток Cl2)
2P + 5Cl2 → 2PCl5 (избыток Cl2)
2P + 3I2 → 2PI3 (с I2 возможно только образованием PI3, PI5 не образуется)
8) Реагирует с соединениями P+5:
3PCl5 + 2P → 5PCl3
5. Углерод
1) Реагирует с кислородом:
C + O2 → CO2
2) Реагирует с водородом:
С + 2H2 → CH4
3) Реагирует с кислотами-окислителями:
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)
C + 4HNO3(конц.)  → CO2 + 4NO2 + 2H2O (t)
4) Используется при получении фосфора:
Ca3(PO4)2 + 5C + 3SiO2 → 5CO + 2P + 3CaSiO3
6. Кремний
1) Реагирует с кислородом:
Si + O2 → SiO2 (кварц, песок)
2) Не реагирует с водородом:
Si + H2 → реакция не идет.
3) Растворяется в щелочах:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
4) Не реагирует с растворами кислот. Реагирует только с HF:
Si + 4HF → SiF4 + 2H2 (t).
Источник
Неметаллы – химические элементы, которые имеют типичные неметаллические свойства и располагаются в правом верхнем углу Периодической системы. Какие же свойства присущи этим элементам, и с чем реагируют неметаллы?

Неметаллы: общая характеристика
Неметаллы отличаются от металлов тем, что на внешнем энергетическом уровне они имеют большее количество электронов. Поэтому их окислительные свойства выражены сильнее, чем у металлов. Неметаллы характеризуются высокими значениями электроотрицательности и высокий восстановительный потенциал.
К неметаллам относятся химические элементы, которые находятся в газообразном, жидком или твердом агрегатном состоянии. Так, например, азот, кислород, фтор, хлор, водород – газы; йод, сера, фосфор – твердые; бром – жидкость (при комнатной температуре). Всего существует 22 неметалла.

Рис. 1. Неметаллы – газы, твердые, жидкости.
С увеличением заряда ядра атома наблюдается закономерность изменения свойств химических элементов от металлических к неметаллическим.
Химические свойства неметаллов
Водородные свойства неметаллов в основном являются летучими соединениями, которые в водных растворах имеют кислотный характер. Они имеют молекулярные структуры, а также ковалентную полярную связь. Некоторые, например, вода, аммиак или фтороводород образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Пример:
S+H2 =H2S (до 350 градусов равновесие смещено вправо)
Все водородные соединения имеют восстановительные свойства, причем их восстановительная сила возрастает справа налево по периоду и сверху вниз в группе. Так, сероводород сгорает при большом количестве кислорода:
2H2 S+3O3 =2SO2 +2H2 O+1158 кДж.
Окисление может идти по другому пути. Так, уже на воздухе водный раствор сероводорода мутнеет в результате образования серы:
H2 S+3O2 =2S+2H2O
Соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты (оксокислоты). Структура оксидов типичных неметаллов молекулярная.
Чем выше степень окисления неметалла, тем сильнее соответствующая кислородосодержащая кислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Наиболее известны такие соли этих кислот, как хлорная известь CaOCl2 (смешанная соль хлорноватистой и хлороводородной кислот), бертолетова соль KClO3 (хлорат калия).
Азот в оксидах проявляет положительные степени окисления +1, +2, +3, +4, +5. Первые два оксида N2O и NO – несолеобразующие и являются газами. N2O3 (оксид азота III) – является ангидридом азотистой кислоты HNO2 . Оксид азота IV – бурый газ NO2 – газ, который хорошо растворяется в воде, образуя при этом две кислоты. Этот процесс можно выразить уравнением:
2NO2 +H2 O=HNO3 (азотная кислота)+HNO2 (азотистая кислота) – окислительно-восстановительная реакция диспропорционирования

Рис. 2. Азотистая кислота.
Ангидрид азотной кислоты N2O5 – белое кристаллическое вещество, которое легко растворяется в воде. Пример:
N2O5 +H2O=2HNO3
Соли азотной кислоты называются селитрами, они растворимы в воде. Соли калия, кальция, натрия используют для получения азотных удобрений.
Фосфор образует оксиды, проявляя степени окисления +3 и +5. Наиболее устойчивый оксид – фосфорный ангидрид P2O5 , образующий молекулярную решетку, в узлах которой находятся димеры P4O10 . Соли ортофосфорной кислоты применяются в качестве фосфорных удобрений, например, аммофос NH4 H2 PO4 (дигидрофосфат аммония).
Таблица расположения неметаллов
| Группа | I | III | IV | V | VI | VII | VIII |
| Первый период | H | He | |||||
| Второй период | B | C | N | O | F | Ne | |
| Третий период | Si | P | S | Cl | Ar | ||
| Четвертый период | As | Se | Br | Kr | |||
| Пятый период | Te | I | Xe | ||||
| Шестой период | At | Rn |
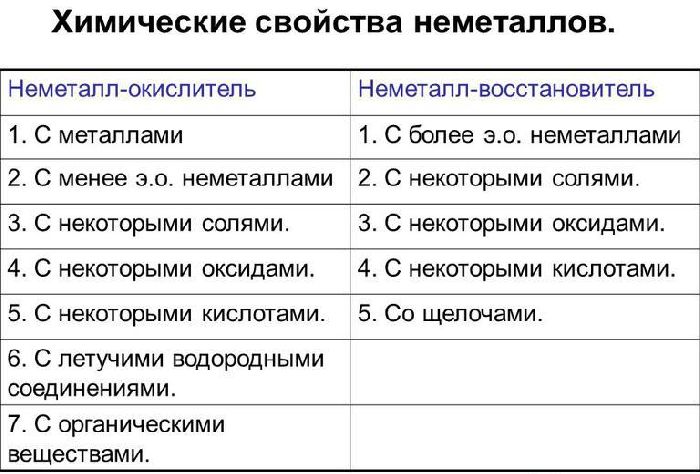
Рис. 3. Таблица химические свойства неметаллов.
Что мы узнали?
В школьной программе по химии (8-9 класс) большое внимание уделяется изучению общих свойств неметаллов. В данной статье изучается информация, чем отличаются металлы от неметаллов, и какими особенностями они обладают. Также приведена таблица химических свойств неметалов.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Лидия Маслова
9/9
Оценка доклада
Средняя оценка: 4. Всего получено оценок: 314.
Источник
I. Элементы. Неметаллы образуют p-элементы, а также водород и гелий, являющиеся s-элементами. В длиннопериодной таблице p-элементы, образующие неметаллы, располагаются правее и выше условной границы B – At.
II. Атомы. Атомы неметаллов маленькие (орбитальный радиус меньше 0,1 нм). У большинства из них от четырех до восьми валентных электронов (они же внешние), но у атома водорода – один, у атома гелия – два, а у атома бора – три валентных электрона. Атомы неметаллов сравнительно легко присоединяют чужие электроны (но не более трех). Склонностью отдавать электроны атомы неметаллов не обладают.
У атомов элементов-неметаллов в периоде с увеличением порядкового номера
- заряд ядра увеличивается;
- радиусы атомов уменьшаются;
- число электронов на внешнем слое увеличивается;
- число валентных электронов увеличивается;
- электроотрицательность увеличивается;
- окислительные (неметаллические) свойства усиливаются (кроме элементов VIIIA группы).
У атомов элементов-неметаллов в подгруппе (в длиннопериодной таблице – в группе) с увеличением порядкового номера
- заряд ядра увеличивается;
- радиус атома увеличивается;
- электроотрицательность уменьшается;
- число валентных электронов не изменяется;
- число внешних электронов не изменяется (за исключением водорода и гелия);
- окислительные (неметаллические) свойства ослабевают (кроме элементов VIIIA группы).
III. Простые вещества. Большинство неметаллов – простые вещества, в которых атомы связаны ковалентными связями; в благородных газах химических связей нет. Среди неметаллов есть как молекулярные, так и немолекулярные вещества. Все это приводит к тому, что физических свойств, характерных для всех неметаллов, нет.
Молекулярные неметаллы: H2, N2, P4 (белый фосфор), As4, O2, O3, S8, F2, Cl2, Br2, I2. К ним же можно отнести и благородные газы (He, Ne, Ar, Kr, Kx, Rn), атомы которых являются как бы “одноатомными молекулами”.
При комнатной температуре водород, азот, кислород, озон, фтор и хлор – газы; бром – жидкость; фосфор, мышьяк, сера и йод – твердые вещества.
Немолекулярные неметаллы: B (несколько аллотропных модификаций), C(графит), C(алмаз), Si, Ge, P(красный), P(черный), As, Se, Te. Все они твердые вещества, кремний, германий, селен и некоторые другие обладают полупроводниковыми свойствами.
IV. Химические свойства. Характерными для большинства неметаллов являются окислительные свойства. Как окислители они реагируют с металлами:
| Ca + Cl2 = CaCl2 | 4Li + O2 = 2Li2O | 2Na + S = Na2S |
с менее электротрицательными неметаллами:
| H2 + S = H2S | P4 + 5O2 = 2P2O5 | 2P + 5Cl2 = 2PCl5 |
со сложными веществами:
| 2FeCl2 + Cl2 = 2FeCl3 | CH4 + Br2 = CH3Br + HBr |
Менее характерны для неметаллов восстановительные свойства. Как восстановители они реагируют с более электротрицательными неметаллами:
| Si + 2F2 = SiF4 | C + O2 = CO2 | C + 2S = CS2 |
со сложными веществами:
| H2 + HCHO = CH3OH | 6P + 5KClO3 = 5KCl + 3P2O5 |
V. Водородные соединения. Все неметаллы (кроме элементов благородных газов) образуют молекулярные водородные соединения, причем углерод и бор – очень много. Простейшие водородные соединения:
| B2H6 диборан | CH4 метан | NH3 аммиак | H2O вода | HF фтороводород |
| SiH4 силан | PH3 фосфин | H2S сероводород | HCl хлороводород | |
| GeH4 герман | AsH3 арсин | H2Se селеноводород | HBr бромоводород | |
| H2Te теллуроводород | HI йодоводород | |||
Все он газы за исключением воды. Вещества, выделенные жирным шрифтом, в водном растворе – сильные кислоты.
В группе с увеличением порядкового номера их устойчивость снижается, а восстановительная активность возрастает.
В периоде с увеличением порядкового номера усиливаются кислотные свойства их растворов, в группе эти свойства ослабевают.
VI. Оксиды и гидроксиды. Все оксиды неметаллов относятся к кислотным или несолеобразующим. Несолеобразующие оксиды: CO, SiO, N2O, NO.
Высшим оксидам неметаллов соответствуют следующие кислоты (сильные кислоты выделены жирным шрифтом)
| H3BO3 борная кислота | H2CO3 угольная кислота | HNO3 азотная кислота | – | – |
| H2SiO3 кремниевая кислота | H3PO4 ортофосфорная кислота | H2SO4 серная кислота | HClO4 хлорная кислота | |
| H3AsO4 мышьяковая кислота | H2SeO4 селеновая кислота | HBrO4 бромная кислота | ||
| H6TeO6 ортотеллуровая кислота | HIO4 йодная кислота | |||
В периоде с возрастанием порядкового номера сила высших кислот увеличивается. В группах выраженной зависимости нет.
Задачи и тесты по теме “Тема 13. “Неметаллы”.”
Источник
