Какие есть свойства неорганических соединений

Ежедневно человек взаимодействует с большим количеством предметов. Они изготовлены из разных материалов, имеют свою структуру и состав. Все, что окружает человека можно разделить на органическое и неорганическое. В статье рассмотрим, что представляют собой такие вещества, приведем примеры. Также определим, какие встречаются неорганические вещества в биологии.
Описание
Неорганическими называются такие вещества, в составе которых нет углерода. Они противоположны органическим. Также к этой группе относят несколько углеродосодержащих соединений, например:
- цианиды;
- оксиды углерода;
- карбонаты;
- карбиды и другие.
Примеры неорганических веществ:
- вода;
- разные кислоты (соляная, азотная, серная);
- соль;
- аммиак;
- углекислый газ;
- металлы и неметаллы.
Неорганическая группа отличается отсутствием углеродного скелета, который характерен для органических веществ. Неорганические вещества по составу принято делить на простые и сложные. Простые вещества составляют немногочисленную группу. Всего их насчитывается примерно 400.

Простые неорганические соединения: металлы
Металлы – простые вещества, соединение атомов которых основывается на металлической связи. Эти элементы имеют характерные металлические свойства: теплопроводность, электропроводность, пластичность, блеск и другие. Всего в этой группе выделяют 96 элементов. К ним относятся:
- щелочные металлы: литий, натрий, калий;
- щелочноземельные металлы: магний, стронций, кальций;
- переходные металлы: медь, серебро, золото;
- легкие металлы: алюминий, олово, свинец;
- полуметаллы: полоний, московий, нихоний;
- лантаноиды и лантан: скандий, иттрий;
- актиноиды и актиний: уран, нептуний, плутоний.
В основном в природе металлы встречаются в виде руды и соединений. Чтобы получить чистый металл без примесей, проводится его очистка. При необходимости возможно проведение легирования или другой обработки. Этим занимается специальная наука – металлургия. Она подразделяется на черную и цветную.

Простые неорганические соединения: неметаллы
Неметаллы – химические элементы, которые не обладают металлическими свойствами. Примеры неорганических веществ:
- вода;
- азот;
- сера;
- кислород и другие.
Неметаллы отличаются большим числом электронов на внешнем энергетическом уровне их атома. Это обуславливает некоторые свойства: повышается способность присоединять дополнительные электроны, проявляется более высокая окислительная активность.
В природе можно встретить неметаллы в свободном состоянии: кислород, хлор, фтор, водород. А также твердые формы: йод, фосфор, кремний, селен.
Некоторые неметаллы имеют отличительное свойство – аллотропию. То есть они могут существовать в различных модификациях и формах. Например:
- газообразный кислород имеет модификации: кислород и озон;
- твердый углерод может существовать в таких формах: алмаз, графит, стеклоуглерод и другие.

Сложные неорганические соединения
Эта группа веществ более многочисленна. Сложные соединения отличаются наличием в составе вещества нескольких химических элементов.
Рассмотрим подробнее сложные неорганические вещества. Примеры и классификация их представлены ниже в статье.
1. Оксиды – соединения, одним их элементов которых является кислород. В группу входят:
- несолеобразующие (например, монооксид углерода, оксид азота);
- солеобразующие оксиды (например, оксид натрия, оксид цинка).
2. Кислоты – вещества, в состав которых входят ионы водорода и кислотные остатки. Например, азотная кислота, серная кислота, сероводород.
3. Гидроксиды – соединения, в составе которых присутствует группа –ОН. Классификация:
- основания – растворимые и нерастворимые щелочи – гидроксид меди, гидроксид натрия;
- кислородосодержащие кислоты – диводород триоксокарбонат, водород триоксонитрат;
- амфотерные – гидроксид хрома, гидроксид меди.
4. Соли – вещества, в составе которых есть ионы металла и кислотные остатки. Классификация:
- средние: хлорид натрия, сульфид железа;
- кислые: гидрокарбонат натрия, гидросульфаты;
- основные: нитрат дигидроксохрома, нитрат гидроксохрома;
- комплексные: тетрагидроксоцинкат натрия, тетрахлороплатинат калия;
- двойные: алюмокалиевые квасцы;
- смешанные: сульфат алюминия калия, хлорид меди калия.
5. Бинарные соединения – вещества, состоящие из двух химических элементов:
- бескислородные кислоты;
- бескислородные соли и другие.

Неорганические соединения, содержащие углерод
Такие вещества традиционно относятся к группе неорганических. Примеры веществ:
- Карбонаты – эфиры и соли угольной кислоты – кальцит, доломит.
- Карбиды – соединения неметаллов и металлов с углеродом – карбид бериллия, карбид кальция.
- Цианиды – соли цианистоводородной кислоты – цианид натрия.
- Оксиды углерода – бинарное соединение углерода и кислорода – угарный и углекислый газы.
- Цианаты – являются производными от циановой кислоты – фульминовая кислота, изоциановая кислота.
- Карбонильные металлы – комплекс металла и монооксида углерода – карбонил никеля.

Свойства неорганических веществ
Все рассмотренные вещества отличаются индивидуальными химическими и физическими свойствами. В общем виде можно выделить отличительные черты каждого класса неорганических веществ:
1. Простые металлы:
- высокая тепло- и электропроводность;
- металлический блеск;
- отсутствие прозрачности;
- прочность и пластичность;
- при комнатной температуре сохраняют твердость и форму (кроме ртути).
2. Простые неметаллы:
- простые неметаллы могут быть в газообразном состоянии: водород, кислород, хлор;
- в жидком состоянии встречается бром;
- твердые неметаллы имеют немолекулярное состояние и могут образовывать кристаллы: алмаз, кремний, графит.
3. Сложные вещества:
- оксиды: вступают в реакцию с водой, кислотами и кислотными оксидами;
- кислоты: вступают в реакцию с водой, основными оксидами и щелочами;
- амфотерные оксиды: могут вступать в реакции с кислотными оксидами и основаниями;
- гидроксиды: растворяются в воде, имеют широкий диапазон температур плавления, могут менять цвет при взаимодействии с щелочами.
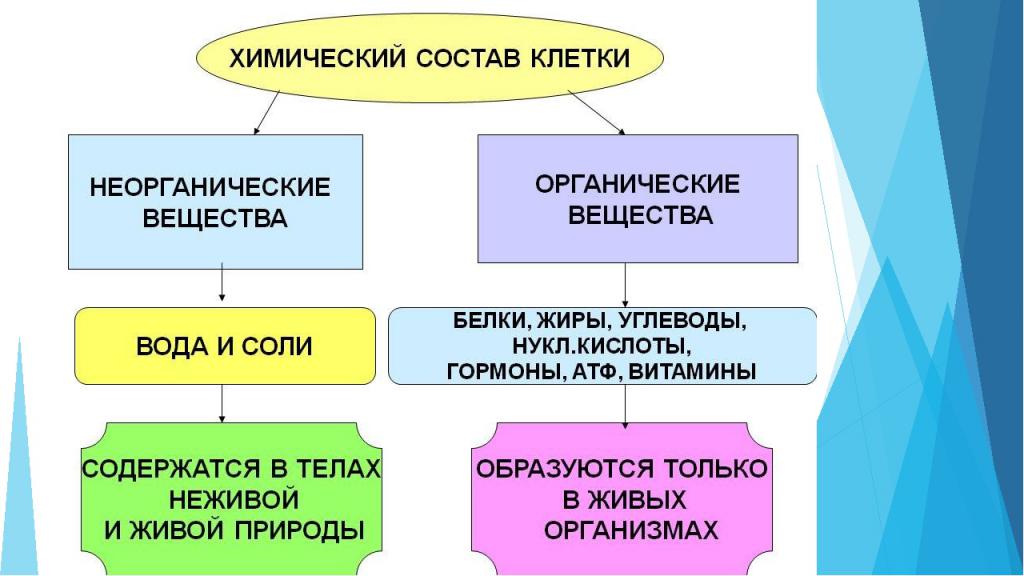
Органические и неорганические вещества клетки
Клетка любого живого организма состоит из множества компонентов. Некоторыми из них являются неорганические соединения:
- Вода. Например, количество воды в клетке составляет от 65 до 95%. Она необходима для осуществления химических реакций, перемещения компонентов, процесса терморегуляции. Также именно вода определяет объем клетки и степень ее упругости.
- Минеральные соли. Могут присутствовать в организме как в растворенном виде, так и в нерастворенном. Важную роль в процессах клетки играют катионы: калий, натрий, кальций, магний – и анионы: хлор, гидрокарбонаты, суперфосфат. Минералы необходимы для поддержания осмотического равновесия, регуляции биохимических и физических процессов, образования нервных импульсов, поддержания уровня свертываемости крови и многих других реакций.
Для поддержания жизнедеятельности важны не только неорганические вещества клетки. Органические компоненты занимают 20-30 % ее объема.
Классификация:
- простые органические вещества: глюкоза, аминокислоты, жирные кислоты;
- сложные органические вещества: белки, нуклеиновые кислоты, липиды, полисахариды.
Органические компоненты необходимы для выполнения защитной, энергетической функции клетки, они служат источником энергии для клеточной активности и запасают питательные вещества, проводят синтез белков, передают наследственную информацию.
В статье были рассмотрены сущность и примеры неорганических веществ, их роль в составе клетки. Можно сказать, что существование живых организмов было бы невозможным без групп органических и неорганических соединений. Они важны в каждой сфере человеческой жизни, а также в существовании каждого организма.
Источник
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение – SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH - Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O
(Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Источник

Неорганические вещества классифицируют по различным классифицирующим признакам. По химическому составу их делят на простые и сложные.
Простыми называют вещества, которые образуют атомы одного и того же химического элемента; сложными — вещества, которые образуют атомы двух и более химических элементов.
Простые вещества делят на металлы и неметаллы.
Металлами называют простые вещества, которые обладают характерными металлическими свойствами, а именно высокой электро- и теплопроводностью и металлическим блеском.
Простые вещества, которые образуют атомы элементов-неметаллов, при нормальных условиях такими свойствами не обладают.
В Периодической таблице Д. И. Менделеева неметаллы расположены в главных подгруппах справа вверху от условной диагонали, проведенной через бор и астат. В главных подгруппах слева от этой диагонали и во всех побочных подгруппах располагаются металлы.
Оксидами называют класс химических соединений, состоящий из какого-либо элемента и кислорода со степенью окисления –2.
Оксиды классифицируют так.
Несолеобразующими, или безразличными, называют оксиды, не проявляющие ни оснОвные, ни кислотные свойства, например N2O, NO, CO.
Солеобразующими называют группу кислотных, основных и амфотерных оксидов.
Кислотные оксиды образуют неметаллы и некоторые металлы в высших степенях окисления. Примеры кислотных оксидов: CO2, SiO2, N2O3, NO2, N2O5, P2O3, P2O5, SO2, SO3, Cl2O5, Cl2O7, CrO3, Mn2O7.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями с образованием солей и воды или кислых солей, а также с водой в том случае, если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Основные оксиды образуют металлы в низших степенях окисления. Наиболее известные из них: Li2O, Na2O, K2O, MgO, CaO, BaO, HgO, Ag2O.
Их характерные свойства: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
Амфотерными называют оксиды, которые проявляют как основные, так и кислотные свойства в зависимости от другого реагента. Наиболее известные амфотерные оксиды Al2O3, Cr2O3, ZnO, BeO, PbO, SnO. Ряд оксидов, например CuО, Fe2O3, проявляет амфотерные свойства с преобладанием основных.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
С водой амфотерные оксиды не взаимодействуют.
Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы.
Число гидроксильных групп определяет кислотность основания.
Щелочами называют растворимые в воде основания.
Сильные основания: гидроксиды щелочных и щелочноземельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Слабые основания: все нерастворимые в воде гидроксиды металлов и гидрат аммиака.
Все основания легко реагируют с кислотами (реакция нейтрализации) и кислотными оксидами с образованием солей и воды:
Основания могут вступать в реакцию с кислыми солями:
Щелочи при сплавлении с амфотерными оксидами дают соль и воду:
Щелочи могут вступать в реакции обмена с солями, если в результате этой реакции образуется осадок, например:
Нерастворимые в воде основания, а также гидроксид лития при нагревании разлагаются на оксид и воду:
Кислотами называют класс химических соединений, которые содержат в своем составе один или несколько катионов водорода, способных замещаться на атомы металлов, и анионов кислотных остатков.
Неорганическими кислотами называют вещества, молекулы которых при электролитической диссоциации в водной среде отщепляют протоны, в результате чего в растворе образуются гидроксоний-катионы Н3О+ и анионы кислотных остатков А–:
Исключение составляет борная кислота В(ОН)3, которая акцептирует гидроксид-ионы ОН–, в результате чего в водном растворе создается избыток гидроксоний-катионов:
Именно поэтому формулу H3BO3 и соответственно название борная кислота применять не рекомендуется, поскольку все три атома водорода молекулы В(ОН)3 не являются кислотными, т. е. не подвергаются кислотной диссоциации по Аррениусу или кислотному протолизу по Бренстеду.
Основностью кислоты называют число способных замещаться на металл атомов водорода в ее молекуле. По основности кислоты делят на одно-, двух- и трехосновные, например HBr, H2S и H3PO4 соответственно.
В зависимости от элементного состава кислоты делят на бескислородные и кислородные, например HBr и H2SO3.
Кислотный остаток — это структурный элемент молекулы кислоты, который выступает как единое целое в ходе химических реакций.
Все кислоты вступают в реакцию с основаниями с образованием солей и воды (реакция нейтрализации), с основными и амфотерными оксидами с образованием солей и воды, например:
Водные растворы сильных кислот вступают в реакцию с металлами, которые стоят в ряду напряжений металлов левее водорода, с образованием соли и выделением водорода:
Исключением является азотная кислота в любой концентрации и концентрированная серная кислота. В этих случаях водород не выделяется, а происходит восстановление атомов азота и серы соответственно.
Сильные кислоты вытесняют более слабые кислоты из их солей. При этом образуется новая кислота и новая соль:
Сильные кислоты: HI, HBr, HCl, HClO4, H2SO4, HNO3, H2CrO4, H2Cr2O7, HMnO4.
Кислоты средней силы: H2SO3, H3PO4, HF, HNO2.
Слабые кислоты: CH3COOH, H2CO3, H2S.
Кислородсодержащие кислоты и основания объединяют в общий класс гидроксидов.
Амфотерными называют гидроксиды, способные реагировать как с кислотами, так и с основаниями. Амфотерные гидроксиды: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, Sn(OH)2 Некоторые гидроксиды (Cu(OH)2, Fe(OH)3) проявляют амфотерные свойства с преобладанием основных. Проиллюстрируем химические свойства амфотерных гидроксидов на примере реакций гидроксида цинка.
Химические свойства гидроксида:
Солями называют класс химических соединений, которые представляют собой продукты взаимодействия кислот с основаниями.
По составу соли классифицируют на средние, кислые и основные.
Средними называют соли, которые состоят только из катиона металла или иона аммония и аниона кислотного остатка, например: CsBr, MgSO4.
Кислыми называют соли, которые наряду с катионом металла содержат катионы водорода, способные замещаться на другие катионы в ходе обменных реакций, например: LiHCO3, CaHPO4.
Основными называют соли, которые наряду с анионом кислотного остатка содержат одну или несколько гидроксильных групп, способных замещаться на анионы в ходе реакций обмена, например: Al(OH)Br2, Cu(OH)I.
Комплексными называют соли, которые содержат в своем составе комплексные катионы и/или анионы, например: K4[Fe(CN)6], [Ag(NH3)2]Cl.
Двойными называют соли, формально представляющие собой продукты взаимодействия двух простых солей, например: KAl(SO4)2.
Смешанными называют соли, являющиеся производными нескольких кислот и/или оснований, например: BaClBr.
Соли могут реагировать с кислотами с образованием кислых солей; более сильные кислоты могут вытеснять более слабые из их солей:
Соли взаимодействуют со щелочами:
Растворимые в воде соли могут вступать друг с другом в реакции обмена, если один из продуктов уходит из сферы реакции в виде осадка, например:
Растворы или расплавы солей вступают во взаимодействие с металлами, стоящими левее, чем металл, входящий в состав соли, в ряду стандартных электродных потенциалов:
Кислые соли вступают в реакции со щелочами с образованием средних солей и воды:
Некоторые кислые соли, например угольной кислоты, разлагаются под действием более сильных кислот:
ОснОвные соли вступают в реакции с кислотами:
Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами, например:
При нагревании комплексные соли теряют воду:
Классификацию неорганических веществ можно представить следующей самой общей схемой:
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Источник
