Какие физические свойства характерны для альдегидов
Общая формула предельных альдегидов и кетонов CnH2nO. В названии альдегидов присутствует суффикс –аль.
Простейшие представители альдегидов – формальдегид (муравьиный альдегид) –СН2 = О, ацетальдегид (уксусный альдегид) – СН3-СН = О. Существуют циклические альдегиды, например, циклогексан-карбальдегид; ароматические альдегиды имеют тривиальные названия – бензальдегид, ванилин.
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации и образует 3σ-связи (две связи С-Н и одну связь С-О). π-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием σ- и π-связей. Электронная плотность смещена в сторону атома кислорода.
Для альдегидов характерна изомерия углеродного скелета, а также межклассовая изомерия с кетонами:
СН3-СН2-СН2-СН = О (бутаналь);
СН3-СН(СН3)-СН = О (2-метилпентаналь);
СН3-С(СН2-СН3) = О (метилэтилкетон).
Химические свойства альдегидов
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; α-СН кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
1. Реакции присоединения:
— воды с образованием гем-диолов
R-CH = O + H2O ↔ R-CH(OH)-OH;
— спиртов с образованием полуацеталей
CH3-CH = O + C2H5OH ↔CH3-CH(OH)-O-C2H5;
— тиолов с образованием дитиоацеталей (в кислой среде)
CH3-CH = O + C2H5SH ↔ CH3-CH(SC2H5)-SC2H5 + H2O;
— гидросульфита натрия с образованием α-гидроксисульфонатов натрия
C2H5-CH = O + NaHSO3 ↔ C2H5-CH(OH)-SO3Na;
— аминов с образованием N-замещенных иминов (основания Шиффа)
C6H5CH = O + H2NC6H5 ↔ C6H5CH = NC6H5 + H2O;
— гидразинов с образованием гидразонов
CH3-CH = O +2HN-NH2 ↔ CH3-CH = N-NH2 + H2O;
— циановодородной кислоты с образованием нитрилов
CH3-CH = O + HCN ↔ CH3-CH(N)-OH;
— восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
R-CH = O + H2 → R—CH2-OH;
2. Окисление
— реакция «серебряного зеркала» — окисление альдегидов аммиачным раствором оксида серебра
R-CH = O + Ag2O → R-CO-OH + 2Ag↓;
— окисление альдегидов гидроксидом меди (II), в результате которого выпадает осадок оксида меди (I) красного цвета
CH3-CH = O + 2Cu(OH)2 → CH3-COOH + Cu2O↓ + 2H2O;
Эти реакции являются качественными реакциями на альдегиды.
Физические свойства альдегидов
Первый представитель гомологического ряда альдегидов – формальдегид (муравьиный альдегид) – газообразное вещество (н.у.), альдегиды неразветвленного строения и состава С2-С12 – жидкости, С13 и длиннее – твердые вещества. Чем больше атомов углерода входит в состав неразветвленного альдегида, тем выше его температура кипения. С увеличением молекулярной массы альдегидов увеличиваются значения величин их вязкости, плотности и показателя преломления. Формальдегид и ацетальдегид способны смешиваться с водой в неограниченных количествах, однако, с ростом углеводородной цепи эта способность альдегидов снижается. Низшие альдегиды обладают резким запахом.
Получение альдегидов
Основные способы получения альдегидов:
— гидроформилирование алкенов. Эта реакция заключается в присоединении СО и водорода к алкену в присутствии карбонилов некоторых металлов VIII группы, например, октакарбонилдикобальта (Cо2(СО)8) Реакция проводится при нагревании до 130![]() С и давлении 300 атм
С и давлении 300 атм
СН3-СН = СН2 + СО +Н2 →СН3-СН2-СН2-СН = О + (СН3)2СНСН = О;
— гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей ртути (II) и в кислой среде:
НС≡СН + Н2О → СН3-СН = О;
— окисление первичных спиртов (реакция протекает при нагревании)
СН3-СН2-ОН + CuO → CH3-CH = O + Cu + H2O.
Применение альдегидов
Альдегиды нашли широкое применение в качестве сырья для синтеза различных продуктов. Так, из формальдегида (крупнотоннажное производство) получают различные смолы (фенол-формальдегидные и т.д.), лекарственные препараты (уротропин); ацетальдегид — сырье для синтеза уксусной кислоты, этанола, различных производных пиридина и т.д. Многие альдегиды (масляный, коричный и др.) используют в качестве ингредиентов в парфюмерии.
Примеры решения задач
Источник
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Температуры кипения кетонов несколько выше, чем у изомерных им альдегидов.
Метаналь (формальдегид) — газ, альдегиды С2–C5 и кетоны С3–С4 — жидкости, высшие карбонильные соединения — твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает. Ароматические карбонильные соединения в воде плохо растворимы.
Отличительной чертой многих альдегидов является их запах.
Низшие альдегиды имеют резкий запах (хотя при сильном разведении запах становится приятным и напоминает аромат плодов), у альдегидов, содержащих С4-С6 – неприятный запах, высшие альдегиды и кетоны обладают цветочными запахами. Альдегиды и кетоны хорошо растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
Альдегиды в природе
Альдегиды широко распространены в природе. Высшие альдегиды, особенно непредельные и ароматические входят в состав эфирных масел и содержатся в фруктах, плодах, цветах, душистых и пряных растениях. Их используют в пищевой промышленности и парфюмерии.
Человек давно использует лечебные свойства некоторых альдегидов. Пиродоксаль является одной из форм витамина В6.
В эфирных маслах аниса, акации, укропа, боярышника доминирует среди других «пахнущих» компонентов анисовый альдегид C8H8O2.
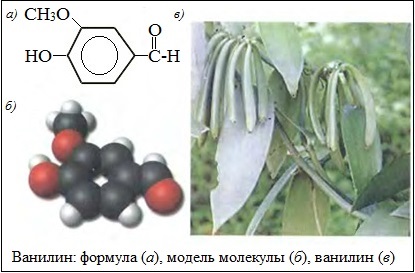
В плодах тропического растения ванили содержится ароматический альдегид ванилин (4-гидрокси-3-метоксибензальдегид) C8H8O3, который придает им характерный запах. Ванилин — кристаллическое вещество, хорошо растворяется в спирте, эфире, мало растворяется в воде.
 Коричный альдегид С6Н5СН=СНСНО содержится в масле корицы, его получают при обработке перегретым паром коры дерева корицы. Он обусловливает запах корицы, гвоздики.
Коричный альдегид С6Н5СН=СНСНО содержится в масле корицы, его получают при обработке перегретым паром коры дерева корицы. Он обусловливает запах корицы, гвоздики.
Куминовый альдегид С10Н12О содержится в масле тмина, гелиотропин (пиперональ) C8H6O3 – содержится в цветках гелиотропа и сирени.
 Пеларгоновый альдегид (нониловый альдегид, нонаналь) СН3(СН2)7СНО содержится в розовом и лимонном масле, в эфирных маслах цитрусовых растений. Пеларгоновый альдегид обладает запахом апельсина, его используют как пищевой ароматизатор.
Пеларгоновый альдегид (нониловый альдегид, нонаналь) СН3(СН2)7СНО содержится в розовом и лимонном масле, в эфирных маслах цитрусовых растений. Пеларгоновый альдегид обладает запахом апельсина, его используют как пищевой ароматизатор.
Альдегиды в природе

Физические свойства некоторых альдегидов

Формальдегид (муравьиный альдегид, метаналь) НСН=О – бесцветный газ с резким запахом, хорошо растворяется в воде, спиртах и полярных раствориелях. Иритант, токсичен!
Ирританты – группа веществ (слезоточивого или раздражающего действия), вызывающих раздражительные реакции при попадании на слизистые и кожу, и воздействии на дыхательные пути (респираторный эффект).
Формальдегид опасен для здоровья! 
Попадая в кровь, он уплотняет клеточную мембрану эритроцитов (красных кровяных клеток) настолько, что она теряет свои свойства, а ведь именно эритроциты снабжают клетки кислородом.
Водный 40%-ный раствор формальдегида называется формалином. Он обладает сильным дезинфицирующим действием и используется для хранения биологических препаратов.
Ацетальдегид (уксусный альдегид, этаналь) СН3СН=О – бесцветная легкокипящая жидкость, с резким запахом зеленой листвы. Хорошо растворяется в спирте, эфире, в воде растворяется неограниченно. Из-за очень низкой температуры кипения (210С) хранят и перевозят ацетальдегид в виде тримера – паральдегида.
Ирритант, очень токсичен! Он способен соединяться с белками и другими органическими соединениями в организме, подавляет дыхательные процессы в клетках.
Он является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Образуется при термической обработке полимеров и пластиков.
Акролеин (акриловый альдегид, пропеналь) СН2=CHCH=O – жидкость с резким неприятным запахом. Вследствие своей высокой реакционной способности акролеин является токсичным, сильно раздражающим слизистые оболочки глаз и дыхательных путей.
Он является одним из продуктов термического разложения глицерина и жиров-глицеридов, чем объясняется раздражающие слизистые оболочки свойства дыма горелых жиров. Подобный процесс наблюдается при пригорании жиров.
Он проявляет реакции, характерные для этиленовых углеводородов и альдегидов.
Бензальдегид(бензойный альдегид) C6H5CH=O – бесцветная маслянистая жидкость с запахом горького миндаля, плохо растворимая в воде, но хорошо растворимая в этаноле. Он содержится в миндале, листьях черемухи, косточках персиков, абрикосов, слив, в листьях лавровишен, в маслах нероли, цветов акации, апельсина, гиацинта, в эфирном масле эвкалипта. Бензальдегид легко окисляется на воздухе, образуя бензойную кислоту.
Фенилэтаналь (фенилуксусный альдегид) C6H5CH2CHO — бесцветная жидкость с сильным запахом гиацинта. По сравнению с бензальдегидом лучше соответствует рецептору цветочного запаха.
Кетоны в природе
Гептанон-2 С7Н14О представляет собой жидкость с гвоздичным запахом, обуславливает запах многих плодов и молочных продуктов.
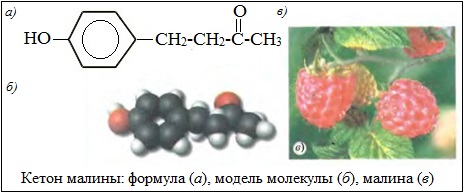
Гидроксифенилбутанон-2 (кетон малины) С10Н12О2 содержится в спелых ягодах малины. Его используют для придания вкуса и аромата в пищевой промышленности и включают в состав синтетических душистых композиций. Это один из самых дорогих компонентов, используемых в пищевой промышленности.
Физические свойства некоторых кетонов
Ацетофенон (метилфенилкетон) C6H5COCH3 — кристаллическое вещество, растворяется в спирте, эфире, бензоле, не растворяется в воде.
Бензофенон (дифенилкетон) (С6Н5)2С=О — кристаллическое вещество, растворимое в эфире, спирте, бензоле, нерастворимое в воде.
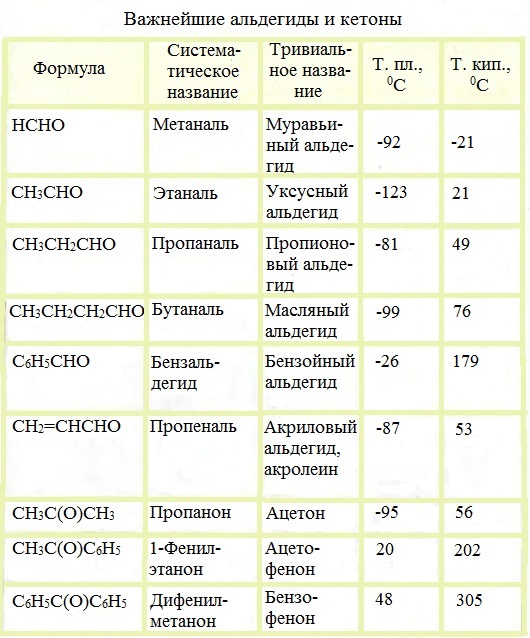
Физические характеристики альдегидов и кетонов
Альдегиды и кетоны
Источник
Альдегиды представляют собой органические соединения, в которых углерод имеет двойную связь с кислородом и одинарную с водородом либо атомом, который имеет обозначение R в структурных схемах. Многие из альдегидов обладают приятным запахом, вследствие чего находят активное применение в разных промышленных целях. Получают альдегиды из спиртов путем их дегидрирования. Об их физических и химических свойствах, применении и получении наша сегодняшняя статья.
Химические свойства альдегидов
Практически все альдегиды способны вступать в разнообразные химические реакции, включая полимеризацию. Сочетание их с другими видами молекул ведет к созданию так званных конденсационных полимеров, которые активно используются, например, при производстве пластмассы, в качестве растворителей и парфюмерных ингредиентов.
А некоторые альдегиды даже принимают активное участие в физиологических процессах, так они являются частью:
- витамина А, очень важного для зрения,
- пиридоксальфосфата – одной из форм витамина В6,
- глюкозы и прочих редуцированных сахаров,
- некоторых природных и синтетических гормонов.
Важным отличием альдегидов от тех же углеродов является наличие у них карбонильной группы. Карбонильная группа эта изначально полярна, то есть электроны образующие связь С=О притягиваются больше к кислороду, нежели к углероду. Благодаря этому первый из электронов получает отрицательный заряд, а второй положительный.
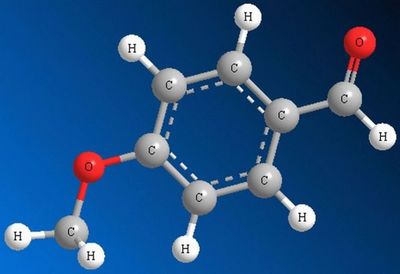
Также стоит заметить, что альдегиды имеют более высокий дипольный момент по сравнению с остальными углеводородными соединениями.
Физические свойства альдегидов
Температура кипения альдегидов и их плавления гораздо выше у карбонилсодержащих соединений, нежели у просто состоящих из углерода и водорода. К примеру, бутан и ацетон имея одинаковую молекулярную массу, закипают очень по разному: бутан закипает уже при 0 С, в то время как ацетону для кипения необходимо уже +56 С.
В отличие от углеводородов альдегиды способны растворятся в воде, но не все, а только имеющие менее пяти атомов углерода в молекуле. Но если углеводородная часть их молекул выше этого числа, это делает их нерастворимыми в воде.
Структура альдегидов
Формальгид – простейший альдегид, имеет молекулу, связанную с двумя атомами водорода. У всех других альдегидов молекулы связаны лишь с одним атомом водорода.
Углерод, связанный с карбонильной группой может быть частью алкильных либо неалкильных групп, они в свою очередь могут быть ациклическими, ароматическими или гетероциклическими кольцами. Органические соединения, обладающие двумя альдегидными группами называются диальдегидами.
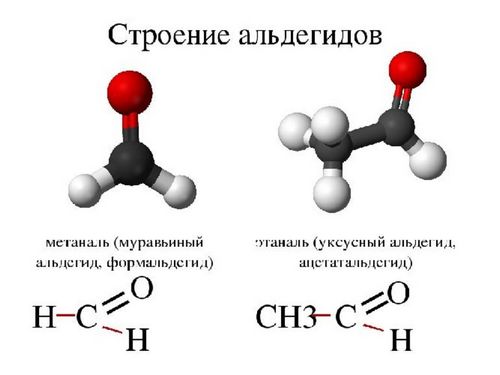
Номенклатура альдегидов
Есть два способа наименования альдегидов. Один из них основан на системе, разработанной Международным союзом теоретической и прикладной химии, его еще называют систематической номенклатурой. Он предполагает использовать в качестве исходного алкана самую длинную цепь атомов углерода, содержащую карбонильную группу в качестве исходного алкана. Числовое определение исходной карбонильной группы при этом использовать не принято, так как она всегда находится в конце родительской цепи. Например, название может быть 2-метилбутаналь, или изомасляный альдегид будет указан как 2-метилпропаналь.
Другой метод представляет собой общую номенклатуру. Принцип общей номенклатуры заключается в том, чтобы называть соединения по общему наименованию соответствующей карбоновой кислоты. Иными словами структура та же, что и у альдегида, только вместо CHO появляется COOH, как у уксусной кислоты — CH3COOH или C2H4O2.
Производство альдегидов
Так как альдегиды одни из ключевых строительных блоков органической химии, то не удивительно, что для их получения и производства существует множество разных методов:
- Окисление. Представляет собой один из основных методов для получения альдегидов. Обычно спирты могут быть окислены до состояния альдегидов. Для этого первичный спирт пропускается через горячий катализатор (гидроксид меди) или через аммиачный раствор оксида серебра (так званая реакция серебряного зеркала). Увы, но этот способ не подходит для маленьких лабораторий.
- Гидроформилирование – еще один способ для получения альдегидов, когда алкены обрабатываются монооксидом углерода, водородом и катализатором на основе переходного металла.
- Один из альдегидов (ацетальдегид) может быть получены путем взаимодействия ацетилена с водой.
Для коммерческого получения альдегидов чаще всего применяют гидроформилирование.

Где и как используются альдегиды?
Альдегиды находят многообразное применение в разных сферах человеческой жизни. Сотни их соединений используются химиками для синтеза других веществ. Например, благодаря формальдегиду мы получаем формалин, который в свою очередь активно применяется для дубления, консервации и бальзамирования, а также в качестве фунгицидного и бактериального средства для обработки растений.
Альдегиды, имеющие высокую молекулярную массу (к примеру, бензальдегид и фенилацетальдегид) обладают приятным запахом и поэтому используются в парфюмерии при производстве духов.
Альдегиды, видео
И в завершении образовательное видео по теме нашей статьи.
Источник
Альдегиды являются представителями карбонильных соединений.
Карбонильные соединения (оксосоединения) – это производные УВ, содержащие в молекуле карбонильную группу С = О.

Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
В зависимости от характера углеводородного радикала, связанного с альдегидной группой, альдегиды разделяются на предельные, непредельные и ароматические.
Предельные (насыщенные) альдегиды

Гомологический ряд


Номенклатура и изомерия
Название альдегида по международной номенклатуре образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания –аль. Нумерацию углеродной цепи начинают от атома углерода альдегидной группы.
В пределах класса альдегидов возможен только один вид изомерии – изомерия углеродной цепи.
Физические свойства
Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8—12 атомов «С», — душистые вещества. Альдегиды с 1—3 атомами «С» хорошо растворяются в воде; с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства
Альдегиды — один из наиболее реакционноспособных классов органических соединений, что связано с наличием в их молекулах высокополяризованной карбонильной группы >С=О.
Для альдегидов характерны реакции присоединения, окисления, полимеризации и поликонденсации.
I. Реакции присоединения
1.Гидрирование (восстановление) с образованием первичных спиртов RCH2ОH:

2.Присоединение спиртов с образованием полуацеталей:

Гидроксильная группа полуацеталей очень реакционноспособна.
В присутствии катализатора – хлороводорода и при избытке спирта образуются ацетали RCH(OR)2:
3.Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов:
Этой реакцией часто пользуются для выделения альдегидов из смесей или с целью их очистки.
II. Реакции окисления
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С—Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению. Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов различными окислителями (сильные окислители: О2 воздуха, подкисленный раствор K2Cr2O7 или КМnО4, слабые окислители: аммиачный раствор оксида серебра (I), щелочной раствор сульфата меди (II) и др.):
Реакции с аммиачным раствором оксида серебра (I) и щелочным раствором сульфата меди (II) являются качественными реакциями на альдегиды.
1.Взаимодействие с аммиачным раствором оксида серебра (I) — «реакция серебряного зеркала».
Оксид серебра (I) образуется в результате взаимодействия нитрата серебра(I) с NH4ОH:
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
2.Взаимодействие с гидроксидом меди (II)
Для реакции используют свежеприготовленный Cu(OH)2 образующийся при взаимодействии растворимой соли меди (II) со щелочью:
III. Реакции полимеризации (характерны для низших альдегидов)
1.Линейная полимеризация
При испарении или длительном стоянии раствора формальдегида происходит образование полимера— параформальдегида:

Полимеризация безводного формальдегида в присутствии катализатора — пентакарбонила железа Fe(CO)5 — приводит к образованию высокомолекулярного соединения— полиформальдегида (полиоксиметилен, полиметиленоксид):

2.Циклическая полимеризация (тримеризация, тетрамеризация)
Тример метаналя получается при перегонке подкисленного раствора формальдегида:
Уксусный альдегид образует циклические триммер и тетрамер: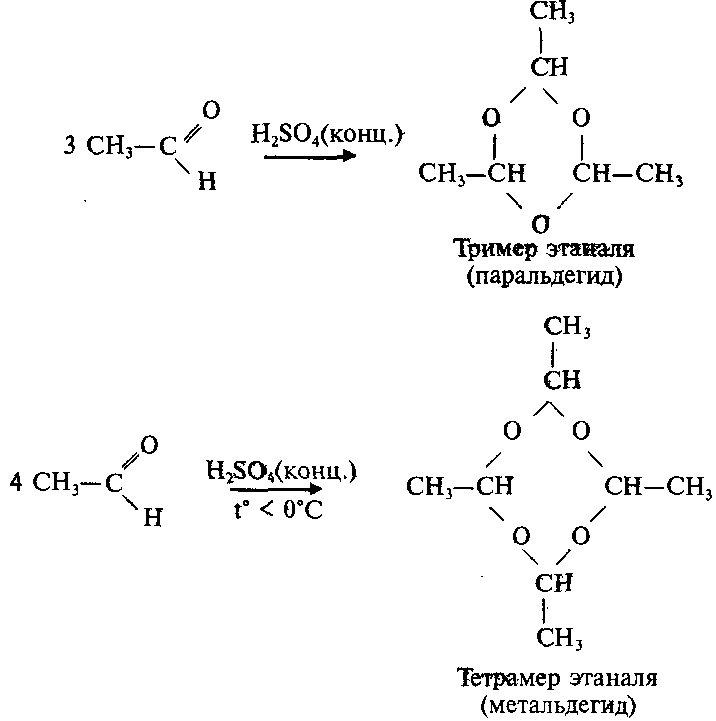
IV. Реакции поликонденсации
Реакции поликонденсации — это процессы образования высокомолекулярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как Н2О, НCl, NH3 и др.
В кислой или щелочной среде при нагревании формальдегид (образует с фенолом высокомолекулярные продукты — фенолформальдегидные смолы различного строения:
Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолоспирта:
При нагревании фенолоспирты конденсируются с образованием фенолформальдегидных полимеров:
Фенолформальдегидные смолы используются для получения пластических масс (фенопластов).
Способы получения
I. Общие методы получения
1.Окисление первичных спиртов:
а) каталитическое

б) под действием окислителей (K2Cr2O7 или KMnO4 в кислой среде)
2.Каталитическое дегидрирование первичных спиртов:
3.Гидролиз дигалогеналканов, содержащих 2 атома галогена у первого атома углеродного атома:
II. Специфические способы получения
Формальдегид можно получить при каталитическом окислении метана:
Ацетальдегид получают реакцией Кучерова:
или при каталитическом окислении этилена:
Данный способ в последнее время широко используется для промышленного получения ацетальдегида. Однако аналогично могут быть получены и другие альдегиды при окислении гомологов этилена, например:

