Какие физические свойства характерны для азота

Азот — химический элемент, который известен каждому. Его обозначают буквой N. Он, можно сказать, основа неорганической химии, и поэтому его начинают изучать еще в восьмом классе. В этой статье мы подробно рассмотрим азот, а также его характеристики и свойства.
История открытия элемента
Такие соединения, как аммиак, селитра, азотная кислота, были известны и применялись на практике задолго до получения чистого азота в свободном состоянии.

Во время эксперимента, проведенного в 1772 году, Даниель Резерфорд сжигал фосфор и прочие вещества в колоколе из стекла. Он выяснил, что газ, остающийся после сгорания соединений, не поддерживает горения и дыхания, и назвал его «удушливым воздухом».
В 1787 году Антуан Лавуазье установил, что газы, входящие в состав обычного воздуха, — это простые химические элементы, и предложил название «Азот». Чуть позже (в 1784 г.) физик Генри Кавендиш доказал, что это вещество входит в состав селитры (группы нитратов). Отсюда происходит латинское название азота (от позднелатинского nitrum и греческого gennao), предложенное Ж. А. Шапталем в 1790 году.
К началу XIX века учеными были выяснены химическая инертность элемента в свободном состоянии и его исключительная роль в соединениях с другими веществами. С этого момента «связывание» азота воздуха стало важнейшей технической проблемой химии.
Физические свойства

Азот немного легче воздуха. Его плотность составляет 1,2506 кг/м³ (0 °С, 760 мм рт. ст.), температура плавления — -209,86 °С, кипения — -195,8 °С. Азот с трудом сжижается. Его критическая температура относительно низка (-147,1 °С), при этом критическое давление довольно высоко — 3,39 Мн/м². Плотность в жидком состоянии — 808 кг/м³. В воде этот элемент менее растворим, чем кислород: в 1 м³ (при 0 °С) Н₂О может раствориться 23,3 г N. Этот показатель выше при работе с некоторыми углеводородами.
Химические свойства азота
При нагревании до невысоких температур этот элемент взаимодействует только с активными металлами. Например, с литием, кальцием, магнием. С большинством других веществ азот вступает в реакцию в присутствии катализаторов и/или при высокой температуре.
Хорошо изучены соединения N с О₂ (кислородом) N₂O₅, NO, N₂O₃, N₂O, NO₂. Из них при взаимодействии элементов (t — 4000 °С) образуется оксид NO. Далее в процессе охлаждения он окисляется до NO₂. Оксиды азота образуются в воздухе при прохождении атмосферных разрядов. Их можно получить действием ионизирующих излучений на смесь N с О₂.

При растворении в воде N₂O₃ и N₂O₅ соответственно получаются кислоты HNO₂ и HNO₂, образующие соли — нитраты и нитриты. Азот соединяется с водородом исключительно в присутствии катализаторов и при высокой температуре, образуя NH₃ (аммиак). Кроме того, известны и другие (они довольно многочисленны) соединения N с H₂, к примеру диимид HN = NH, гидразин H₂N-NH₂, октазон N₈H₁₄, кислота HN₃ и другие.
Стоит сказать, что большинство соединений водород + азот выделены исключительно в виде органических производных. Этот элемент не взаимодействует (непосредственно) с галогенами, поэтому все его галогениды получают только косвенным путем. К примеру, NF₃ образуется при взаимодействии аммиака с фтором.
Большинство галогенидов азота — малостойкие соединения, более устойчивы оксигалогениды: NOBr, NO₂F, NOF, NOCl, NO₂Cl. Непосредственного соединения N с серой также не происходит, N₄S₄ получается в процессе реакции аммиак + жидкая сера. Во время взаимодействия раскаленного кокса с N образуется циан (CN)₂. В процессе нагревания ацетилена С₂Н₂ с азотом до 1500 °С можно получить цианистый водород HCN. При взаимодействии N с металлами при относительно высоких температурах образуются нитриды (к примеру, Mg₃N₂).
При воздействии на обычный азот электроразрядов [при давлении 130–270 н/м² (соответствует 1–2 мм рт. cт.)] и при разложении Mg₃N₂, BN, TiNx и Ca₃N₂, а также при электроразрядах в воздухе может быть образован активный азот, обладающий повышенным запасом энергии. Он, в отличие от молекулярного, весьма энергично взаимодействует с водородом, парами серы, кислородом, некоторыми металлами и фосфором.
Азот входит в состав довольно многих важнейших органических соединений, в том числе — аминокислот, аминов, нитросоединений и прочих.
Получение азота
В лаборатории этот элемент может быть легко получен в процессе нагревания концентрированного раствора нитрита аммония (формула: NH₄NO₂ = N₂ + 2H₂O). Технический метод получения N основан на разделении заранее сжиженного воздуха, который в дальнейшем подвергается разгонке.
Область применения

Основная часть получаемого свободного азота используется при промышленном производстве аммиака, который потом в довольно больших количествах перерабатывается на удобрения, взрывчатые вещества и т. п.
Кроме прямого синтеза NH₃ из элементов, применяется разработанный в начале прошлого века цианамидный метод. Он основан на том, что при t = 1000 °С карбид кальция (образованный накаливанием смеси угля и извести в электропечи) реагирует со свободным азотом (формула: СаС₂ + N₂ = CaCN₂ + С). Полученный цианамид кальция под действием разогретого водяного пара разлагается на CaCO₃ и 2NH₃.
В свободном виде данный элемент применяется во многих отраслях промышленности: в качестве инертной среды при разнообразных металлургических и химических процессах, при перекачке горючих жидкостей, для заполнения пространства в ртутных термометрах и т. д. В жидком состоянии он используется в различных холодильных установках. Его транспортируют и хранят в стальных сосудах Дьюара, а сжатый газ — в баллонах.
Широко применяют и многие соединения азота. Их производство стало усиленно развиваться после Первой мировой войны и на данный момент достигло поистине огромных масштабов.
Роль азота в биологии

Это вещество является одним из основных биогенных элементов и входит в состав важнейших элементов живых клеток — нуклеиновых кислот и белков. Однако количество азота в живых организмах невелико (примерно 1–3 % на сухую массу). Имеющийся в атмосфере молекулярный материал усваивают лишь сине-зеленые водоросли и некоторые микроорганизмы.
Довольно большие запасы этого вещества сосредоточены в почве в виде различных минеральных (нитраты, аммонийные соли) и органических соединений (в составе нуклеиновых кислот, белков и продуктов их распада, включая еще не полностью разложившиеся остатки флоры и фауны).
Растения отлично усваивают азот из грунта в виде органических и неорганических соединений. В природных условиях большое значение имеют особые почвенные микроорганизмы (аммонификаторы), которые способны минерализировать органический N почвы до солей аммония.
Нитратный азот грунта образуется в процессе жизнедеятельности нитрифицирующих бактерий, открытых С. Виноградским в 1890 году. Они окисляют аммонийные соли и аммиак до нитратов. Часть усвояемого флорой и фауной вещества теряется из-за воздействия денитрифицирующих бактерий.
Микроорганизмы и растения отлично усваивают как нитратный, так и аммонийный N. Они активно превращают неорганический материал в различные органические соединения — аминокислоты и амиды (глутамин и аспарагин). Последние входят в состав многих белков микроорганизмов, растений и животных. Синтез аспарагина и глутамина путем амидирования (ферментативного) аспарагиновой и глутаминовой кислот осуществляется многими представителями флоры и фауны.
Производство аминокислот происходит при помощи восстановительного аминирования ряда кетокислот и альдегидокислот, возникающих путем ферментативного переаминирования, а также в результате окисления различных углеводов. Конечными продуктами усвоения аммиака (NH₃) растениями и микроорганизмами являются белки, которые входят в состав ядра клеток, протоплазмы, а также откладываются в виде так называемых запасных белков.
Человек и большинство животных могут синтезировать аминокислоты лишь в довольно ограниченной мере. Они не способны производить восемь незаменимых соединений (лизин, валин, фенилаланин, триптофан, изолейцин, лейцин, метионин, треонин), и потому для них главным источником азота являются потребляемые с пищей белки, то есть, в конечном счете, — собственные белки микроорганизмов и растений.
Источник
Ключевые слова конспекта: свойства простых веществ, азот, строение и физические свойства, химические свойства, производство и применение азота.
Азот – элемент группы VA. Его важнейшие параметры приведены в таблице.
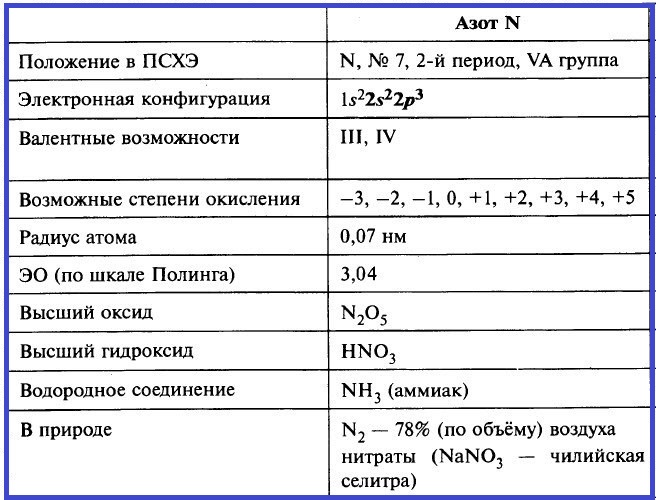
Таблица «Важнейшие параметры элемента азот»
На валентном энергетическом уровне атома азота нет вакантных орбиталей. Следовательно, электронная пара 2s-подуровня не может быть распарена, и поэтому азот в своих соединениях не может быть пятивалентным. Максимальная валентность азота в соединениях – IV.
Азот проявляет степени окисления от –3 (низшей) до +5 (высшей). Примеры соединений с различными степенями окисления азота приведены в таблице.

Примеры веществ с различными степенями окисления азота и фосфора
СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА
Для азота не характерна аллотропия, элемент азот образует одно простое вещество – N2. Это молекулярное вещество, молекула азота образована двумя атомами азота, связь – ковалентная неполярная, тройная (одна σ- и две π-связи):
Тройная связь в молекуле азота чрезвычайно прочна, её энергия составляет 946 кДж/моль. Именно это обусловливает крайне низкую реакционную способность азота.
Молекулярный азот – газ (при обычных условиях), без цвета, без запаха, чуть легче воздуха (DB = 28/29 ≈ 0,966), плохо растворим в воде.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА
Электроотрицательность элемента азота довольно высока, но химическая активность азота – простого вещества крайне низкая. Это обусловлено прочностью тройной связи в молекуле азота.
Химические свойства азота представлены в таблице ниже. В обычных условиях азот взаимодействует только с литием Li, при нагревании азoт реагирует с металлами с образованием нитридов. Если говорить о неметаллах, то азот реагирует с водородом и кислородом. С водородом реакция идёт при нагревании и повышенном давлении, требуется катализатор.
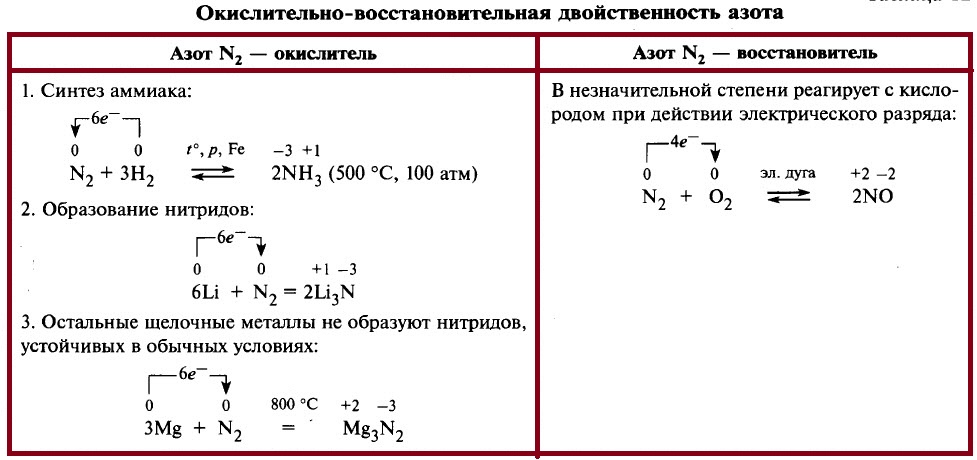
Реакция азота с кислородом начинается при температуре 3000–4000 °С, но даже при температуре 4000 °С содержание NO составляет всего около 10%. В отличие от других реакций кислорода с простыми веществами, эта реакция – эндотермическая, на образование 1 моль NO требуется 90 кДж. Обычно реакцию с кислородом осуществляют в электрической дуге, но всё равно она идёт с незначительным выходом продукта.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТА
В промышленности азот получают методом разделения жидкого воздуха на компоненты. Лабораторным способом получения азота является термическое разложение нитрита аммония:![]()
Эта реакция относится к типу конпропорционирования: восстановителем является азот в составе иона аммония (N–3), а окислителем – азот в составе нитрит-иона (N+3).
Применение азота. Большая часть азота (примерно 3/4) расходуется для синтеза аммиака, который, в свою очередь, используется для получения удобрений.
Применение газообразного азота обусловлены его инертными свойствами. Газообразный азoт пожаро- и взрывобезопасен, препятствует окислению, гниению.
В лабораториях азот применяется для создания инертной среды при проведении некоторых реакций.
В нефтехимии его применяют для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений.
В горнодобывающем деле азот может использоваться для создания в шахтах взрыво–безопасной среды, для распирания пластов породы.
В производстве электроники его применяют для продувки областей, не допускающих наличия окисляющего кислорода.
Aзот используется в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот используется как газ, наполняющий упаковки, как хладагент.
Газообразным азотом заполняют камеры шин летательных аппаратов.
В жидком азоте, имеющем температуру – 196 °С, хранят в медицинских и исследовательских целях клетки, органы, ткани, другие биологические объекты. Жидкий азот применяют в косметологии для удаления бородавок и родинок.

Конспект урока «Свойства простых веществ: Азот».
Следующая тема: «Свойства простых веществ: Фосфор».
Источник
Таблица 1. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА | |
Плотность, г/см3 | 0,808 (жидк.) |
Температура плавления, °С | -209,96 |
Температура кипения, °С | -195,8 |
Критическая температура, °С | -147,1 |
Критическое давление, атма | 33,5 |
Критическая плотность, г/см3 а | 0,311 |
Удельная теплоемкость, Дж/(мольЧК) | 14,56 (15° С) |
Электроотрицательность по Полингу | 3 |
Ковалентный радиус, Е | 0,74 |
Кристаллический радиус, Е | 1,4 (M3-) |
Потенциал ионизации, Вб | |
первый | 14,54 |
второй | 29,60 |
а Температура и давление, при которых плотности азота жидкого и газообразного состояния одинаковы. | |
б Количество энергии, необходимое для удаления первого внешнего и следующего за ним электронов, в расчете на 1 моль атомарного азота. |
Плотность газообразного азота при 0°C 1,25046 г/дм3, жидкого азота (при температуре кипения) — 0,808 кг/дм3. Газообразный азот при нормальном давлении при температуре -195,8°C переходит в бесцветную жидкость, а при температуре -210,0°C — в белое твердое вещество. В твердом состоянии существует в виде двух полиморфных модификаций: ниже -237,54°C устойчива форма с кубической решеткой, выше — с гексагональной. Критическая температура азота -146,95°C, критическое давление 3,9МПа, тройная точка лежит при температуре -210,0°C и давлении 125,03 гПа, из чего следует, что азот при комнатной температуре ни при каком, даже очень высоком давлении, нельзя превратить в жидкость. Теплота испарения жидкого азота 199,3 кДж/кг (при температуре кипения), теплота плавления азота 25,5 кДж/кг (при температуре -210°C) [13].
Таблица 2. СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА И СООТВЕТСТВУЮЩИЕ СОЕДИНЕНИЯ
Химические свойства | |
Степень окисления | Примеры соединений |
-III | Аммиак NH3, ион аммония NH4+, нитриды M3N2 |
-II | Гидразин N2H4 |
-I | Гидроксиламин NH2OH |
I | Гипонитрит натрия Na2N2O2, оксид азота(I) N2O |
II | Оксид азота(II) NO |
III | Оксид азота(III) N2O3, нитрит натрия NaNO2 |
IV | Оксид азота(IV) NO2, димер N2O4 |
V | Оксид азота(V) N2O5, азотная кислота HNO3 и ее соли (нитраты) |
Азота способен образовывать химические соединения, находясь во всех степенях окисления от +5 до -3. Соединения в положительных степенях окисления азот образует с фтором и кислородом, причем в степенях окисления больше +3 азот может находиться только в соединениях с кислородом. Соединения, в которых имеет степень окисления – 3, называются нитридами.Только с такими активными металлами, как литий, кальций, магний, Азот взаимодействует при нагревании до сравнительно невысоких температур. С большинством других элементов Азот реагирует при высокой температуре и в присутствии катализаторов. Хорошо изучены соединения Азота с кислородом N2O, NO, N2O3, NO2 и N2O5 . Из них при непосредственном взаимодействии элементов (4000°С) образуется оксид NO С кислородом азот соединяется только в электрической дуге с образованием оксида азота (II):
N2 + O2 = 2NO
который при охлаждении легко окисляется далее до оксида (IV) NO2. В воздухе оксиды Азота образуются при атмосферных разрядах. Их можно получить также действием на смесь Азота с кислородом ионизирующих излучений. При растворении в воде азотистого N2O3 и азотного N2O5 ангидридов соответственно получаются азотистая кислота HNO2 и азотная кислота HNO3, образующие соли – нитриты и нитраты. С водородом Азот соединяется только при высокой температуре и в присутствии катализаторов, при этом образуется аммиак NH3. Кроме аммиака, известны и другие многочисленные соединения Азот с водородом, например гидразин H2N-NH2, диимид HN=NH, азотистоводородная кислота HN3(H-N=N?N), октазон N8H14 и другие; большинство соединений Азота с водородом выделено только в виде органических производных. Известно несколько оксидов азота. С галогенами азот непосредственно не реагирует, косвенными путями получены NF3, NCl3, NBr3 и NI3 (фтористый азот NF3 – при взаимодействии фтора с аммиаком), а также несколько оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и галогена, и кислорода, например, NOF3).. Как правило, галогениды Азота – малостойкие соединения (за исключением NF3); более устойчивы оксигалогениды Азота – NOF, NOCl, NOBr, NO2F и NO2Cl. С серой также не происходит непосредственного соединения Азот; азотистая сера N4S4 получается в результате реакции жидкой серы с аммиаком. При взаимодействии раскаленного кокса с Азот образуется циан (CN)2. Нагреванием Азота с ацетиленом С2Н2 до 1500°С может быть получен цианистый водород HCN. Взаимодействие Азота с металлами при высоких температурах приводит к образованию нитридов (например, Mg3N2).
При действии на обычный Азот электрических разрядов [давление 130-270 н/м2 (1-2 мм рт. cт.)] или при разложении нитридов В, Ti, Mg и Са, а также при электрических разрядах в воздухе может образоваться активный Азот, представляющий собой смесь молекул и атомов Азота, обладающих повышенным запасом энергии. В отличие от молекулярного, активный Азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами.
Азот входит в состав очень многих важнейших органических соединений (амины, аминокислоты, нитросоединения и других).
Из-за высокой прочности молекулы N2 процессы разложения различных соединений азота (в том числе и печально знаменитого взрывчатого вещества гексогена) при нагревании, ударах и т. д. приводят к образованию молекул N2. Так как объем образовавшегося газа значительно больше, чем объем исходного взрывчатого вещества, гремит взрыв.
Химически азот довольно инертен и при комнатной температуре реагирует только с металлом литием с образованием твердого нитрида лития Li3N. В соединениях проявляет различные степени окисления (от -3 до +5). С водородом образует азотистоводородную кислоту HN3. Соли этой кислоты — азиды. Азид свинца Pb(N3)2 разлагается при ударе, поэтому его используют как детонатор, например, в капсюлях патронов. Галогениды азота неустойчивы и легко разлагаются при нагревании (некоторые — при хранении) на простые вещества. Так, NI3 выпадает в осадок при сливании водных растворов аммиака и иодной настойки. Уже при легком сотрясении сухой NI3 взрывается:
2NI3 = N2 + 3I2.
Азот не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими неметаллами. При нагревании азот реагирует с магнием и щелочноземельными металлами, при этом возникают солеобразные нитриды общей формулы М3N2, которые разлагаются водой с образованием соответствующих гидроксидов и аммиака, например:
Са3N2 + 6H2O = 3Ca(OH)2 + 2NH3.
Аналогично ведут себя и нитриды щелочных металлов. Взаимодействие азота с переходными металлами приводит к образованию твердых металлоподобных нитридов различного состава. Например, при взаимодействии железа и азота образуются нитриды железа состава Fe2N и Fe4N. При нагревании азота с ацетиленом C2H2 может быть получен цианистый водород HCN. Из сложных неорганических соединений азота наибольшее значение имеют азотная кислота HNO3, ее соли нитраты, а также азотистая кислота HNO2 и ее соли нитриты. Поэтому реакции присоединения одного атома H или молекулы H2 к N2 сильно эндотермичны:
H + N2=N2H (87,8 кДж/моль)
H2 + N2=N2H2 (204,8 кДж/моль)
Отсюда следует, что гидрирование N2 не может происходить через стадию образования диимида (HN=NH), в то время как в случае ацетилена аналогичные реакции сильно экзотермичны:
H + С2H2=C2H3 (- 167,2 кДж/моль)
H2 + С2H2=C2H4 (- 175,5 кДж/моль)
Итак, энергетические характеристики N2 из-за особенностей его электронного строения делают его нереакционноспособным в реакциях с кислотами и основаниями, электрофильными (R+, AlCl3) и нуклеофильными (H-, R-, OR-) реагентами и даже с атомом H.
До 1964 года считали маловероятной возможность создания каталитических систем для фиксации азота, работающих в более мягких условиях, чем катализаторы процесса Габера-Боша, и более простых по структуре, чем ферменты. Вместе с тем известные в то время методы активации инертной молекулы CO комплексами переходных металлов, аналогии с активацией типичной тройной связи в алкинах и известные данные о наличии переходных металлов (Mo, V, Fe) в активных центрах нитрогеназ позволяли надеяться на возможность использования более слабых восстановителей, чем Li, при использовании комплексов переходных металлов в качестве активаторов азота [13].
Источник
