Какие физические свойства характерны для металлов как зависят свойства

Слово «металл» заимствовано из немецкого языка и окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл», а разграничение этих понятий произошло во времена М.В.Ломоносова.
Немецкое слово «metall» произошло от латинского «metallum» — «рудник, металл».
В латинский язык слово пришло из греческого — μεταλλον: «рудник, копь».
В современном понимании, металлы — группа химических элементов, в виде простых веществ, обладающих характерными металлическими свойствами: высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Однако в астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия.
Как химические элементы металлы очень распространены. Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
6 элементов в группе щелочных металлов,
6 в группе щёлочноземельных металлов,
38 в группе переходных металлов,
11 в группе лёгких металлов,
7 в группе полуметаллов,
14 в группе лантаноиды + лантан,
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
вне определённых групп — бериллий и магний.
Таким образом, к металлам относится 96 элементов из всех открытых.
Свойства металлов
Характерные свойства металлов
Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
Хорошая электропроводность (из неметаллов электропроводностью обладает также углерод)
Возможность лёгкой механической обработки (см.: пластичность; однако некоторые металлы, например, германий и висмут, непластичны)
Высокая плотность (обычно металлы тяжелее неметаллов)
Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
Большая теплопроводность
В реакциях чаще всего являются восстановителями
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью.
Температуры плавления чистых металлов лежат в диапазоне от −39°C (ртуть) до 3410°C (вольфрам). За исключением щелочных, металлы плавятся при высокой температуре, однако некоторые, например, олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность затруднительно: требуется полностью очистить металлы, так как любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако проволока из цинка или олова хрустит при сгибании, марганец и висмут почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла. Очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым.
Все металлы хорошие проводники. Это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность. По этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла. Широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Металлы в природе. Добыча и обогащение
Источник
Общие физические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. РЕАКЦИИ МЕТАЛЛОВ С НЕМЕТАЛЛАМИ
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
2. РЕАКЦИИ МЕТАЛЛОВ С КИСЛОТАМИ
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. ВЫТЕСНЕНИЕ БОЛЕЕ АКТИВНЫМИ МЕТАЛЛАМИ МЕНЕЕ АКТИВНЫХ МЕТАЛЛОВ ИЗ РАСТВОРОВ ИХ СОЛЕЙ:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
ОПРЕДЕЛЕНИЕ
Неметаллы – химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают как неметаллы.
Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Большее число электронов на внешнем энергетическом уровне по сравнению с металлами определяет их большую способность к присоединению электронов и проявлению высокой окислительной активности.
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Неметаллы обладают высокими значениями сродства к электрону , электроотрицательность и окислительно-восстановительный потенциал.
Химические свойства неметаллов
Основные химические свойства неметаллов (общие для всех) – это:
— взаимодействие с металлами
2Na + Cl2 = 2NaCl
Fe + S = FeS
6Li + N2 = 2Li3N
2Ca + O2 = 2CaO
— взаимодействие с другими неметаллами
3H2+ N2 = 2NH3
H2+ Br2 = 2HBr
S + O2 = SO2
4P + 5O2 = 2P2O5
2F2+ O2 = 2OF2
S + 3F2 = SF6,
C + 2Cl2 = CCl4
Каждый неметалл обладает специфическими химическими свойствами, характерными только для него, которые подробно рассматривают при изучении каждого неметалла в отдельности.
Физические свойства неметаллов
Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость.
Неметаллы находятся в земной коре (в большинстве своем кислород и кремний — 76 % от массы земной коры а также As, Se, I, Te, но в очень езначительных количествах), в воздухе (азот и кислород), в составе растительной массы (98,5 % — углерод, водород, кислород, сера, фосфор и азот), а также в основе массы человека (97,6 % — — углерод, водород, кислород, сера, фосфор и азот). Водород и гелий – входят в состав космических объектов, включая Солнце. Чаще всего в природе неметаллы встречаются в виде соединений.
Источник
Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.

Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.

Рис. 1. Электрохимический ряд напряжений металлов.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
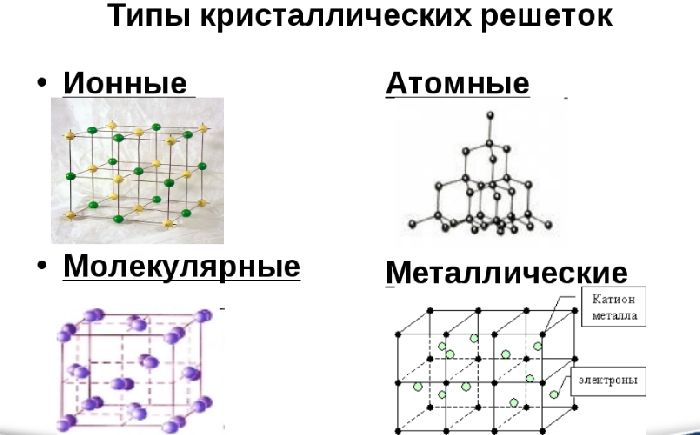
Рис. 2. Виды кристаллических решёток.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства | Особенности | Примеры | Применение |
Металлический блеск | Способность отражать солнечный свет | Наиболее блестящими металлами являются Hg, Ag, Pd | Изготовление зеркал |
Плотность | Лёгкие – имеют плотность меньше 5 г/см3 | Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см3 | Изготовление облицовки, деталей самолётов |
Тяжёлые – имеют плотность больше 5 г/см3 | Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см3 | Использование в сплавах | |
Пластичность | Способность изменять форму без разрушений (можно раскатать в тонкую фольгу) | Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn | Формовка, сгибание труб, изготовление проволоки |
Твёрдость | Мягкие – режутся ножом | Na, K, In | Изготовление мыла, стекла, удобрений |
Твёрдые – сравнимы по твёрдости с алмазом | Самый твёрдый – хром, режет стекло | Изготовление несущих конструкций | |
Температура плавления | Легкоплавкие – температура плавления ниже 1000°С | Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C) | Производство радиотехники, жести |
Тугоплавкие – температура плавления выше 1000°С | Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С) | Изготовление ламп накаливания | |
Теплопроводность | Способность передавать тепло другим телам | Лучше всего проводят ток и тепло Ag, Cu, Au, Al | Приготовление пищи в металлической посуде |
Электропроводность | Способность проводить электрический ток за счёт свободных электронов | Передача электричества по проводам |
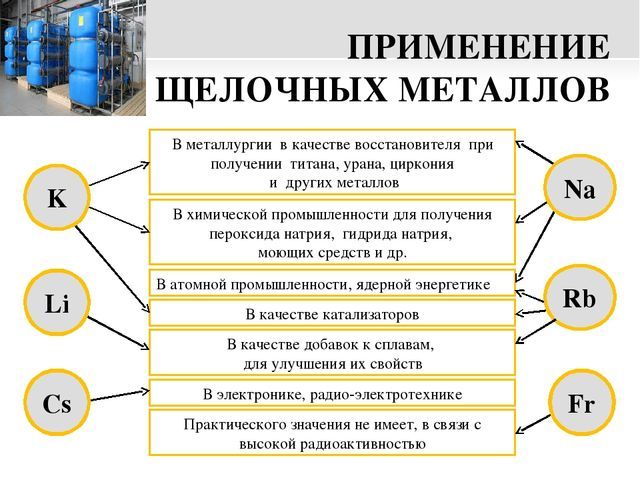
Рис. 3. Примеры применения металлов.
Что мы узнали?
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Лидия Маслова
10/10
Оценка доклада
Средняя оценка: 4.2. Всего получено оценок: 152.
Источник

Металлы, это группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск. В данной статье все свойства металлов будут представлены в виде отдельных таблиц.
Содержание
Свойства металлов
Свойства металлов делятся на физические, химические, механические и технологические.
Физические свойства металлов
К физическим свойствам относятся: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность, теплоемкость, расширяемость при нагревании.
Удельный вес металла — это отношение веса однородного тела из металла к объему металла, т.е. это плотность в кг/м3 или г/см3.
Плавкость металла — это способность металла расплавляться при определенной температуре, называемой температурой плавления.
Электропроводность металлов — это способность металлов проводить электрический ток, это свойство тела или среды, определяющее возникновение в них электрического тока под воздействием электрического поля. Под электропроводностью подразумевается способность проводить прежде всего постоянный ток (под воздействием постоянного поля), в отличие от способности диэлектриков откликаться на переменное электрическое поле колебаниями связанных зарядов (переменной поляризацией), создающими переменный ток.
Магнитные свойства металлов характеризуются: остаточной индукцией, коэрцетивной силой и магнитной проницаемостью.
Теплопроводность металлов — это их способность передавать тепло от более нагретых частиц к менее нагретым. Теплопроводность металла определяется количеством теплоты, которое проходит по металлическому стержню сечением в 1см2, длиной 1см в течение 1сек. при разности температур в 1°С.
Теплоемкость металлов — это количество теплоты, поглощаемой телом при нагревании на 1 градус. Отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества — мольной (молярной).
Расширяемость металлов при нагревании.Все металлы при нагревании расширяются, а при охлаждении сжимаются. Степень увеличения или уменьшения первоначального размера металла при изменении температуры на один градус характеризуется коэффициентом линейного расширения.
Химические свойства металлов
К химическим — окисляемость, растворимость и коррозионная стойкость.
Окисление металлов — это реакция соединения металла с кислородом, сопровождающаяся образованием окислов (оксидов). Если рассмотреть окисляемость шире, то это реакции, в которых атомы теряют электроны и образуются различные соединения, например, хлориды, сульфиды. В природе металлы находятся в основном в окисленном состоянии, в виде руд, поэтому их производство основано на процессах восстановления различных соединений.
Растворимость металлов — это их способность образовывать с другими веществами однородные системы — растворы, в которых металл находится в виде отдельных атомов, ионов, молекул или частиц. Металлы растворяются в растворителях, в качестве которых выступают сильные кислоты и едкие щелочи. В промышленности наиболее часто используются: серная, азотная и соляные кислоты, смесь азотной и соляной кислот (царская водка), а также щелочи — едкий натр и едкий калий.
Коррозионная стойкость металлов — это их способность сопротивляться коррозии.
Механические свойства металлов
К механическим — прочность, твердость, упругость, вязкость, пластичность.
Прочностью металла называется его способность сопротивляться действию внешних сил, не разрушаясь.
Твердостью металлов называется способность тела противостоять проникновению в него другого, более твердого тела.
Упругость металлов — свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызвавших изменение формы (деформацию).
Вязкость металлов — это способность металла оказывать сопротивление быстро возрастающим (ударным) внешним силам. Вязкость — свойство обратное хрупкости.
Пластичность металлов — это свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил. Пластичность—свойство обратное упругости.
Технологические свойства металлов
К технологическим — прокаливаемость, жидкотекучесть, ковкость, свариваемость, обрабатываемость резанием.
Прокаливаемость металлов – это их способность получать закаленный слой определенной глубины.
Жидкотекучесть металлов — это свойство металла в жидком состоянии заполнять литейную форму и воспроизводить ее очертания в отливке.
Ковкость металлов —это технологическое свойство, характеризующее их способность к обработке деформированием, например, ковкой, вальцеванием, штамповкой без разрушения.
Свариваемость металлов — это их свойство образовывать в процессе сварки неразъемное соединение, отвечающее требованиям, обусловленным конструкцией и эксплуатацией производимого изделия.
Обрабатываемость металлов резанием — это их способность изменять геометрическую форму, размеры, качество поверхности за счет механического срезания материала заготовки режущим инструментом. Обрабатываемость металлов зависит от их механических свойств, в первую очередь прочности и твердости.
Современными методами испытания металлов являются механические испытания, химический анализ, спектральный анализ, металлографический и рентгенографический анализы, технологические пробы, дефектоскопия. Эти испытания дают возможность получить представление о природе металлов, их строении, составе и свойствах, а также определить качество готовых изделий.
Таблицы свойств металлов
Таблица «Свойства металлов: Чугун, Литая сталь, Сталь»
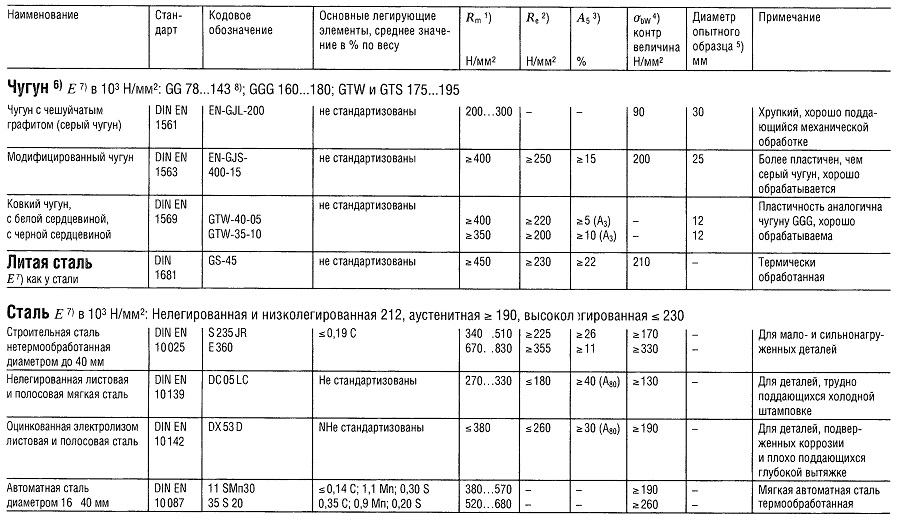
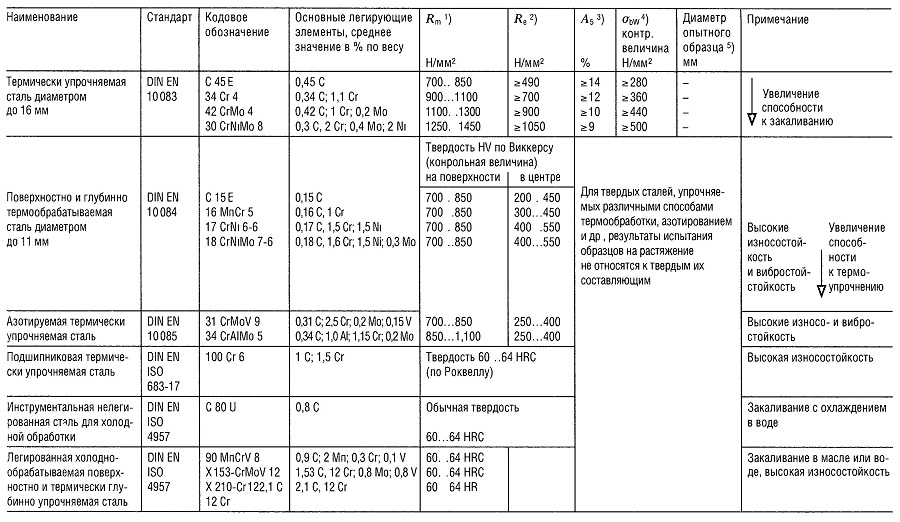
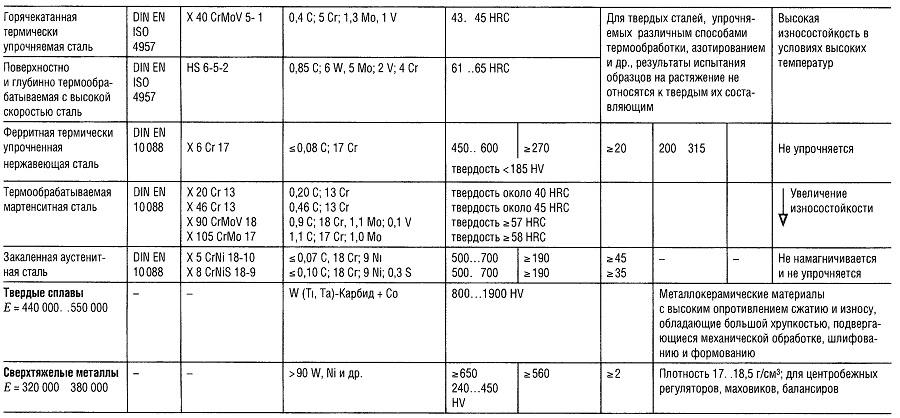
- Предел прочности на растяжение
- Предел текучести (или Rp 0,2);
- Относительное удлинение образца при разрыве;
- Предел прочности на изгиб;
- Предел прочности на изгиб приведен для образца из литой стали;
- Предел усталости всех типов чугуна, зависит массы и сечения образца;
- Модуль упругости;
- Для серого чугуна модуль упругости уменьшается с увеличением напряжения растяжения и остается практически постоянным с увеличением напряжения сжатия.
Таблица «Свойства пружинной стали»
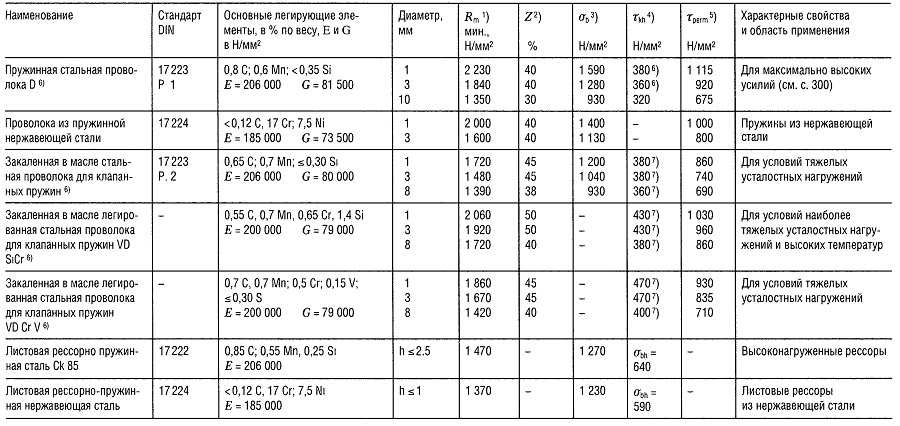
- Предел прочности на растяжение,
- Относительное уменьшение поперечного сечения образца при разрыве,
- Предел прочности на изгиб;
- Предел прочности при знакопеременном циклическом нагружении при N ⩾ 107,
- Максимальное напряжение при температуре 30°С и относительном удлинении 1 2% в течение 10 ч; для более высоких температур см. раздел «Способы соединения деталей»;
- 480 Н/мм2 для нагартованных пружин;
- Приблизительно на 40% больше для нагартованных пружин
Таблица «Свойства кузовных тонколистовых металлов»
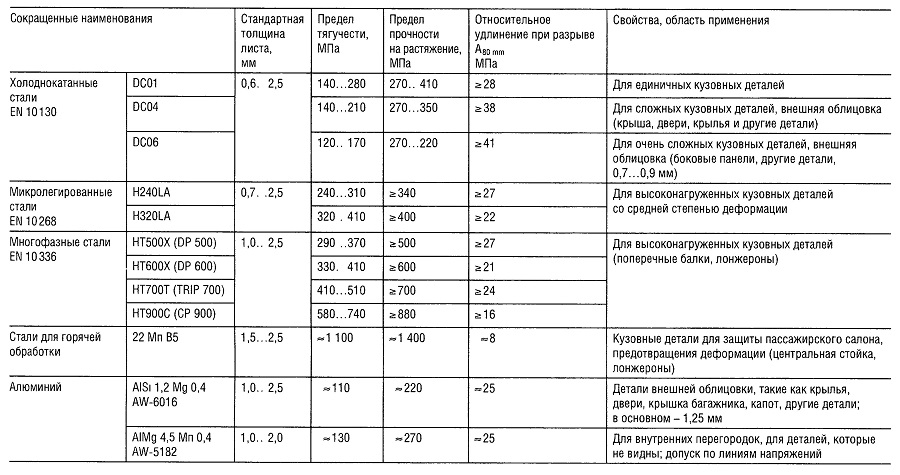
Таблица «Свойства цветных металлов»
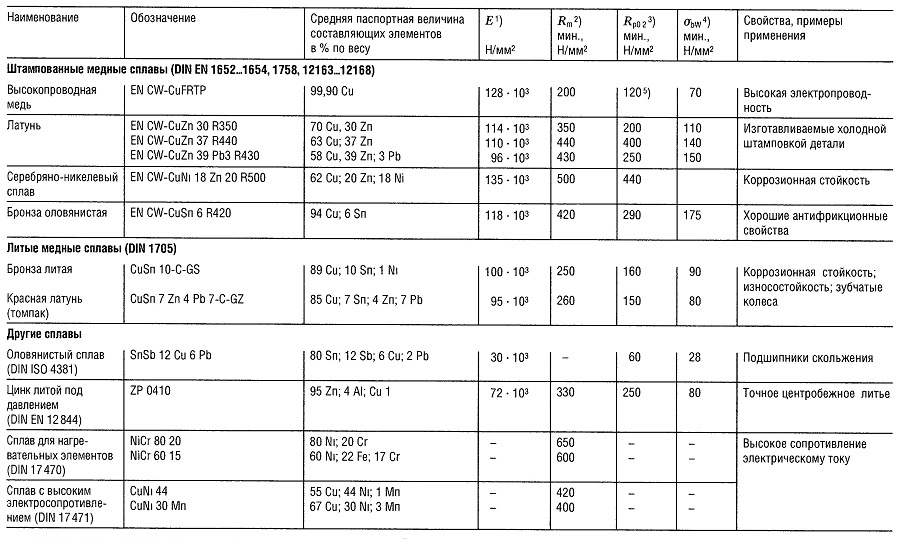
- Модуль упругости, справочные данные;
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Для отдельных образцов
Таблица «Свойства легких сплавов»
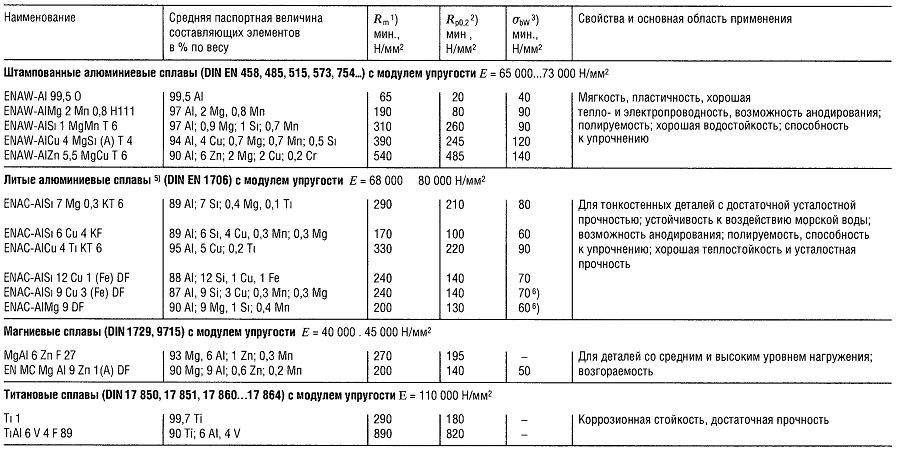
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Показатели прочности приведены для образцов и для отливок;
- Показатели предела прочности на изгиб приведены для случая плоского нагружения
Таблица «Металлокерамические материалы (PM)1) для подшипников скольжения»
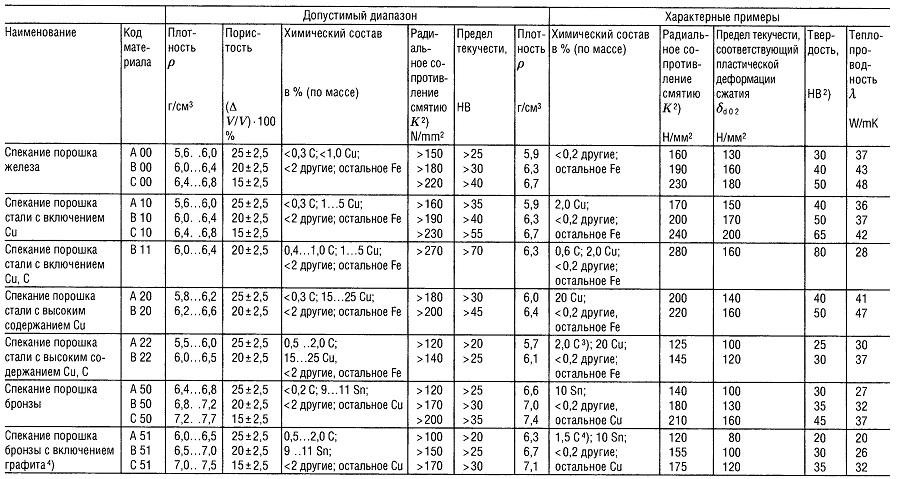
- В соответствии со стандартом DIN 30 910,1990 г. издания;
- Применительно к подшипнику 10/16 г 10;
- Углерод содержится, главным образом, в виде свободного графита;
- Углерод содержится только в виде свободного графита
Таблица «Свойства металлокерамических материалов (РМ)1 для конструкционных деталей»
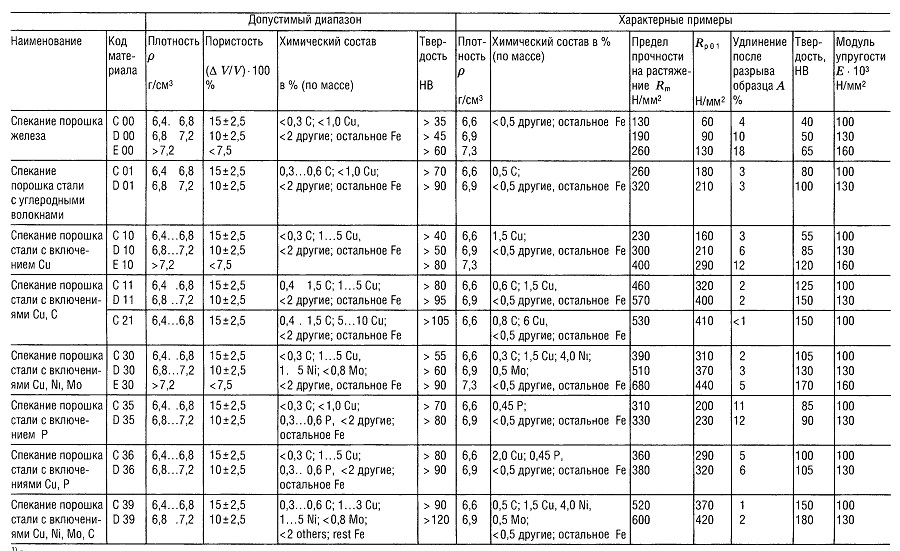
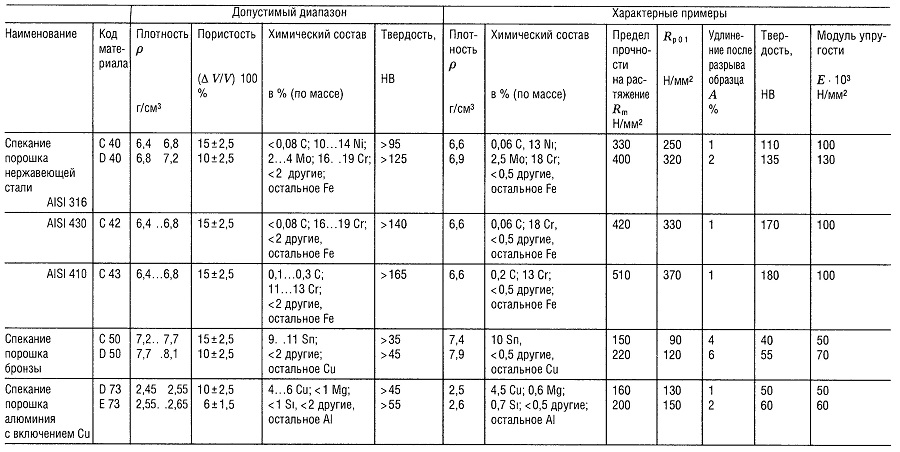
- В соответствии со стандартом DIN 30 910,1990 г. издания;
Магнитные материалы
Таблица «Свойства магнитомягких материалов»
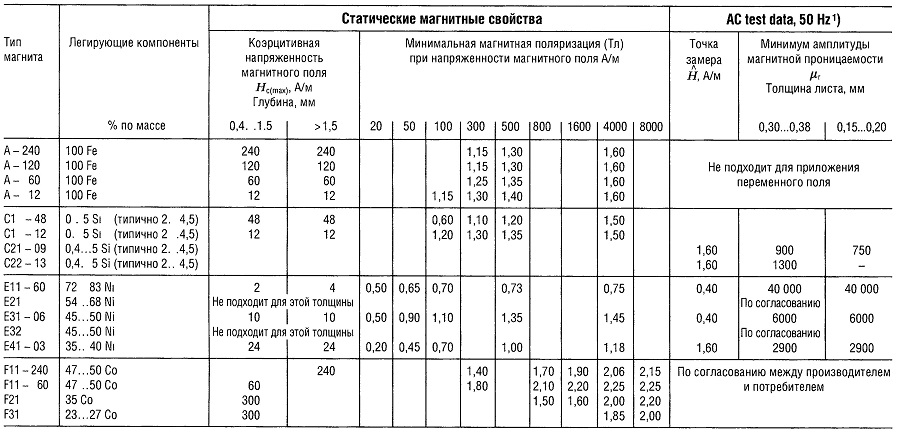
- Данные относятся только к магнитным кольцам.
Магнитомягкие металлы
Таблица «Свойства магнитной листовой и полосовой стали»
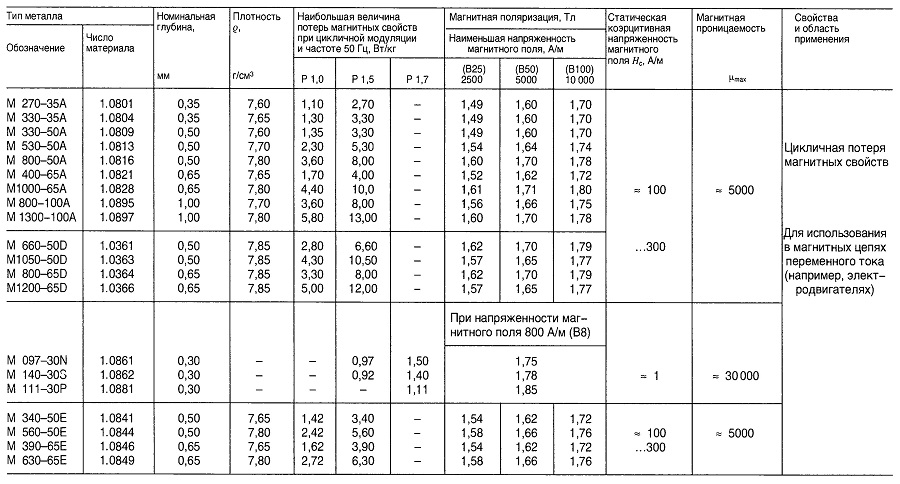
Материалы для преобразователей и электрических реакторов
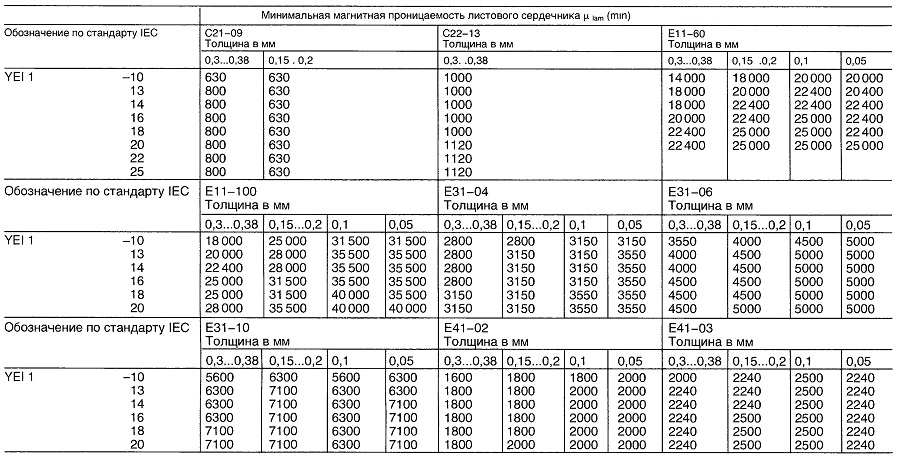
Магнитная проницаемость листового сердечника для классов сплавов С21, С22, Е11, Е31 и Е41 для секции тонколистового сердечника EY11
Материалы для реле постоянного тока
Таблица «Свойства материалов для реле постоянного тока»
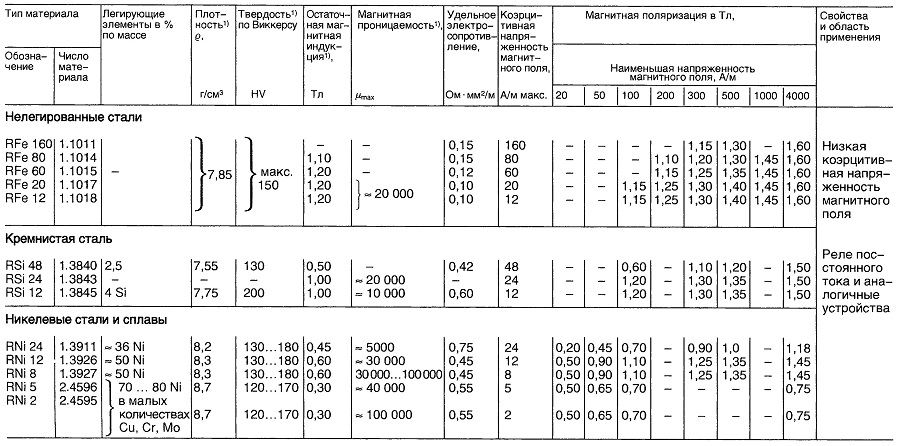
- Нормируемые величины
Металлокерамические материалы для магнитомягких компонентов
Таблица «Свойства металлокерамических материалов для магнитомягких компонентов»
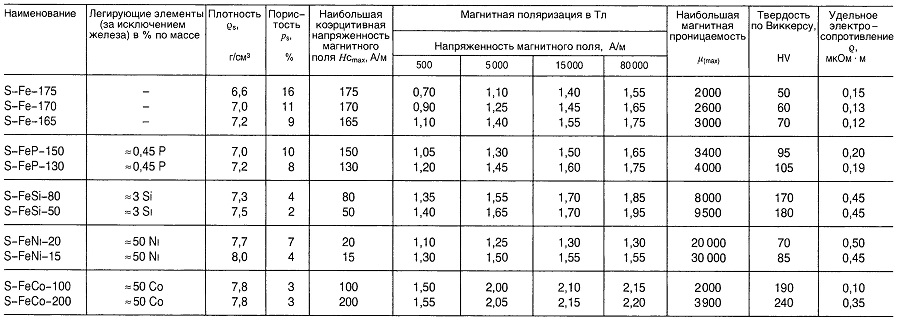
Магнитомягкие ферриты
Таблица «Свойства магнитомягких ферритов»

- Нормируемые величины;
- Потеря материалом магнитных свойств в зависимости от частоты при низкой плотности магнитного потока (В < 0,1 мТл);
- Потери магнитных свойств при высокой плотности магнитного потока; замеряются предпочтительно при f = 25 кГц, В = 200 мТл, Θ = 100°С;
- Магнитная проницаемость при строго синусоидальном магнитном поле; замеряется при f<; 25 кГц, В = 320 мТл, Θ = 100°С;
- Температура Кюри Θс, при которой начальная магнитная проницаемость μ, снижается ниже 10% от значения при температуре 25°С;
- Нормируемые величины.
Материалы для постоянных магнитов
Таблица «Свойства материалов для постоянных магнитов»
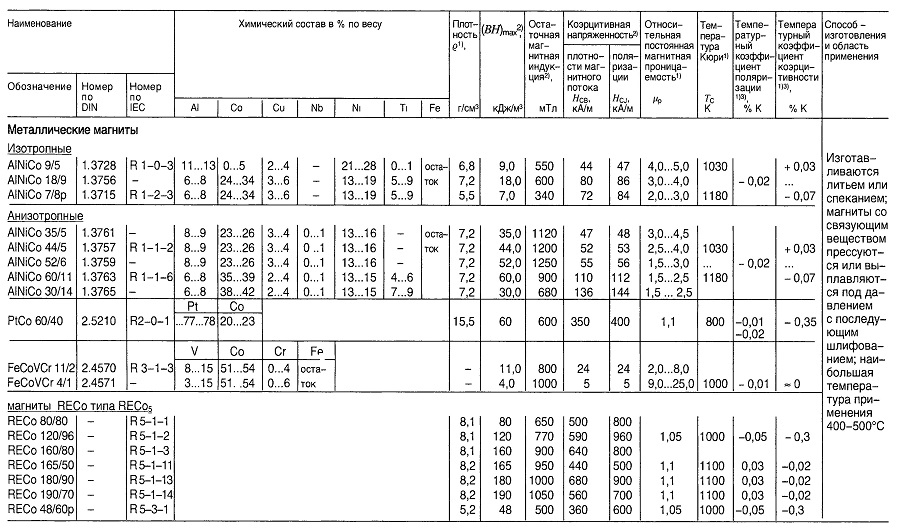
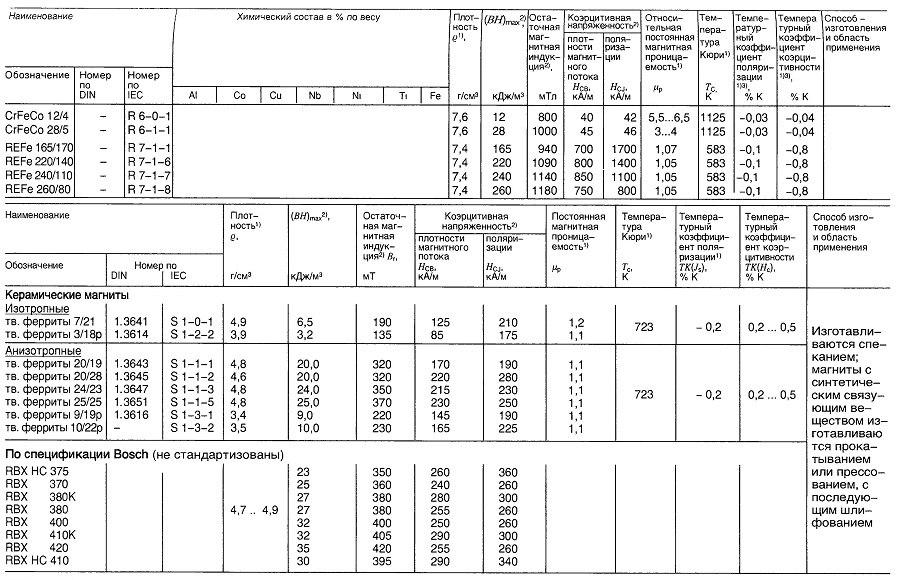
- Нормируемые величины;
- Наименьшее значение;
- В диапазоне температур 273…373 К.
Сравнение материалов для постоянных магнитов и магнитомягких ферритов
Таблица «Диапазон магнитных характеристик некоторых широко используемых кристаллических материалов»
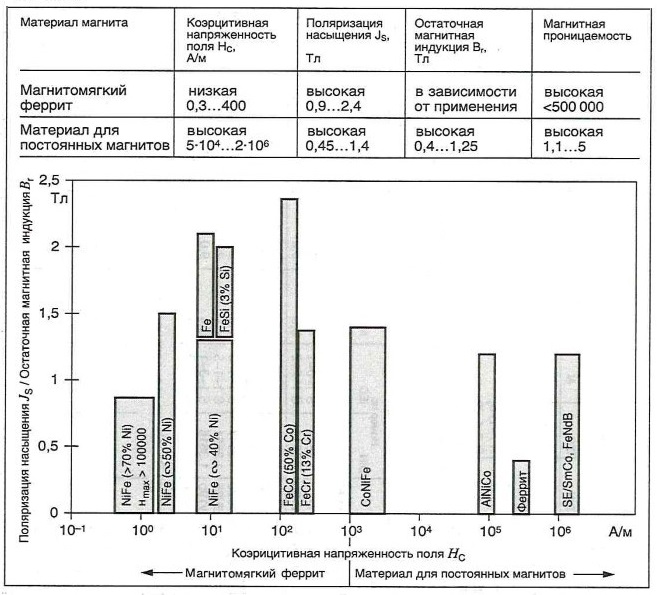
Материалы для пайки
Таблица «Свойства материалов для пайки»
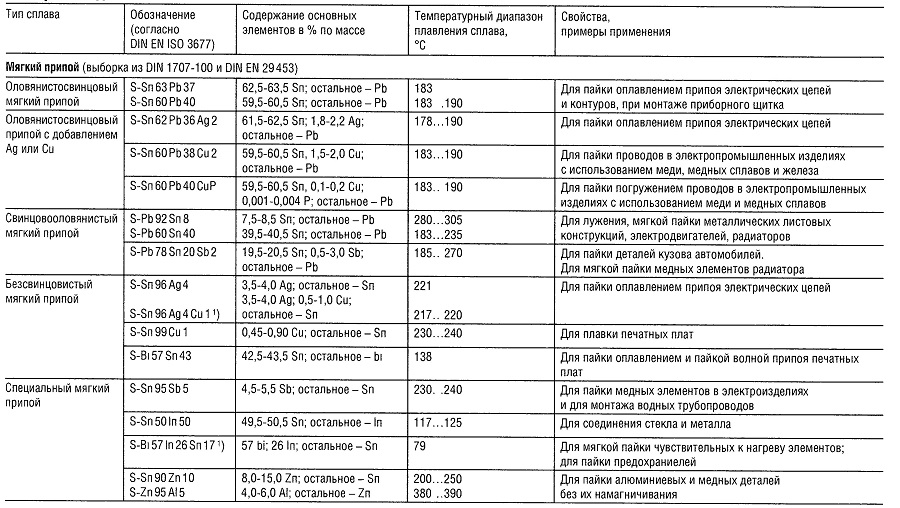
- Нет перечисленных в DIN 1707-100 или DIN EN 29453
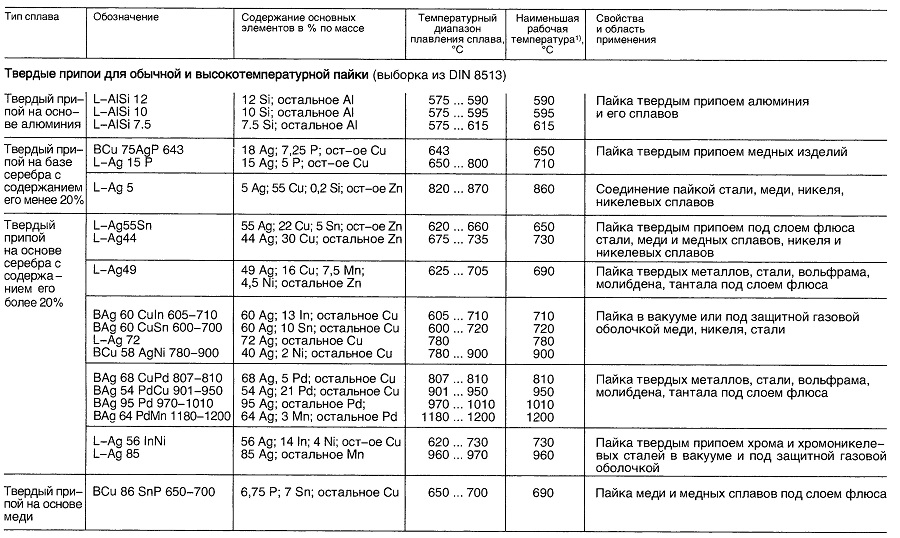
- В зависимости от выполняемой операции.
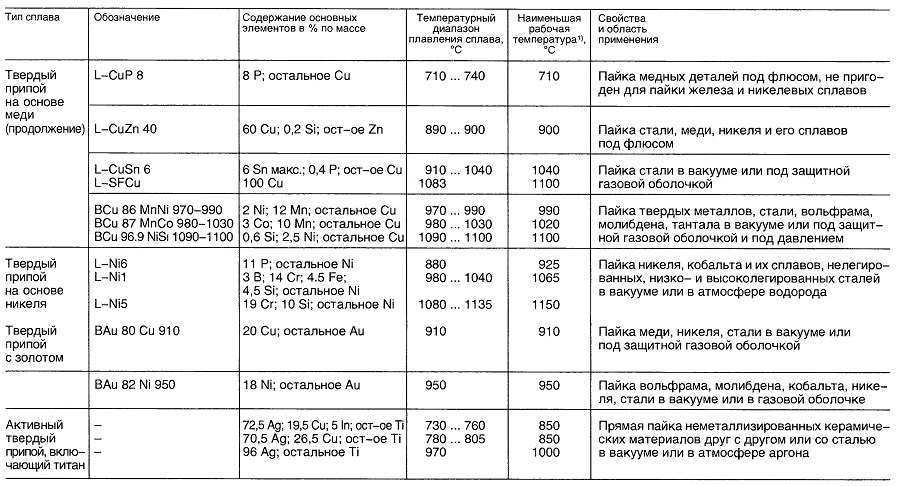
- В зависимости от выполняемых операций
В следующей статье я расскажу о бензине и дизельном топливе.
РЕКОМЕНДУЮ ЕЩЁ ПОЧИТАТЬ:
Источник
