Какие физические свойства имеют основания

ОПРЕДЕЛЕНИЕ
Основания называются электролитами, при диссоциации которых из отрицательных ионов образуются только ионы (
mathrm{OH}
):
(
mathrm{Fe}(mathrm{OH}) 2 leftrightarrow mathrm{Fe} 2++2 mathrm{OH}-
);
(
mathrm{NH} 3+mathrm{H} 2 mathrm{O} rightarrow mathrm{NH} 4 mathrm{OH} leftrightarrow mathrm{NH} 4++mathrm{OH}-
).
Все неорганические основания классифицируются на водорастворимые (щелочи) – (
mathrm{NaOH}
), (
mathrm{KOH}
) и нерастворимые в воде (
(mathrm{Ba}(mathrm{OH}) 2, mathrm{Ca}(mathrm{OH}) 2)
). В зависимости от их химических свойств среди оснований выделяются амфотерные гидроксиды.
Химические свойства оснований
Когда индикаторы действуют на растворы неорганических оснований, их цвет меняется, так что, когда база попадает в раствор, лакмусовая бумажка приобретает синий цвет, метиловый оранжевый становится желтым, а фенолфталеин становится малиновым.
Неорганические основания способны реагировать с кислотами с образованием соли и воды, а нерастворимые в воде основания взаимодействуют только с водорастворимыми кислотами:
(
mathrm{Cu}(mathrm{OH}) 2 downarrow+mathrm{H} 2 mathrm{SO} 4=mathrm{CuSO} 4+2 mathrm{H} 2 mathrm{O}
);
(
mathrm{NaOH}+mathrm{HCl}=mathrm{NaCl}+mathrm{H} 2 mathrm{O}
).
Водонерастворимые основания термически нестабильны, то есть при нагревании они разлагаются с образованием оксидов:
(
2 mathrm{Fe}(mathrm{OH}) 3=mathrm{Fe} 2 mathrm{O} 3+3 mathrm{H} 2 mathrm{O}
);
(
mathrm{Mg}(mathrm{OH}) 2=mathrm{MgO}+mathrm{H} 2 mathrm{O}
).
Alkalis (водорастворимые основания) взаимодействуют с кислотными окислами с образованием солей:
(
mathrm{NaOH}+mathrm{CO} 2=mathrm{NaHCOZ}
).
Alkalis также способны вступать в реакцию взаимодействия (IDR) с некоторыми неметаллами:
(
2 mathrm{NaOH}+mathrm{Si}+mathrm{H} 2 mathrm{O} rightarrow mathrm{Na} 2 mathrm{SiO} 3+mathrm{H} 2 uparrow
).
Некоторые основания вступают в обменные реакции с солями:
(
(0 mathrm{H}) 2+mathrm{Na} 2 mathrm{S} 04=2 mathrm{NaOH}+mathrm{BaSO} 4downarrow
).
Амфотерные гидроксиды (основания) также обладают свойствами слабых кислот и реагируют с щелочами:
(
mathrm{Al}(mathrm{OH}) 3+mathrm{NaOH}=mathrm{Na}[mathrm{Al}(mathrm{OH}) 4]
).
Амфотерные основания включают алюминий, гидроксиды цинка. хром (III) и другие
Физические свойства оснований
Большинство оснований – это твердые вещества, которые характеризуются разной растворимостью в воде. Алкалис – водорастворимые основания – чаще всего твердые вещества белого цвета. Водонерастворимые основания могут иметь разные цвета, например, гидроксид железа (III) представляет собой коричневое твердое вещество, гидроксид алюминия представляет собой белое твердое вещество, а гидроксид меди (II) представляет собой синее твердое вещество.
Получение оснований
Базы получают по-разному, например, реакцией:
– обмен
(
mathrm{CuSO} 4+2 mathrm{KOH} rightarrow mathrm{Cu}(mathrm{OH}) 2 downarrow+mathrm{K} 2 mathrm{SO} 4
);
(
mathrm{K} 2 mathrm{CO} 3+mathrm{Ba}(mathrm{OH}) 2 rightarrow 2 mathrm{KOH}+mathrm{BaCO} 3downarrow
);
– взаимодействие активных металлов или их оксидов с водой
(
2 mathrm{Li}+2 mathrm{H} 2 mathrm{O} rightarrow 2 mathrm{LiOH}+mathrm{H} 2
);
(
mathrm{BaO}+mathrm{H} 20 rightarrow mathrm{Ba}(mathrm{OH}) 2 downarrow
);
– электролиз водных растворов солей
(
2 mathrm{NaCl}+2 mathrm{H} 20=2 mathrm{NaOH}+mathrm{H} 2 uparrow+mathrm{Cl} 2 uparrow
).
Примеры решения проблем
ПРИМЕР 1
Рассчитать практическую массу оксида алюминия (выход целевого продукта составляет 92%) путем реакции разложения гидроксида алюминия массой 23,4 г
Напишите уравнение реакции:
(
2 mathrm{Al}(text { OH) } quad 3=mathrm{A} 1203+3 mathrm{H} 20
).
Молярная масса гидроксида алюминия, рассчитанная с использованием таблицы химических элементов D.I. Менделеева – 78 г / моль. Найдите количество вещества гидроксида алюминия:
(
mathrm{v}(mathrm{Al}(mathrm{OH}) 3)=mathrm{m}(mathrm{Al}(mathrm{OH}) 3) / mathrm{M}(mathrm{Al}(mathrm{OH}) 3)
);
(
mathrm{v}(mathrm{Al}(mathrm{OH}) mathrm{Z})=23,4 / 78=0,3
) моль.
Согласно уравнению реакции (
mathrm{v}(mathrm{Al}(mathrm{OH}) text { 3): } mathrm{v}(mathrm{Al} 2 mathrm{O} 3)=2 : 1
), поэтому количество вещества оксида алюминия будет:
(
mathrm{v}(mathrm{A} | 2 mathrm{O} mathrm{Z})=0,5 times mathrm{v}(mathrm{Al}(mathrm{OH}) 3)
);
(
mathrm{v}(mathrm{Al} 2 mathrm{O} mathrm{3})=0,5 times 0,3=0,15
) моль.
Молярная масса оксида алюминия, рассчитанная с использованием таблицы химических элементов D.I. Менделеева – 102 г / моль. Найти теоретическую массу оксида алюминия:
(
mathrm{M}(mathrm{Al} 2 mathrm{O} 3) mathrm{th}=0,15 times 102=15,3 mathrm{г}
)
Тогда практическая масса глинозема:
(
mathrm{m}(mathrm{Al} 2 mathrm{O} 3) mathrm{pr}=mathrm{m}(mathrm{Al} 2 mathrm{O} 3) mathrm{th} times 92 / 100
);
(
mathrm{M}(mathrm{Al} 2 mathrm{O} 3) mathrm{np}=15,3 times 0,92=14 mathrm{г}
)
Ответ Масса глинозема – 14 г.
ПРИМЕР 2
Выполнение серии преобразований:
(
mathrm{Fe} rightarrow mathrm{FeCl} 2 rightarrow mathrm{Fe}(mathrm{OH}) 2 rightarrow mathrm{Fe}(mathrm{OH}) 3 rightarrow mathrm{Fe}(mathrm{NO} 3) mathrm{Z}
)
Раствор Для получения хлорида железа из железа необходимо растворить его в соляной кислоте:
(
mathrm{Fe}+2 mathrm{HCl} rightarrow mathrm{FeCl} 2+mathrm{H} 2 uparrow
).
Чтобы получить соли железа (II) и соли железа (II), необходимо воздействовать на эту соль щелочью:
(
mathrm{FeCl} 2+2 mathrm{NaOH} rightarrow mathrm{Fe}(mathrm{OH}) 2+2 mathrm{NaCl}
).
Чтобы получить гидроксид железа (III) из гидроксида железа (II), необходимо уменьшить его железо:
(
4 mathrm{Fe}(mathrm{OH}) 2+2 mathrm{H} 2 mathrm{O}+mathrm{O} 2 rightarrow 4 mathrm{Fe}(mathrm{OH}) 3 downarrow
).
Чтобы получить соль железа (III) из гидроксида железа (III), необходимо обработать осадок гидроксида железа (III) соответствующей кислотой:
(
mathrm{Fe}(mathrm{OH}) 3+3 mathrm{HNO} 3 rightarrow mathrm{Fe}(mathrm{NO} 3) quad 3+3 mathrm{H} 20
).
Источник
К основаниям относятся сложные вещества, в составе которых всегда присутствует атом металла и гидроксильная группа OH (таких групп в молекуле основания может быть несколько). С точки зрения теории электролитической диссоциации основаниями считаются электролиты, которые при их нахождении в растворе воды диссоциируют на катионы металлического элемента и анионы гидроксильной группы (OH-).
Основания часто называют гидроксидами.
Способы получения и химические свойства оснований в значительной степени зависят от физических особенностей: агрегатного состояния, температуры кипения, плавления.
Получение оснований
Популярные способы получения щелочей (растворимых оснований):
- Щелочи образуются из 10 металлов группы щелочных и щелочноземельных: Li, Na, K, Ca, Rb, Sr, Cs, Ba, Fr, Ra. Их легко запомнить по таблице Менделеева (короткий вариант): от франция по литий – девятиэтажный дом, в котором нам нужны только розовые блоки (s-элементы), а от радия по кальций – семиэтажный. Эти металлы отличаются высокой химической активностью и очень бурно взаимодействуют с водой, особенно натрий. Поэтому их хранят в специальных местах, надежно защищенных от воздействия влаги.
2Na + 2HOH → 2NaOH + H2↑
В результате реакции образовались едкая окись натрия и водород, который вылетает в воздух.
Формулу воды в таких уравнениях лучше представить в виде записи HOH, а не H2O.
Это облегчает составление уравнений химических реакций и делает их запись более наглядной, а также лучше отображает сущность происходящих процессов.
- Десять активных металлов из первой и второй групп (перечислены выше) образовывают щелочные оксиды. Они в свою очередь взаимодействуют с водой и соединяются с ней.
CaO + HOH → Ca(OH)2
В результате реакции образовалась щелочь – кальций гидроксид.
- Последний способ получения растворимых оснований – электролиз раствора многих солей, которые образуют щелочные либо щелочноземельные металлы и бескислородные кислоты (кроме плавиковой).
NaCl + H2O → NaOH + Cl2↑ + H2↑
После электролиза в воздух выделяются водород и хлор, а в емкости остается окись натрия.
Для получения нерастворимых оснований на соли воздействуют щелочами:
Cu(NO3)2 + 2KOH → Cu(OH)2↓ + 2KNO3
В результате реакции на дно пробирки выпадает голубой осадок (двухвалентный гидроксид меди) и образуется растворимая соль – нитрат калия.
Этим же способом можно получить и растворимые основания, например:
К2СО3 + Ва(ОН)2 → 2КОН + ВаСО3
Физические свойства
В зависимости от способности растворяться в воде основания могут быть растворимыми или нерастворимыми.
Растворимые основания иначе называется щелочами. Малорастворимые гидроксиды также классифицируются как щелочи.
Их растворы можно охарактеризовать как «мыльные» и весьма едкие.
Гидроксиды, образуемые щелочными металлами, обычно являются твердыми веществами белого цвета с кристаллической структурой. Они очень чувствительны к воздействию влаги даже в виде водяных паров. Эти вещества имеют относительно низкие температуры плавления.
Гидроксиды, в молекулах которых присутствуют атомы щелочноземельных металлов, – твердые порошкообразные вещества белого цвета. В воде они растворяются, хотя их растворимость хуже, чем у оснований, образуемых щелочными металлами.
Нерастворимые основания также представляют собой твердые вещества. При помещении в воду они образуют гелеобразный осадок, который со временем постепенно разлагается. Цвет гидроксидов, не растворяющихся в воде, бывает разным. К примеру, Cu(OH)2 имеет синюю окраску, а Fe(OH)3 – красно-коричневую.
Химические свойства
Первое, что нужно знать, – идентификация щелочей от других веществ. Например, если будет задание такого типа: «В двух пробирках содержится кислота и основание. Определите, где щелочь, а где кислота». Для решения таких заданий существуют качественные реакции. У кислот и оснований — действие индикаторов.
Щелочи изменяют цвет индикаторов:
| Наименование индикатора | Цвет в нейтральной среде | Цвет в щелочной среде |
|---|---|---|
| Метиловый оранжевый | оранжевый | желтый |
| Лакмус | фиолетовый | синий |
| Фенолфталеин | бесцветный | малиновый |
Пожалуй, наиболее показательным является изменение цвета фенолфталеина – с бесцветного на малиновый. Это легко запомнить с помощью простой рифмованной фразы: «Фенолфталеиновый в щелочах малиновый». В остальных средах (кислотной, водной) он бесцветный.
Основные химические свойства
- Растворимые основания вступают в реакцию с оксидами:
● Кислотными (щелочи тяготеют к противоположным кислотам).
Ca(OH)2 + CO2 → CaCO3 + H2O
Реакция проходит как с угольной кислотой, соответствующей диоксиду углерода, – H2CO3.
Угольная кислота весьма неустойчива, из водных растворов ее выделить нельзя. Поэтому ее принято записывать в виде СО2 + Н2О.
● Амфотерными.
2NaOH + Al2O3 → 2NaAlO2 + H2O
Al2O3 – оксид, которому соответствует метаалюминиевая кислота HAlO2
● С оксидами, которые классифицируются как основные, они не взаимодействуют.
- Основания вне зависимости от своего состояния (жидкое или твердое) вступают в реакцию нейтрализации с кислотами, образуя соль и воду.
KOH + HCl → KCl + H2O;
Fe(OH)2+H2SO4 → FeSO4 + H2O.
- Щелочи могут взаимодействовать с солями. Реакция пойдет до конца в следующих случаях:
● Если выпадает осадок.
3NaOH + FeCl3 → Fe(OH)3↓ + 3NaCl;
В осадок упал гидроксид железа(III) и появилась обычная кухонная соль.
● Если выделяется газ.
NH4Cl + NaOH → NH3↑ + H2O + NaCl;
В воздух выделяется аммиак, так как образуется неустойчивый аммоний гидроксид.
- При нагревании нерастворимые основы разлагаются на оксид, который соответствует им по валентности, и воду.
Cu(OH)2 → CuO↓ +H2O;
Окись меди представляет собой черный порошок.
- Амфотерные основания взаимодействуют с:
● Щелочами.
Al(OH)3 + NaOH → Na[Al(OH)4];
Происходит реакция присоединения с образованием комплексной соли натрий тетрагидроксоалюмината.
● Кислотами. В результате взаимодействия образуется соль и вода.
Al(OH)3 + 3HCl → AlCl3 +3H2O;
- Нерастворимые гидроксиды при значительном нагревании начинают разлагаться. Это относится к слабым основаниям.
2Al(OH)3 → Al2O3 + 3H2O.
В данном примере гидроксид алюминия распадается на амфотерный оксид Al2O3 и воду.
В заключение еще раз подчеркнем, что щелочи получают с помощью 10 активных металлов, их оксидов и электролизом. Нерастворимые основания – реакцией между солью и одним из десяти гидроксидов. Основания изменяют цвета индикаторов, вступают в реакцию с кислотами, оксидами, солями. К тому же слабые основания термически неустойчивы.
Тест по теме «Свойства и получение оснований»
Источник
Мы с Вами рассмотрели в предыдущих темах оксиды их свойства и получение и теперь плавно переходим к гидроксидам. На проверку знаний свойств гидроксидов нацелено 8 задание ЕГЭ по химии, ну и, конечно, вторая часть заданий ЕГЭ также может содержать хитрые вопросы, требующие знаний специфических реакций и свойств оснований.
Итак, давайте с вами вспоминать, что такое основания в принципе. Основания – это соединения, состоящие из атомов металла, связанных с одной или несколькими гидроксогруппами. (примерами могут служить гидроксид натрия, гидроксид бария, гидроксид железа)
Название основания складывается из слова гидроксид и названия металла в родительном падеже
Физические свойства оснований
Гидроксиды при комнатной температуре представляют собой твердые вещества. Делятся на малорастворимые, нерастворимые и растворимые в воде. Растворимые в воде сильные основания – это щелочи. Обладают мылкостью, разъедают ткани и кожу. Растворимым основанием также является гидроксид аммония.
Получение оснований.
- Взаимодействие активного металла с водой. При этом происходит образование щелочи и водорода
- Взаимодействие основного оксида (оксидов щелочного или щелочноземельного металла) с водой.
- Взаимодействие растворимого основания с солью. Образуется нерастворимое основание ( к примеру гидроксид аммония вступает в реакцию с сульфатом железа с образованием гидроксида железа и сульфата аммония.)
Химические свойства
- Взаимодействие с кислотами. Основания вступают в реакции с кислотами с образованием соли и воды.
- Взаимодействие оснований с кислотными оксидами. Гидроксиды реагируют с ангидридами кислот с образованием соли и воды.
- Взаимодействие с солями. С солями вступают в реакцию растворимые основания с образованием нового основания и соли с выпадением одного из веществ в осадок.
- Изменение цвета индикаторов. Лакмус щелочи окрашивают в синий цвет, фенолфталенин в малиновый, а метилоранж в желтый.
- Разложение при повышении температуры (нагревании). Нерастворимые основания при нагревании разлагаются на воду и основный оксид.
Амфотерные гидроксиды
Амфотерные гидроксиды – гидроксиды, проявляющие основные и кислотные свойства. Вступающие в реакцию и с кислотами и с щелочами. Проявление основных свойств выражается в реакциях гидроксидов с кислотами с образованием соли и воды, а проявление кислотных свойств выражается в реакциях с щелочами также с образованием соли и воды.
Амфотерные гидроксиды практически нерастворимы в воде (а это значит, что соответствующие им оксиды с водой не реагируют). Кислотные и основные свойства как правило выражены слабо (нивелируют друг друга). К амфотерным гидроксидам ЭГП относятся гидроксиды бериллия, олова, свинца, алюминия к примеру.
Важное замечание: амфотерные гидроксиды растворимы в растворах щелочей, а это значит, что для получения таких гидроксидов ни в коем случае не берем избыток щелочей. В противном случае у нас в ходе обменной реакции щелочи и соли амфотерный гидроксид попросту растворится.
Мы с вами рассмотрели основные свойства гидроксидов элементов главных подгрупп и общие свойства и получение гидроксидов, а теперь давайте рассмотрим гидроксиды элементов побочных подгрупп.
Титан. Титан в степени окисления +4 в виде гидроксида проявляет амфотерные свойства (есть титановая кислота). Одна из форм титановой кислоты растворяется в щелочи и образует соли титанаты.
Цирконий. Гидроксид четырехвалентного циркония также амфотерен и подобно титану растворяется в щелочи, образуя цирконаты.
Хром. Гидроксид хрома трехвалентный – амфотерный гидроксид имеет соли в катионной форме и в анионной форме. Остальные модификации хрома образуют исключительно анионные формы.
Марганец. Элемент проявляет степени окисления от +2 до + 7 и каждая имеет свои характерные особенности. Так марганец в степени окисления + 2 образует слабое основание, а вот четырехвалентный марганец образует амфотерный гидроксид, образующий соли манганиты. Марганец в других степенях окисления не образует гидроксидов.
Железо. Образует слабое основание – двухвалентный гидроксид железа с признаками амфотерности, но с преобладанием основных свойств. А вот гидроксид железа в трехвалентном состоянии – этотипичное амфотерное соединение с небольшим преобладанием основных свойств.
Медь. Двухвалентный гидроксид меди также проявляет амфотерные свойства и подобно двухвалентному гидроксиду железа основные свойства преобладают над кислотными. Образование купратов возможно только при действии на гидроксид меди концентрированным раствором щелочи.
Цинк. Образует типично амфотерный гидроксид. С растворами кислот образует соль и воду, а с раствором щелочей образует цинкаты.
Надеемся, цель данной статьи послужить вам своеобразной памяткой и шпаргалкой достигнута. Более детальную информацию вы сможете получить уже непосредственно на занятиях с нашими преподавателями и сдать ЕГЭ на 90+. А значит открыть себе путь в любой престижный ВУЗ страны. В следующих статьях мы с вами рассмотрим кислоты и соли, разберем особенности кислородосодержащих кислот, рассмотрим соли различных элементов, познакомимся с частными случаями химических реакций различных солей.
Источник
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.

Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.

Рис. 1. Щёлочи в твёрдом состоянии.
Виды
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
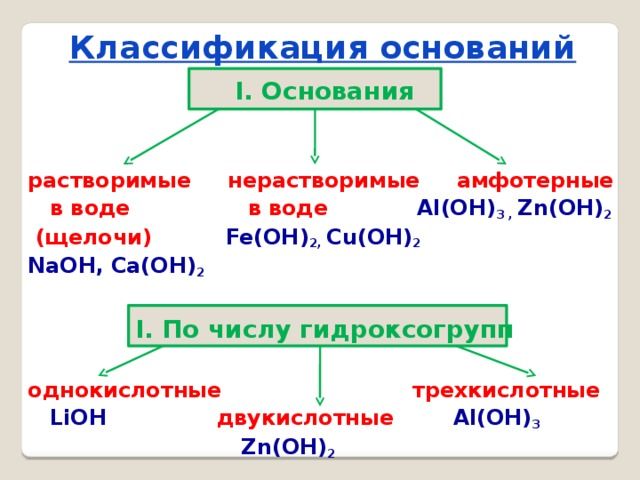
Рис. 2. Классификация оснований.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Na2O + H2O → 2NaOH.
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Химические свойства
Основные химические свойства оснований описаны в таблице.
Реакции | Что образуется | Примеры |
С кислотами | Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами | Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
Разложение при высокой температуре | Оксид металла и вода | 2Fe(OH)3 → Fe2O3 + 3H2O |
С кислотными оксидами (реагируют щёлочи) | Соль | NaOH + CO2 → NaHCO3 |
С неметаллами (вступают щёлочи) | Соль и водород | 2NaOH + Si + H2O → Na2SiO3 +H2↑ |
Обмена с солями | Гидроксид и соль | Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
Щелочей с некоторыми металлами | Сложная соль и водород | 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
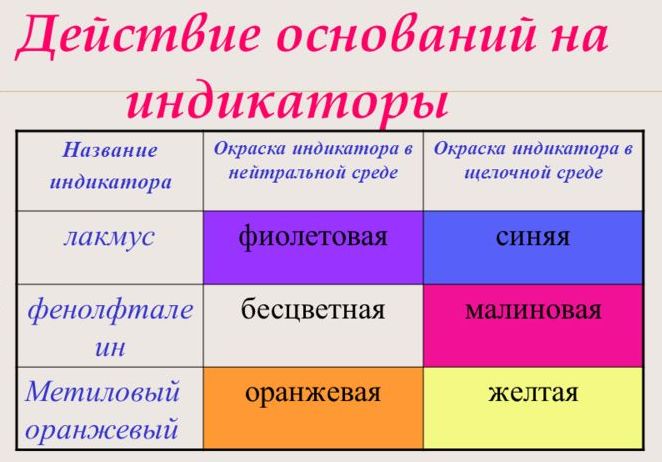
Рис. 3. Реакция индикаторов на основания.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Мишлен Громов
10/10

Вика Мартынова
10/10

Ольга Хромцова
10/10

Лилия Швец
10/10

Наталья Чернова
10/10

Максим Макеев
10/10

Сергей Ефремов
8/10

Оля Вернер
9/10
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 1117.
Источник
