Какие физические свойства солей вы знаете

Соли принято делить на три группы – средние (NaCl), кислые (NaHCO3) и основные (Fe(OH)Cl). Кроме этого различают двойные (смешанные) и комплексные соли. Двойные соли образованы двумя катионами и одним анионом. Они существуют только в твердом виде.
Химические свойства солей
а) кислые соли
Кислые соли при диссоциации дают катионы металла (иона аммония), ионы водорода и анионы кислотного остатка:
NaHCO3 ↔ Na+ + H+ + CO32-.
Кислые соли – продукты неполного замещения атомов водорода соответствующей кислоты на атомы металла.
Кислые соли термически неустойчивы и при нагревании разлагаются с образованием средних солей:
Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O.
Для кислых солей характерны реакции нейтрализации со щелочами:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O.
б) основные соли
Основные соли при диссоциации дают катионы металла, анионы кислотного остатка и ионы ОН—:
Fe(OH)Cl ↔ Fe(OH)+ + Cl— ↔ Fe2+ + OH— + Cl—.
Основные соли – продукты неполного замещения гидроксильных групп соответствующего основания на кислотные остатки.
Основные соли, также, как и кислые, термически неустойчивы и при нагревании разлагаются:
[Cu(OH)]2CO3 = 2CuO + CO2↑ + H2O.
Для основных солей характерны реакции нейтрализации с кислотами:
Fe(OH)Cl + HCl ↔ FeCl2 + H2O.
в) средние соли
Средние соли при диссоциации дают только катионы металла (ион аммония) и анионы кислотного остатка (см. выше). Средние соли – продукты полного замещения атомов водорода соответствующей кислоты на атомы металла.
Большинство средних солей термически неустойчивы и при нагревании разлагаются:
CaCO3 = CaO + CO2;
NH4Cl = NH3 + HCl;
2Cu(NO3)2 = 2CuO +4NO2 + O2.
В водном растворе средние соли подвергаются гидролизу:
Al2S3 +6H2O ↔ 2Al(OH)3 + 3H2S;
K2S + H2O ↔ KHS + KOH;
Fe(NO3)3 + H2O ↔ Fe(OH)(NO3)2 + HNO3.
Средние соли вступают в реакции обмена с кислотами, основаниями и другими солями:
Pb(NO3)2 + H2S = PbS↓ + 2HNO3;
Fe2(SO4)3 + 3Ba(OH)2 = 2Fe(OH)3↓ + 3BaSO4↓;
CaBr2 + K2CO3 = CaCO3↓ + 2KBr.
Физические свойства солей
Чаще всего соли – кристаллические вещества с ионной кристаллической решеткой. Соли имеют высокие температуры плавления. При н.у. соли – диэлектрики. Растворимость солей в воде различна.
Получение солей
а) кислые соли
Основные способы получения кислых солей – неполная нейтрализация кислот, действие избытка кислотных оксидов на основания, а также действие кислот на соли:
NaOH + H2SO4 = NaHSO4 + H2O;
Ca(OH)2 + 2CO2 = Ca(HCO3)2;
CaCO3 + CO2 + H2O = Ca(HCO3)2.
б) основные соли
Основные соли получают путем осторожного добавления небольшого количества щелочи к раствору средней соли, либо действием солей слабых кислот на средние соли:
AlCl3 + 2NaOH = Al(OH)2Cl + 2NaCl;
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3↓ + CO2↑ + 2NaCl.
в) средние соли
Основные способы получения средних солей – реакции взаимодействия кислот с металлами, основными или амфотерными оксидами и основаниями, а также реакции взаимодействия оснований с кислотными или амфотерными оксидами и кислотами, реакции взаимодействия кислотных и основных оксидов и реакции обмена:
Mg + H2SO4 = MgSO4 + H2↑;
Ag2O + 2HNO3 = 2AgNO3 + H2O;
Cu(OH)2 + 2HCl = CuCl2 + 2H2O;
2KOH + SO2 = K2SO3 + H2O;
CaO + SO3 = CaSO4;
BaCl2 + MgSO4 = MgCl2 + BaSO4↓.
Примеры решения задач
Источник
Солями называются сложные соединения, в составе которых обязательно присутствуют атомы металла (или аммоний NH4+) и кислотные остатки.
Как атомов металла, так и кислотных остатков в молекуле соли может быть не только один, но и несколько. Вместо атомов металла могут присутствовать и более сложные катионные группы, такие как NH4+.
Согласно теории электролитической диссоциации, соли – это сложные вещества, которые в процессе диссоциации образуют катионы металла или аммония и анионы кислотного остатка.
Физические свойства солей
Соли представляют собой твердые кристаллические вещества (при нахождении в условиях нормальной температуры и давления). Кристаллы разных солей при этом могут различаться по форме.
Так, поваренная соль NaCl образует кристаллы в форме куба. Чтобы в этом убедиться, приготовим очень концентрированный раствор хлорида натрия. Для этого нальем в стакан теплую воду, добавим в него 2-3 столовые ложки соли и перемешаем до полного растворения. Часть раствора перельем в неглубокую тарелку и поставим в сухое прохладное место. Через несколько дней вода в тарелке испарится, и в посуде, где находился раствор, образуются кристаллы соли. Они будут иметь идеальную кубическую форму.
Если же концентрированный раствор поваренной соли налить в 2 стакана и поставить между ними пустую тарелку, опустив концы ленты из впитывающей ткани в стаканы, а ее середину положив в тарелку, можно наблюдать следующее явление. В ленту впитается солевой раствор, который достигнет ее средней части и начнет стекать в тарелку. Опыт следует продолжать несколько дней. Вода будет испаряться, вследствие чего образуются кристаллы соли. На ленте начнут образовываться и расти соляные сталактиты. Также велика вероятность, что прямо со дна тарелки примутся расти вверх сталагмиты из кристаллов поваренной соли. Так всего за несколько дней можно полностью пронаблюдать процесс, который в природных пещерах занимает многие столетия, а то и тысячелетия.
Соли различаются по степени растворимости их в воде. По этому критерию они условно подразделяются на:
- растворимые (в 100 г воды растворяется больше 1 г соли);
- малорастворимые (растворимость находится в пределах от 0,1 г до 1 г на 100 г воды);
- нерастворимые (в 100 г воды растворяется менее 0,1 г соли).
Например, всем хорошо знакомый хлорид натрия, или поваренная соль хорошо растворяется в воде, сульфат кальция CaSO4 относится к малорастворимым веществам, а карбонат кальция, из которого почти целиком состоит обычный мел, практически нерастворим.
Окраска солей очень разнообразна, но чаще всего они белые или бесцветные:
- чистые кристаллы хлорида натрия бесцветны,
- карбонат кальция белый,
- сульфид свинца PbS – черный,
- сульфид ртути HgS – красный,
- двухвалентные соли никеля зеленые,
- кристаллы перманганата калия, в быту часто называемого марганцовкой, – фиолетовые.
Для всех солей свойственны высокие температуры плавления и кипения. Поваренная соль плавится при температуре 801ºC, а закипает при 1413ºC, у сульфата калия K2SO4 эти значения еще выше: плавиться он начинает только при 1069 ºC, а точки кипения достигает при повышении температуры до 1689ºC.
При нахождении в нормальных условиях соли практически не проводят электрический ток, однако растворы большинства солей – отличные проводники электричества.
Химические свойства солей
Химические свойства разных солей могут существенно различаться. Это определяется прежде всего их составом и принадлежностью к определенному подклассу. Но все соли обладают и рядом общих свойств, характерных для этого класса химических соединений.
- В результате воздействия сильного нагревания происходит разложение большинства солей. При этом как правило образуются кислотный и основный оксиды, а бескислородные соли (состоящие из двух элементов) разлагаются на металл и неметалл.
CaCO3→CaO+CO2↑
2NaCl →2Na + Cl2↑ (в результате электролиза)
В случае, если реакции разложения подвергаются нитраты (соли азотной кислоты), наблюдается выделение свободного кислорода.
2Zn(NO3)2→2ZnO+4NO2+O2↑
2Hg(NO3)2→2Hg+4NO2+ O2↑
Кислород образуется также и при разложении перманганата калия.
2KMnO4→K2MnO4+MnO2+O2↑
В результате разложения оксосолей хлора происходит образование хлоридов и выделение кислорода.
KClO4→KCl+2O2↑
При разложении нитрита аммония образуются газообразный азот и вода.
NH4NO2→N2↑+2H2O
- Соли взаимодействуют с кислотами, в результате образуются новая соль и новая кислота. Такая реакция будет протекать при условии, что кислота является более сильной, чем соль, на которую она должна воздействовать.
2NaCl+H2SO4→Na2SO4+2HCl↑
Хотите увидеть фейерверк в стакане? Тогда налейте в него 50 мг этилового спирта и поместите на дно 40 мл концентрированной серной кислоты. Сделать это можно с помощью пипетки, которую следует опускать на самое дно емкости с кислотой. Должно образоваться два слоя с четко выраженной границей: вверху будет находиться спирт, а внизу – серная кислота. Затем в стакан бросим небольшое количество кристалликов перманганата калия. Когда они пройдут через спиртовой слой и окажутся на границе со слоем кислоты, то они начнут вспыхивать. Вспышки эти напоминают фейерверк. Дело в том, что после начала погружения марганцовки в серную кислоту начинается химическая реакция, в результате которой происходит образование марганцевого ангидрида Mn2O7:
2KMnO4 + H2SO4→Mn2O7 + K2SO4 + H2O.
Марганцевый ангидрид – буро-зеленая жидкость, являющаяся сильнейшим окислителем, которая поджигает в нашем примере небольшое количество этилового спирта.
- В результате взаимодействия соли с основанием образуется другая соль и другое основание.
Ba(OH)2+MgSO4→BaSO4↓+Mg(OH)2 (образующийся при этом сульфат бария выпадает в осадок)
- Соли могут взаимодействовать с другими солями, образуя новые соли.
NaCl+AgNO3→AgCl+NaNO3
Весьма интересный эффект можно наблюдать при взаимодействии нитрата свинца Pb(NO3)2 c хлоридом аммония (NH4Cl). Для проведения опыта потребуется налить в стакан емкостью 300 мл концентрированный раствор нитрата свинца и поместить в него кристалл хлорида аммония. Вскоре в стакане начнут появляться солевые кристаллы, которые будут постепенно расти. В процессе своего роста они все больше будут становиться похожими на растения, покрытые инеем. Происходящую при этом реакцию можно выразить следующим уравнением:
Pb(NO3)2+2NH4Cl→2NH4NO3+PbCl2.
Опыт
Вернемся из зимы в осень. Для него нам понадобится раствор все того же нитрата свинца (25 г соли на 100 мл подогретой воды), который после охлаждения следует осторожно залить в стакан с 5-7 кусочками дихромата аммония (NH4)Cr2O7. На кусочках дихромата аммония начнут появляться имеющие игольчатую форму кристаллы бихромата свинца. Они будут постепенно разрастаться и принимать причудливую форму, напоминающую очертания деревьев. Через несколько дней после начала опыта весь стакан будет заполнен «деревьями» в золотом осеннем уборе. При работе с дихроматом аммония необходимо соблюдать осторожность, так как это токсичное канцерогенное вещество. Особую опасность представляет вдыхание его пыли.
- Соли вступают в реакцию с металлами, которые в ряду активности расположены перед металлом, входящим в состав соли. В такой реакции предыдущий металл вытесняет последующий из солей, в составе которых он имеется. Образуются новая соль и новый металл.
2Al+Cr2(SO4)3→Al2(SO4)3+2Cr↓
Если поместить в пробирку кусок меди (он должен быть обезжиренным) и затем налить в нее небольшое количество раствора нитрата серебра AgNO3 с концентрацией 1:10, то несколько часов спустя на поверхности металла можно наблюдать скопление игольчатых кристаллов металлического серебра.
Cu+2AgNO3→Cu(NO3)2+2Ag↓
Таким способом можно получить настоящий драгоценный металл.
Способы получения солей
Существует ряд способов, с помощью которых могут быть получены соли. Они образуются в результате:
- взаимодействия определенных простых веществ (металла и неметалла):
2Na+Cl2→2NaCl;
- взаимодействия двух оксидов, один из которых является основным, или амфотерным, а другой – кислотным:
ZnO+SO3→ZnSO4 (реакция начинается при нагревании);
- реакции основного оксида с амфотерным:
Na2O+ZnO→Na2ZnO2;
- воздействия кислот на металлы:
2HCl+Fe→FeCl2+H2↑;
- реакции основного или амфотерного оксида с кислотой:
Na2O + 2HNO3→2NaNO3 +H2O;
- взаимодействия амфотерного оксида или основания со щелочью:
2NaOH+ZnO →Na2ZnO2+H2O,
2NaOH+Zn(OH)2→ Na2ZnO2+2H2O (обе реакции протекают при нагревании);
- реакции кислот с гидроксидами металлов:
Zn(OH)2+H2SO4→ZnSO4+2H2O;
- взаимодействия щелочи с другой солью:
ZnSО4+2NaOH→Na2SO4+Zn(OH)2↓;
- взаимодействия кислоты с другой солью:
2HCl+Na2S→2NaCl+Н2S;
- реакции двух солей друг с другом (одна из образующихся солей должна быть нерастворима и выпадать в осадок):
AgNO3+KCl→AgCl↓+KNO3.
Приведенный здесь перечень способов получения солей не следует рассматривать как исчерпывающий. Существуют и многие другие способы, которые зависят от того, какую именно соль требуется получить, а также к какому подклассу солей она относится.
Также следует отметить, что многие соли не обязательно получать химическим путем, их запасы находятся в природе в больших количествах и доступны для добычи. В частности, поваренная соль активно добывается со дна и берегов соленых озер, хотя почти все ее мировые запасы сосредоточены в водах океанов и морей, которые, как известно, покрывают около 71% поверхности Земли.
Тест по теме «Свойства и получение солей»
Источник
Каждый день мы сталкиваемся с солями и даже не задумываемся, какую роль они играют в нашей жизни. А ведь без них и вода была бы не такой вкусной, и пища не приносила бы удовольствия, и растения не росли, да и жизнь на земле не могла бы существовать, не будь в нашем мире соли. Так что же это за вещества и какие свойства солей делают их незаменимыми?
Что такое соли
По своему составу это самый многочисленный класс, отличающийся разнообразием. Еще в 19 веке химик Й. Верцелиус дал определение соли — это продукт реакции между кислотой и основанием, при которой водородный атом заменяется металлическим. В воде обычно соли диссоциируют на металл или аммоний (катион) и кислотный остаток (анион).

Получить соли можно следующими способами:
- путем взаимодействия металла и неметалла, в этом случае она будет бескислородная;
- при взаимодействии металла с кислотой получается соль и выделяется водород;
- металл может вытеснять другой металл из раствора;
- при взаимодействии двух оксидов — кислотного и основного (еще их называют оксидом неметалла и оксидом металла соответственно);
- при реакции оксида металла и кислоты получаются соль и вода;
- реакция между основанием и оксидом неметалла также дает соль и воду;
- с помощью реакции ионного обмена, при этом могут реагировать разные растворимые в воде вещества (основания, кислоты, соли), но протекать реакция будет, если образуется газ, вода или соли слаборастворимые (нерастворимые) в воде.
Только от химического состава свойства солей и зависят. Но для начала разберемся в их классах.
Классификация
В зависимости от состава выделяют следующие классы солей:
- по содержанию кислорода (кислородсодержащие и бескислородные);
- по взаимодействию с водой (растворимые, малорастворимые и нерастворимые).
Такая классификация отражает все многообразие веществ не полностью. Современная и наиболее полная классификация, отражающая не только состав, но и свойства солей, представлена в следующей таблице.
| Соли | |||||
|---|---|---|---|---|---|
| Нормальные | Кислые | Основные | Двойные | Смешанные | Комплексные |
| Водород полностью замещен | Атомы водорода замещены на металл не полностью | Группы оснований замещены на кислотный остаток не полностью | В составе два металла и один кислотный остаток | В составе один металл и два кислотных остатка | Сложные вещества, состоящие из комплексного катиона и аниона или катиона и комплексного аниона |
| NaCl | KHSO4 | FeOHSO3 | KNaSO4 | CaClBr | [Cu(NH3)4]SO4 |
Физические свойства
Как бы ни был широк класс этих веществ, но общие физические свойства солей выделить возможно. Это вещества немолекулярного строения, с ионной кристаллической решеткой.
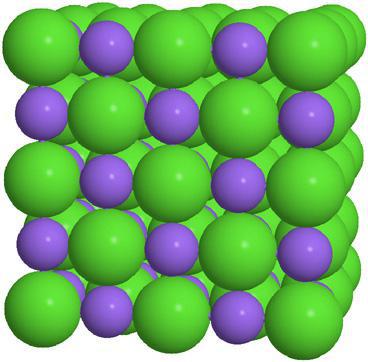
Очень высокие точки плавления и кипения. При нормальных условиях все соли не проводят электричество, но в растворе большинство из них прекрасно проводит ток.
Цвет может быть самым разным, он зависит от иона металла, входящего в ее состав. Сульфат железа (FeSO4) — зеленый, хлорид железа (FeCl3) — темно-красный, а хромат калия (K2CrO4) красивого ярко-желтого цвета. Но большинство солей все-таки бесцветные или белые.

Растворимость в воде также бывает различной и зависит от состава ионов. В принципе, все физические свойства солей имеют особенность. Они зависят от того, ион какого металла и какой кислотный остаток включены в состав. Продолжим рассматривать соли.
Химические свойства солей
Здесь тоже есть важная особенность. Как и физические, химические свойства солей зависят от их состава. А также от того, к какому классу они относятся.

Но общие свойства солей можно все-таки выделить:
- многие из них разлагаются при нагревании с образованием двух оксидов: кислотного и основного, а бескислородные — металла и неметалла;
- взаимодействуют соли и с другими кислотами, но реакция идет, только если в составе соли кислотный остаток слабой или летучей кислоты или в результате получается нерастворимая соль;
- взаимодействие со щелочью возможно, если катион образует нерастворимое основание;
- возможна реакция и между двумя разными солями, но только если одна из вновь образовавшихся солей не растворяется в воде;
- может происходить и реакция с металлом, но она возможна, только если брать металл, расположенный правее в ряду напряжения от металла, содержащегося в соли.
Химические свойства солей, относящихся к нормальным, рассмотрены выше, другие же классы реагируют с веществами несколько иначе. Но отличие идет только по продуктам на выходе. В основном все химические свойства солей сохраняются, как и требования к протеканию реакций.
Источник
Инфоурок
›
Другое
›Презентации›Соли. Физические свойства солей.
Описание презентации по отдельным слайдам:
1 слайд

Описание слайда:
Эпиграф урока
«Просто знать еще не все,
знания необходимо
еще использовать»
2 слайд

3 слайд

Описание слайда:
Действие фенолфталеина
№1 ?
№2 ?
основание
4 слайд

Описание слайда:
Действие метилоранжа
№1 кислота
№2 основание
№3 – ?
5 слайд

Описание слайда:
Угадайте вещество
Вещество, без которого невозможна жизнь растений, животных и человека.
Это химическое соединение необходимо для существования в крови эритроцитов, сокращения мышц, переваривания пищи в желудке.
В год каждый человек потребляет
от 3 до 5 кг. этого вещества.
4. Это вещество- символ гостеприимства
и радушия русской нации.
Говорят, чтобы узнать человека,
надо с ним пуд этого вещества съесть.
6 слайд

Описание слайда:
Тема урока:
Соли
7 слайд

Описание слайда:
Состав солей
NaCl K2S MgSO4
Соли –это сложные или простые вещества?
Проанализируйте состав солей.
Можно ли считать эти вещества производными кислот и оснований?
Сформулируйте определение данного класса соединений.
8 слайд

Описание слайда:
Соли – это сложные вещества, состоящие из ионов металлов и ионов кислотных остатков.
NaCl K2SO4 MgS
Какие виды ионов входят в состав солей?
Na
Cl
–
K
SO4
2-
S
2-
Mg
9 слайд

Описание слайда:
Алгоритм (№1) называния соли по формуле
Определить название кислотного остатка.
К названию соли добавить русское название металла в родительном падеже, указать в скобках римской цифрой степень окисления металла (если она непостоянна).
Название соли =
название кислотного ост-ка +
название металла (в родительном падеже)
+ с. о. металла(если она непостоянна).
10 слайд

Описание слайда:
Названия солей
ион кислотного остатка (в именительном падеже) с суффиксами:
– ид для безкислородной соли;
-ат для высшей степени окисления неметалла;
-ит для низшей степени окисления неметалла;
Al2S3 – сульфид алюминия
FeBr2 – бромид железа (II)
FeBr3 – бромид железа (III)
Na2S+6O4– сульфат натрия
Na2S+4O3 – сульфит натрия
Fe+2 (N+3O2)2 – нитрит железа (II)
Fe +3 (N+5O3) 3 – нитрат железа (III)
11 слайд

12 слайд

13 слайд

Описание слайда:
Алгоритм действий при составлении формулы
Составление формулы соли
Шаг 1
Шаг 2
Шаг 3
Шаг 4
1. Записать химические знаки металла и кислотного остатка, указать их заряды
Сa2+ PO43-
2. Найти наименьшее общее кратное значений зарядов
Сa2+ PO43-
2*3 = 6
3. Разделить полученное число:
а) на заряд металла и записать индекс справа внизу от знака металла;
б) на заряд кислотного остатка и записать индекс кислотного остатка
2*3 = 6
6 : 2 = 3 (индекс)
Сa2+3 PO43-
6 : 3 = 2 (индекс)
Сa2+3(PO43-)2
4. Проверка: произведение значения заряда металла на его индекс должно быть равно аналогичному произведению кислотного остатка
Сa2+3(PO43-)2
(2+) ∙ 3 = 6+
(3 -) ∙ 2 = 6 –
(6 +) + (6-)= 0
Порядок действий
Пример
13
14 слайд

Описание слайда:
Са
SO4
N03
PO4
S
CO3
Проверка
CaS СУЛЬФИД КАЛЬЦИЯ
CaSO4 СУЛЬФАТ КАЛЬЦИЯ
Проверка
Са3(PO4)2ФОСФАТ КАЛЬЦИЯ
Ca(NO3) 2 НИТРАТ КАЛЬЦИЯ
CaCO3 карбонат кальция
Тренажер «Соли кальция»
Составьте формулы солей, укажите зарядов ионов, назовите вещества.
Проверка
15 слайд

Описание слайда:
Физминутка
16 слайд

Описание слайда:
Физические свойства
Растворимые
NaCl
Поваренная соль
По растворимости в воде соли делят
(смотри таблицу растворимости):
Нерастворимые
CaCO3
Мел, мрамор, известняк
Малорастворимые
CaSO4
Безводный гипс
17 слайд

Описание слайда:
Лабораторная работа
«Физические свойства солей»
Название соли
Агрегатное состояние
Цвет
Растворимость
18 слайд

19 слайд

20 слайд

Описание слайда:
ДОСКА ПОЧЁТА
21 слайд

Описание слайда:
На дом:
§21, стр.107-110, №3
Подготовить сообщения о применении солей
22 слайд

Описание слайда:
Спасибо
за работу!
Всего доброго!

Курс профессиональной переподготовки
Педагог-библиотекарь

Курс повышения квалификации

Курс профессиональной переподготовки
Специалист в области охраны труда
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Проверен экспертом
Общая информация
Вам будут интересны эти курсы:
Оставьте свой комментарий
Источник
