Какие физико химические свойства белков позволяют их фракционировать
фракции
Методы фракционирования
белков основаны на их различиях в
растворимости в воде, изменении
гидродинамического радиуса, подвижности
в зависимости от молекулярной массы и
степени ионизации белковой молекулы.
К ним относятся такие методы, как
высаливание, осаждение органическими
растворителями и изоэлектрическое
осаждение. Как указывалось выше, белковая
молекула в растворе удерживается двумя
факторами – зарядом и гидратной
оболочкой. При устранении этих обоих
факторов устойчивости белки осаждаются.
По химическим и
физическим свойствам вода, входящая в
состав гидратной оболочки, отличается
от чистого растворителя. В частности,
температура замерзания ее составляет
–40°С. В этой воде хуже растворяются
сахара, соли и другие вещества. Растворы
белков отличаются крайней неустойчивостью,
и под действием разнообразных факторов,
нарушающих гидратацию, белки легко
выпадают в осадок. Поэтому при добавлении
к раствору белка любых водоотнимающих
средств (концентрированных растворов
нейтральных солей щелочных и
щелочноземельных металлов, органических
растворителей) наблюдается дегидратация
молекул белка и их выпадение в осадок.
На этом принципе основаны методы
высаливания и осаждения органическими
растворителями.
Высаливание.
Под действием концентрированных
растворов солей щелочных, щелочно-земельных
металлов и аммония (NaCl,
Na2SO4,
MgSO4,
(NH4)2SO4)
растворимость белков снижается, и они
выпадают в осадок. Этот процесс называют
высаливанием.
Так как растворимость белков различна,
то и способность к высаливанию зависит
от концентрации соли в растворе. Это
позволяет фракционировать белки, осаждая
их при различных концентрациях солей.
Постепенное увеличение концентрации
соли дает возможность получить ряд
отдельных фракций с преимущественным
содержанием в одной из них выделяемого
белка. Белки с наименьшей растворимостью
выпадают в осадок при небольшой
концентрации соли.
Процесс
высаливания в основном зависит от
гидрофобности белка. Типичная белковая
молекула имеет гидрофобные участки,
соприкосновение которых с водным
растворителем приводит к термодинамически
неустойчивому упорядочиванию структуры
воды. При внесении высокой концентрации
соли происходит сольватация ее ионов,
в результате чего остается мало свободных
молекул воды. Дальнейшее увеличение
концентрации соли ведет к отрыву
упорядоченных молекул воды от гидрофобных
боковых остатков аминокислот с обнажением
неполярных участков белковых молекул,
которые стремятся взаимодействовать
друг с другом. Белки, которые содержат
на своей поверхности большое количество
гидрофобных аминокислотных остатков,
при этом агрегируют и выпадают в осадок.
Белки с незначительным содержанием
неполярных остатков остаются в растворе
даже при его полном насыщении солью.
При
высаливании смеси белков часто имеет
место их соосаждение. Тем не менее многие
ферменты осаждаются из раствора в
достаточно узком диапазоне концентрации
соли, что делает эту процедуру
высокоэффективным методом фракционирования
белков.
На величину
высаливания белков оказывают влияние
не только природа и концентрация соли,
но и рН среды и температура. Катионы и
анионы нейтральных солей, как правило,
по-разному влияют на конформационную
стабильность белков. Считают, что главную
роль при этом играет валентность ионов
соли. Предложены лиотропные ряды катионов
и анионов:
Li+
Na+
K+
NH4+
Mg2+
SO42
CH3COO
Cl
NO3
CNS
Растворимость
белков может изменяться и при изменении
рН. Если самую высокую растворимость в
солевых растворах белки имеют при рН 7
(когда они содержат наибольшее число
заряженных групп), то наиболее полное
осаждение белка происходит вблизи его
изоэлектрической точки.
При выборе солей
исходят из их растворимости в воде при
низких температурах. Чаще всего используют
сульфат аммония, так как он обладает
несомненными преимуществами перед
другими нейтральными солями: он имеет
высокую высаливающую способность, не
вызывает денатурацию белков, хорошо
растворим в воде, при растворении
выделяется мало тепла, обладает низкой
стоимостью. Кроме того, концентрированные
растворы сульфата аммония имеют небольшую
вязкость и плотность, что немаловажно,
поскольку следующей стадией является
центрифугирование.
Таким
образом, основной причиной высаливания
является дегидратация макромолекул
белка с одновременной нейтрализацией
электрического заряда. К существенным
факторам, определяющим растворимость
белка, относят также поверхностное
натяжение на границе поверхности раздела
белок – вода.
Белки,
осажденные высаливанием, отделяют от
белков, оставшихся в растворе,
центрифугированием и вновь растворяют
в физиологическом растворе.
Осаждение
белков органическими растворителями.
Из органических растворителей наиболее
часто используются ацетон и этанол,
которые смешиваются с водой в любых
соотношениях. Добавление этих растворителей
к водным растворам белков приводит к
уменьшению диэлектрической проницаемости
растворителя и изменению конформации
белковых макромолекул. По мере возрастания
концентрации органических растворителей
снижается способность воды к сольватации
заряженных гидрофильных молекул белка.
Молекулы воды, расположенные упорядоченным
образом вокруг гидрофобных участков
на поверхности белка, могут быть замещены
молекулами органического растворителя.
Растворитель связывает воду, вызывая
дегидратацию молекул белка и неустойчивость
их в растворе. При этом происходит
агрегация молекул за счет электростатических
взаимодействий между противоположно
заряженными участками на поверхности
белков, что аналогично осаждению в
изоэлектрической точке.
Вблизи изоэлектрической
точки белков осаждение происходит при
более низкой концентрации органического
растворителя.
На осаждение белков
под действием органических растворителей
влияет также размер молекулы. Как
правило, чем ниже молекулярная масса
белка, тем выше концентрация органического
растворителя, необходимая для его
осаждения. Крупные молекулы агрегируют
быстрее, чем мелкие.
Осаждение
органическими растворителями проводят
при пониженной температуре (0°С). Низкая
температура не только предохраняет
белок от денатурации, но и усиливает
осаждающее действие растворителя.
При
осаждении этанолом
раствор белка должен быть нейтральным
или слабокислым, но не щелочным. Реакция
облегчается присутствием электролита
(например, хлористого натрия) вследствие
снятия заряда с частиц белка. Реакция
осаждения белка этанолом обратима при
низких температурах и кратковременном
действии.
Ацетон
обладает меньшим денатурирующим
действием, чем этанол, отчасти потому,
что при низкой температуре требуются
несколько более низкие его концентрации,
чтобы получить такое же осаждение, как
и при использовании этанола. Он также
более летуч, что позволяет легко удалять
его из растворенного осадка при пониженном
давлении.
Одним из преимуществ
фракционирования с помощью органических
растворителей является то, что его можно
проводить при температуре ниже 0°С, так
как все смешивающиеся с водой растворители
образуют смеси, замерзающие при
температуре значительно ниже 0°С. Это
предотвращает денатурирующее действие
органического растворителя, которое
становится заметным при температуре
выше +10°С.
Изоэлектрическое
осаждение белков. Большинство
ферментов хорошо растворимо при
физиологических концентрациях солей,
ионной силе 0,150,2
М и нейтральном значении рН.
Растворимость
можно рассматривать как результат
полярного взаимодействия растворенного
вещества с водным растворителем и ионных
взаимодействий его с присутствующими
солями, а также в некоторой степени как
результат электростатического
отталкивания между одноименно заряженными
молекулами или небольшими (растворимыми)
агрегатами молекул. В небольших агрегатах
сильные разноименные заряды
взаимопогашаются. Например, если
поверхность глобулы характеризуется
высокой гидрофобностью, то это значит,
что лишь малая ее часть взаимодействует
с растворителем и соответственно меньшее
число заряженных групп реагирует с
солями. Если заряд снижается до нуля,
электростатическое отталкивание
уменьшается и по мере приближения к
изоэлектрической точке молекулы
притягиваются друг к другу с образованием
крупных агрегатов (рис. 3.2). Этот процесс
называется изоэлектрическим
осаждением.
Следовательно, осаждаться из растворов
в изоэлектрической точке могут только
гидрофильные белки.
Рис. 3.2. Растворимость
белков вблизи изоэлектрической точки
Изоэлектрическая
точка(pI)
– это значение рН, при котором положительные
и отрицательные заряды белка полностью
скомпенсированы и суммарный заряд
молекулы равен нулю. Изоэлектрические
точки у разных белков разные, что
обусловлено их первичной структурой.
Для большинства белков изоэлектрическая
точка соответствует слабокислой среде
(рН ~ 5).
В смеси белков
ситуация осложняется соосаждением –
разные белки со сходными свойствами
агрегируют и осаждаются при достижении
изоэлектрической точки.
Вышеописанные
методы высаливания, осаждения белков
органическими растворителями и
изоэлектрического осаждения являются
способами
обратимого осаждения белков,
при которых белковые молекулы не
подвергаются денатурации и их осадки
могут быть снова растворены с сохранением
своих нативных свойств.
Однако
существуют способы
необратимого осаждения белков,
когда происходит глубокая денатурация
белка, при которой нековалентные связи
в белковой молекуле разрываются и
денатурированный белок не способен
восстановить свои первоначальные
свойства. К ним относятся денатурация
под действием температуры и путем
изменения рН. Эти методы используются
для избирательной
денатурации,
цель которой состоит в создании таких
условий, при которых выделяемый белок
не денатурирует, тогда как часть ненужных
белков осаждается под действием
денатурирующих агентов.
В
основе тепловой денатурации и денатурации
сильными органическими кислотами лежит
дегидратация белковых молекул. Для
основной массы белков температурный
режим находится в области 5060°С.
Важную роль при тепловой денатурации
играет ионная сила раствора, рН, его
солевой состав и время экспозиции. При
нагревании происходит разрыв дисульфидных
связей между полипептидными цепями,
что приводит к изменению конформации
белковых молекул.
При необратимом
осаждении белков сильными органическими
кислотами чаще используют растворы
трихлоруксусной и сульфосалициловой
кислот. Трихлоруксусная кислота способна
осаждать только белки и не осаждает
продукты их распада. В отличие от нее
сульфосалициловая кислота, являясь
более сильной кислотой, кроме белков
осаждает также продукты их распада
–высокомолекулярные пептоны и
полипептиды.
Обязательной
стадией, предшествующей выделению
индивидуального белка из обогащенной
фракции, является освобождение белковых
растворов от низкомолекулярных соединений
(сульфата аммония, органических
растворителей). Для этого используют
методы диализа и гель-фильтрации.
Диализомназывается
процесс разделения высокомолекулярных
и низкомолекулярных веществ с помощью
полупроницаемых мембран. При диализе
применяют полупроницаемые мембраны
(целлофан), диаметр пор которых варьирует
в широких пределах. Этот метод основан
на неспособности белков проходить через
полупроницаемую мембрану, которая легко
пропускает низкомолекулярные вещества.
Диффузия последних через мембраны
обеспечивается разностью концентраций
подлежащего удалению вещества в
исследуемом растворе и чистом растворителе,
находящихся по разные стороны мембраны.
Белковый раствор
помещают в целлофановый мешочек, который
погружают в чистый растворитель (воду,
физиологический или буферный раствор)
(рис. 3.3). Низкомолекулярные вещества
будут выходить из мешочка в растворитель
до тех пор, пока их концентрации по обе
стороны мембраны не станут равными. Для
ускорения диффузии рекомендуется
регулярно менять растворитель.
Рис. 3.3. Устройство
для диализа
Если осмотическое
давление в белковом растворе и растворителе
неодинаково, то по мере выхода из
диализного мешочка растворенного
вещества молекулы чистого растворителя
будут проникать внутрь мешочка (явление
осмоса), что приведет к разведению
белкового раствора.
Более
быстрым и эффективным методом обессоливания
белковых растворов служит гель-фильтрация
(гель-хроматография), которую используют
также для выделения индивидуального
белка и определения его молекулярной
массы. Гель-фильтрацией называется
процесс разделения высокомолекулярных
и низкомолекулярных веществ при помощи
гелей, основанного на различиях в размере
молекул. Принцип метода описан ниже
(см. п. 3.2.4).
При обессоливании
белковых растворов крупные молекулы
белков, минуя гранулы геля, двигаются
с наибольшей скоростью и выходят из
колонки первыми, а ионы соли, легко
проникающие внутрь гранул, задерживаются
ими и, двигаясь медленнее, выходят из
колонки последними.
Присутствие
сульфата аммония выявляют в пробе с
хлоридом бария по образованию осадка
сульфата бария.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
26.03.201510.87 Mб12Ген.план нового завода.pdf
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
После
достижения полной экстракции белков, т.е. перевода белков в растворенное
состояние, приступают к разделению – фракционированию смеси белков на
индивидуальные белки. Для этого применяют разнообразные методы: высаливание,
тепловую денатурацию, осаждение органическими растворителями, хроматографию,
электрофорез, распределение в двухфазных системах, кристаллизацию и др.
Растворение
белков в воде связано с гидратацией каждой молекулы, что приводит к образованию
вокруг белковой глобулы водных (гидратных) оболочек, состоящих из
ориентированных в определенной форме в пространстве молекул воды. По химическим
и физическим свойствам вода, входящая в состав гидратной оболочки, отличается
от чистого растворителя. В частности, температура замерзания ее составляет
–40°С. В этой воде хуже растворяются сахара, соли и другие вещества. Растворы
белков отличаются крайней неустойчивостью, и под действием разнообразных
факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому при
добавлении к раствору белка любых водоотнимающих средств (спирт, ацетон,
концентрированные растворы нейтральных солей щелочных металлов), а также под
влиянием физических факторов (нагревание, облучение и др.) наблюдаются
дегидратация молекул белка и их выпадение в осадок.
Высаливание. При
добавлении растворов солей щелочных и щелочноземельных металлов происходит
осаждение белков из раствора. Обычно белок не теряет способности растворяться
вновь в воде после удаления солей методами диализа или гельхроматографии.
Высаливанием белков обычно пользуются в клинической практике при анализе белков
сыворотки крови и других биологических жидкостей, а также в препаративной
энзимологии для предварительного осаждения и удаления балластных белков или
выделения исследуемого фермента. Различные белки высаливаются из растворов при
разных концентрациях нейтральных растворов сульфата аммония. Поэтому метод
нашел широкое применение в клинике для разделения глобулинов (выпадают в осадок
при 50% насыщении) и альбуминов (выпадают при 100% насыщении).
На величину
высаливания белков оказывают влияние не только природа и концентрация соли, но
и рН среды и температура. Считают, что главную роль при этом играет валентность
ионов. Действие разных ионов принято сравнивать не по молярной концентрации
соли, а по так называемой ионной силе (μ), которая равна
половине суммы произведений концентрации каждого иона (с) на квадрат его валентности (V):
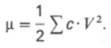
Более тонкое
разделение белков плазмы крови человека на фракции достигается при
использовании различных концентраций этанола при низкой температуре (от –3 до
–5°С) по методу Кона (рис. 1.2). В этих условиях белки сохраняют свои нативные
свойства. Указанным методом часто пользуются для получения отдельных фракций
крови, используемых в качестве кровезаменителей.
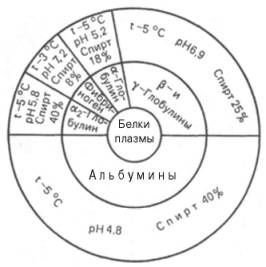
Рис. 1.2. Диаграмма фракционирования белков плазмы
крови человека этанолом (по методу Кона).
В последнее
время наибольшее распространение получили хроматографические и
электрофоретические методы разделения белков.
Хроматография. Принцип хроматографии, разработанный в 1903 г. русским
ученым М. С. Цветом, основан на способности пигментов (или любых других
окрашенных и неокрашенных веществ) специфически адсорбироваться на адсорбенте,
заключенном в колонке.
В результате
происходит разделение анализируемых веществ и их концентрирование в строго
определенном слое адсорбента. Затем через колонку пропускают подходящие
элюенты, которые ослабляют силы адсорбции и выносят с током раствора
индивидуальные вещества. Последние последовательно собирают в коллекторе
фракций (принцип сорбции-десорбции).
Чрезвычайно
эффективным средством фракционирования белков из смеси оказалась колоночная
хроматография с гидроксилапатитом, различными ионообменными смолами и производными
целллюлозы в качестве носителей. При выделении и очистке белков используют
четыре основных типа хроматографии: адсорбционную, распределительную,
ионообменную и аффинную (хроматография по сродству) – в соответствии с разными
физическими и химическими механизмами, лежащими в основе каждого из них.
Хроматография широко применяется не только для выделения белков, но и для
разделения множества других органических и неорганических веществ, входящих в
состав живых организмов.
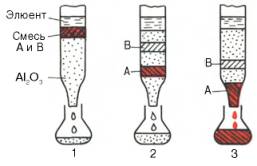
Адсорбционная хроматография. Разделение компонентов смеси (образца) основано на их
различной сорбируемости на твердом адсорбенте. В качестве адсорбентов
используют активированный древесный уголь, гель фосфата кальция, оксиды
алюминия или кремния. Адсорбент в виде суспензии с растворителем (чаще всего
буферным раствором) вносят в стеклянную вертикальную трубку (колонку) и
равномерно в ней упаковывают. Образец в небольшом объеме растворителя наносят
на колонку –

Рис. 1.3. Абсорбционнаяхроматография (схема). Разделение двух
разных веществ (А и В), перемещающихся по колонке с разной скоростью.
1 – нанесение
образца на колонку; 2 -середина опыта; 3 – окончание опыта.
компоненты
разделяемой смеси адсорбируются на адсорбенте. Затем приступают к стадии
освобождения – десорбции компонентов из колонки, применяя подходящие элюенты
(рис. 1.3). Сбор фракций осуществляют при помощи автоматического коллектора
фракций.
Распределительная хроматография. В отличие от адсорбционной твердая фаза служит только
опорой (основой) для стационарной жидкой фазы. Один из типов распределительной
хроматографии, как и адсорбционная, осуществляется на колонках, в которых в
качестве стационарной фазы применяют влажный крахмал или силикагель. Образец
растворяют в подходящем растворителе, затем наносят на колонку; разделяемые
вещества, подвергающиеся многократному распределению между неподвижной
стационарной фазой (водный слой) и движущейся фазой органического растворителя,
с разной скоростью перемещаются ко дну колонки. Собранные при помощи коллектора
фракции пробы, содержащие одно вещество, соединяют для выделения этого вещества
в чистом виде.
Разновидностью
распределительной хроматографии является хроматография на бумаге, широко
используемая в биохимических лабораториях, в том числе клинических, для
разделения пептидов, аминокислот и других веществ (рис. 1.4). В качестве
стационарной фазы при этом служит вода, адсорбированная целлюлозными цепями
фильтровальной бумаги. Образец помещают на одном конце бумажной полосы, этим же
концом бумагу погружают в подходящую смесь органических растворителей
(например, бутанол–уксусная кислота–вода в определенных соотношениях). При
движении растворителя по бумаге благодаря силе капиллярности происходит
разделение компонентов смеси. Проявленную хроматограмму высушивают, а
местоположение каждого из разделяемых веществ определяют химическими или
физико-химическими методами.
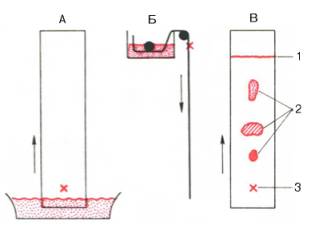
Рис. 1.4. Хроматография
на бумаге (схема).
А – восходящая
хроматография; Б – нисходящая хроматография (вид сбоку); В – хроматограмма с
разделенными и окрашенными веществами: 1 – фронт растворителя, 2 – разделенные
вещества, 3 – место нанесения образца.
Ионообменная хроматография. Ионообменные смолы являются полимерными органическими
соединениями, содержащими функциональные группы, способные вовлекаться в ионный
обмен. Различают положительно заряженные анионообменники, представленные
органическими основаниями и аминами, и отрицательно заряженные
катионообменники, содержащие фенольные, сульфо- или карбоксильные группы. Из
сильно- и слабоосновных анионообменников чаще используют производные
полистирола и целлюлозы, несущие функциональные группы:
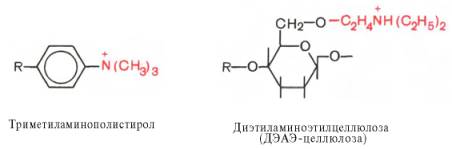
Аналогичные
функциональные группы содержат триэтиламиноэтил (ТЭАЭ)- и аминоэтил
(АЭ)-целлюлозы.
Катионообменники
представлены сульфонированными полистиролами (производные винилбензола или
дивинилбензола) и карбоксиметилцеллюлозой, имеющими следующие функциональные
группы:
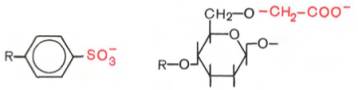
В зависимости
от заряда разделяемых белков используют подходящую ионообменную смолу, с
функциональными группами которой обменивается и задерживается на колонке часть
белков, в то время как другие белки беспрепятственно элюируются с колонки.
«Осажденные» на колонке белки снимают с колонки, применяя более
концентрированные солевые растворы или изменяя рН элюента.
Новейшие
методы ионообменной хроматографии, в частности высокоэффективная жидкостная
хроматография (ВЭЖХ), широко используются в фармакологии (при создании и
определении лекарственных веществ), в клинической биохимии (при определении
биологически активных веществ в физиологических жидкостях), в биотехнологических
процессах и производствах и других областях: они позволяют определять вещества
в нано-, пико- и фемтаграммных количествах.
Аффинная хроматография (хроматография по сродству). Основана аффинная хроматография на
принципе избирательного взаимодействия белков (или других макромолекул) с
закрепленными (иммобилизованными) на носителе специфическими веществами –
лигандами, которыми могут быть субстраты или коферменты (когда выделяют
какой-либо фермент), антигены (или антитела), гормоны или рецепторы и т. д. Благодаря
высокой специфичности белков к иммобилизованному лиганду, связанному с
носителем (которым заполняют хроматографическую колонку), присоединяется только
один какой-либо белок из смеси. Снятие с колонки этого белка осуществляют
элюированием буферными смесями с измененным рН или измененной
ионной силой, а также введением в состав элюента детергентов, ослабляющих связи
между белками и лигандами. Несомненным достоинством метода является возможность
одноэтапно выделить заданный белок или другой биополимер высокой степени
чистоты. При помощи аффинной хроматографии, например, удалось сравнительно
легко выделить очищенные препараты аминоацил-тРНК-синтетаз на
полиакрилгидразидагаровом геле, к которому в качестве лигандов были
присоединены определенные тРНК (транспортные РНК).
Гель-хроматография. В препаративных целях, особенно при очистке белков от
примесей, широко используют метод молекулярных сит, или гель-хроматографию. При
обработке эпихлоргидрином полисахарида дек-страна образуются различной
степени выраженности поперечные связи, приводящие к формированию крупных
гидрофильных зерен, нерастворимых в воде и называемых сефадексами. Благодаря
большому сродству к воде зерна сильно набухают в водной среде с образованием
геля, которым заполняют хроматографическую колонку. Разделение веществ этим
методом основано на том, что большие молекулы не проникают во внутреннюю водную
фазу геля, являющуюся стационарной, и остаются снаружи, двигаясь вместе с
подвижной фазой вниз вдоль колонки; небольшие молекулы, напротив, свободно
диффундируют внутрь зерен, образуя равновесную систему между подвижной и
стационарной фазами, и соответственно с меньшей скоростью двигаются вдоль
колонки (рис. 1.5). Обычно момент появления веществ в вытекающем из колонки с
сефадексом элюенте выражают формулой:
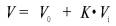
где V – объем элюирующей жидкости вещества с
данным К, мл; V0 – свободный объем колонки
или общий объем внешнего растворителя (вне зерен геля), мл; Vi – объем растворителя внутри
геля, мл; K – коэффициент распределения для
растворенного вещества между растворителем внутри зерен геля и окружающим
растворителем. Если анализируемую пробу, содержащую одно растворенное вещество
с К = 1 и второе с К = 0, внести в колонку с сефадексом, то второе вещество
появится в элюирующей жидкости сразу после выхода из колонки V0
, а первое – только после выхода объема V0+ Vi.
Поскольку
молекулы белков, обладающие большими молекулярной массой и размерами, не
диффундируют внутрь зерен сефадекса, они первыми вымываются из колонки после
выхода свободного объема колонки V0, в
то время как все остальные вещества (включая низкомолекулярные примеси)
вымываются после выхода объема, равного V0+ К
• Vi.
Метод нашел
широкое применение в препаративной энзимологии. С помощью сефадекса можно
разделить белки с разной молекулярной массой.
Электрофорез. Метод свободного электрофореза, детально разработанный лауреатом
Нобелевской премии А. Тизелиусом, основан на различии в скорости движения
(подвижности) белков в электрическом поле, которая определяется
величиной заряда белка при определенных значениях рН и ионной силы раствора. В
последнее время более широкое распространение получили методы зонального
электрофореза белков на различных носителях, в частности на твердых
поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе. Преимущества
их по сравнению с методом свободного электрофореза состоят в том, что
исключается размывание границы белок-растворитель в результате диффузии и конвекции,
не требуется налаживания сложной аппаратуры для определения положения границы,
а для анализа необходимо небольшое количество белка (подробно эти методы и
соответствующая аппаратура рассматриваются в практических руководствах по
биохимии).
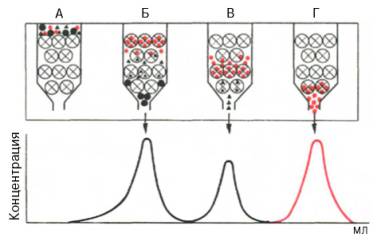
Рис. 1.5. Гель-хроматография на колонке с сефадексом
(схема).
Большие
светлые кружки с крестиками – зерна сефадекса; малые черные и красные кружки и
треугольники – белки с различной молекулярной массой; А – колонка в начале
работы; Б, В, Г – колонка в различные периоды времени. На графике элюции четко
видно разделение белковых компонентов.
Одним из наиболее
распространенных методов фракционирования белков (как и методов оценки
гомогенности) является диск-электрофорез (от англ. discontinuous
– прерывистый, перемежающийся) в полиакриламидном геле, при котором
используют пары буферных растворов с различными значениями рН и разной степени
пористости гель. Следует отметить высокую разрешающую способность
гель-электрофореза. Если при электрофорезе белков сыворотки крови человека на
бумаге открываются всего 6 фракций, то при электрофорезе в крахмальном геле – 10,
а в полиакрил-амидном геле – до 18 разных белковых фракций.
Для выявления
белков при электрофорезе в гелях их обрабатывают одним из следующих красителей:
бромфеноловым синим, амидо черным 10В, кислотным синим 83, кумасси
бриллиантовым голубым R-250 и др. Интенсивность
окраски и соответственно относительное содержание каждой белковой фракции
обычно определяют денситометрически путем прямого сканирования на денситометре.
В последние годы стали применять методы электрофореза белков с градиентом
концентрации геля, что значительно повышает разрешающую способность, особенно
при фракционировании белков с высокой молекулярной массой, превышающей 50000–
100000.
Весьма
перспективными методами разделения белков (как и определения ряда
физико-химических свойств) оказались разные варианты метода изоэлектрического фокусирования – изотахофореза, основанные на
проведении электрофореза в поддерживающих средах (на колонке или в тонком слое)
с градиентом рН. Точное местоположение на колонке каждого белка из смеси
определяется значением его изоэлектрической точки, т.е. состоянием, при котором
суммарный электрический заряд белковой частицы при данном значении рН равен
нулю. При использовании метода
изоэлектрического фокусирования применяют смеси синтетических
полиаминополикарбоновых кислот (амфолины) для создания градиента рН в диапазоне
от 3,0 до 10,0.
В последние
годы широкое распространение для фракционирования белков получили различные
сочетания изоэлектрофокусирования и диск-электрофореза в полиакриламидном геле
– методы двухмерного электрофореза, которые позоляют параллельно анализировать
сотни и даже тысячи белковых фракций.
Очистка белков
от низкомолекулярных примесей
Применение в
определенной последовательности ряда перечисленных методов позволяет получить
белок в очищенном состоянии, не лишенный, однако, некоторых примесей солей. Для
полного освобождения белков от низкомолекулярных примесей в настоящее время
используют методы диализа, гельхроматографии, кристаллизации, ультрафильтрации.
При диализе применяют полупроницаемые мембраны (целлофан, коллодийная пленка),
диаметр пор которых варьирует в широких пределах. Белки, как правило, не
диффундируют через такую мембрану, в то время как низкомолекулярные вещества
легко проникают через нее в окружающую среду.
Метод
кристаллизации белков основан на достижении критической точки начала осаждения
белка из раствора сульфата аммония при медленном повышении температуры. Уже
получены сотни кристаллических белков . Однако не всякий кристаллический белок
является гомогенным, поскольку при одной и той же концентрации раствора
сульфата аммония могут кристаллизоваться близкие по размерам и массе разные
белки.
Наилучшие
результаты при освобождении белков от низкомолекулярных примесей получают с
помощью гельхроматографии и ультрафильтрации. Последняя основана на
продавливании растворов белка через специальные мембраны, задерживающие
белковые молекулы, что позволяет не только освободить белковые растворы от
низкомолекулярных примесей, но и концентрировать их.
Источник
