Какие характеристики живого были связаны со свойствами белков

Белки – высокомолекулярные соединения, построенные из аминокислот и являются одними из наиболее сложных по строению и составу среди всех органических соединений.
Биологическая роль белков исключительно велика: они составляют основную массу протоплазмы и ядер живых клеток. Белковые вещества находятся во всех растительных и животных организмах. О запасе белков в природе можно судить по общему количеству живого вещества на нашей планете: масса белков составляет примерно 0,01% от массы земной коры, то есть 1016 тонн.
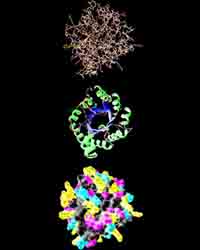 Молекулы белка
Молекулы белка
Белки по по своему элементному составу отличаются от углеводов и жиров: кроме углерода, водорода и кислорода они ещё содержат азот. Кроме того, Постоянной составной частью важнейших белковых соединений является сера, а некоторые белки содержат фосфор, железо и йод.
Свойства белков
1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы.
2. Гидролиз – под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот.
3. Денатурация – частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием:
- – высокой температуры
- – растворов кислот, щелочей и концентрированных растворов солей
- – растворов солей тяжёлых металлов
- – некоторых органических веществ (формальдегида, фенола)
- – радиоактивного излучения
Строение белков
Строение белков начали изучать в 19 веке. В 1888г. русский биохимик А.Я.Данилевский высказал гипотезу о наличии в белках амидной связи. Эта мысль в дальнейшем была развита немецким химиком Э.Фишером и в его работах нашла экспериментальное подтверждение. Он предложил полипептидную теорию строения белка. Согласно этой теории молекула белка состоит из одной длинной цепи или нескольких полипептидных цепей, связанных друг с другом. Такие цепи могут быть различной длины.
Фишером проведена большая экспериментальная работа с полипептидами. Высшие полипептиды, содержащие 15-18 аминокислот, осаждаются из растворов сульфатом аммония (аммиачными квасцами), то есть проявляют свойства, характерные для белков. Было показано, что полипептиды расщепляются теми же ферментами, что и белки, а будучи введёнными в организм животного, подвергаются тем же превращениям, как и белки, а весь их азот выделяется нормально в виде мочевины (карбамида).
Исследования, проведённые в 20 веке, показали, что существует несколько уровней организации белковой молекулы.
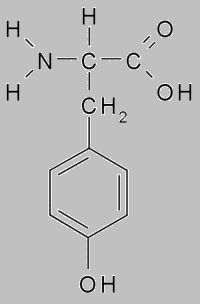 Белок тирозин
Белок тирозин
В организме человека тысячи различных белков и практически все они построены из стандартного набора 20 аминокислот. Последовательность аминокислотных остатков в молекуле белка называют первичной структурой белка. Свойства белков и их биологические функции определяются последовательностью аминокислот. Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков – инсулина. В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина. В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C254H337N65O75S6. Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками.
В настоящее время большая часть работы по определению первичной структуры белков автоматизирована. Так была установлена первичная структура фермента лизоцима.
Тип “укладки” полипептидной цепочки называют вторичной структурой. У большинства белков полипептидная цепь свёртывается в спираль, напоминающую “растянутую пружину” (называют “А-спираль” или “А-стуктура”). Еще один распространённый тип вторичной структуры – структура складчатого листа (называют “B – структура”). Так, белок шёлка – фиброин имеет именно такую структуру. Он состоит из ряда полипептидных цепей, которые располагаются параллельно друг-другу и соединяются посредством водородных связей, большое число которых делает шёлк очень гибким и прочным на разрыв.
При всём этом практически не существует белков, молекулы которых на 100% имеют “А-структуру” или “B – структуру”.
 Белок фиброин – белок натурального шёлка
Белок фиброин – белок натурального шёлка
Пространственное положение полипептидной цепи называют третичной структурой белкой. Большинство белков относят к глобулярным, потому что их молекулы свёрнуты в глобулы. Такую форму белок поддерживает благодаря связям между разнорзаряженными ионами (-COO- и -NH3+ и дисульфидных мостиков. Кроме того, молекула белка свёрнута так, что гидрофобные углеводородные цепи оказываются внутри глобулы, а гидрофильные – снаружи.
Способ объединения нескольких молекул белка в одну макромолекулу называют четвертичной стуктурой белка. Ярким примером такого белка может быть гемоглобин. Было установлено, что, например, для взрослого человека молекула гемоглобина состоит из 4-х отдельных полипептидных цепей и небелковой части – гема.
Свойства белков объясняет их различное строение. Большинство белков аморфно, в спирте, эфире и хлороформе нерастворимо. В воде некоторые белки могут растворяться с образованием коллоидного раствора. Многие белки растворимы в растворах щелочей, некоторые – в растворах солей, а некоторые – в разбавленном спирте. Кристаллическое состояние белов встречается редко: примером могут быть алейроновые зёрна, встречающиеся в клещевине, тыкве, конопле. Кристаллизуется также альбумин куриного яйца и гемоглобин в крови.
Гидролиз белков
При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, образуя в конце цепочки превращения смесь A-аминокислот. Такое расщепление называется гидролизом белка. Гидролиз белка имеет большое биологическое значение: попадая в желудок и кишечник животного или человека, белок расщепляется под действием ферментов на аминокислоты. Образовавшиеся аминокислоты в дальнейшем под влиянием ферментов снова образуют белки, но уже характерные для данного организма!
В продуктах гидролиза белков кроме аминокислот были найдены углеводы, фосфорная кислота, пуриновые основания. Под влиянием некоторых факторов например, нагревания,растворов солей, кислот и щелочей, действия радиации, встряхивания, может нарушиться пространственная структура, присущая данной белковой молекуле. Денатурация может носить обратимый или необратимый характер, но в любом случае аминокислотная последовательность, то есть первичная структура, остаётся неизменной. В результате денатурации белок перестаёт выполнять присущие ему биологические функции.
Для белков известны некоторые цветные реакции, характерные для их обнаружения. При нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание или качественная реакция на белок, которую можно провести дома). Биуретовую реакцию даёт вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует.
Ксантопротеиновая реакция заключается в том, что белок от концентрированной азотной кислоты окрашивается в жёлтый цвет. Эта реакция указывает на наличие в белке бензольной группы, которая имеется в таких аминокислотах, как фениланин и тирозин.
При кипячении с водным раствором нитрата ртути и азотистой кислоты, белок даёт красное окрашивание. Эта реакция указывает на наличие в белке тирозина. При отсутствии тирозина красного окрашивания не появляется.
Источник
Цель: актуализировать и углубить знания
учащихся об уникальных особенностях строения
молекул белка и ее свойствах.
Методы, используемые на уроке:
репродуктивные, частично-поисковые.
Задачи.
- Раскрыть особенности строения белков.
- Углубить знания учащихся об уникальных
особенностях строения молекулы белка. - Изучить химические свойства белков.
Структура урока:
I этап: организационный момент;
II этап: подготовка учащихся к активному
усвоению знаний;
III этап: изучение нового материала;
IV этап: закрепление;
V этап: итоги, д/з.
Оборудование: раствор куриного белка,
куриные перья, раствор фенола, спиртовка, спички,
зажим, пробирки, растворы: гидроксида натрия,
сульфата меди, нитрата свинца, концентрированная
азотная кислота.
Ход урока
I этап. Приветствие
II этап
Учитель приводит высказывание Ф.Энгельса о том,
что такое жизнь: “Жизнь есть способ
существования белковых тел, существенным
моментом которого является постоянный обмен
веществ с окружающей их внешней природой….
Причем при прекращении обмена веществ
прекращается и сама жизнь, что приводит к
разложению белка…”.
Ни одно из веществ не выполняет стль
специфических и разнообразных функций в
организме, как белок. В организме человека
имеется более 10 000 видов белков.
Тема нашего урока: Белки с различных точек
зрения.
III этап
. Изучение нового материала
Вопросы.
– Какие соединения называют белками? (Природные
полимеры, мономерами которых являются
аминокислоты)
– Изучение какого процесса помогло установить
строение белков? (Изучение гидролиза белков)
1. Самостоятельная работа учащихся с текстом и
рисунками учебника биологии.
Задание: найти в тексте информацию о том:
– Сколько типов белковых молекул, отличающихся
друг от друга, содержится в организме человека? (5
млн. типов белковых молекул)
– Сколько аминокислот входит в состав белка?
(Двадцать)
– Рассмотрите формулу аминокислоты и ответьте
на вопрос: “Почему аминокислоты являются
амфотерными соединениями? (Потому что содержит
одновременно аминогруппу и карбоксильную
группу, обладающие противоположными свойствами)
– Рассмолтрите схему образования дипептида.
Какие атомы образовали молекулу воды в
результате соединения двух аминокислот? (Водород
от аминогруппы и гидроксогруппа от
карбоксильной группы)
– Сколько уровней организации может иметь
белковая молекула? Назовите эти структуры.
Обсуждение материала учебника.
2. Работа с текстом учебника и рис. 1 по
заполнению таблицы “Структуры белковых
молекул”.
| Структура белковой молекулы | Характеристика структуры | Тип связи, определяющий структуры |
| Первичная | Последовательность аминокислот в полипептидной цепи | Пептидная связь между углеродом кислотной и азотом основной групп |
| Вторичная | Белковая молекула принимает вид спирали или складчатого слоя гармошки | Водородная связь между остатками карбоксильных и аминогрупп разных аминокислот |
| Третичная | Белковая спираль сворачивается и приобретает форму шарика или глобулы | Атомы серы двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи соединяются образуя так называемые дисульфидные связи |
| Четвертичная | Функциональное объединение нескольких молекул белка обладающих третичной структурной организацией. |
3. Составление схемы “Классификация белков”.
По составу
- Простые – протеины (состоят
только из аминокислот): альбумины, глобулины,
гистоны. - Сложные – протеиды (состоят из
аминокислот и небелковой составляющей):
фосфопротеиды, нуклеопротеиды, липопротеиды.
По функциям
- Структурные.
- Каталитические.
- Регуляторные.
- Транспортные.
- Защитные.
- Двигательные.
- Запасательные.
- Токсичные.
- Сигнальные.
По структуре
- Фибриллярные (коллаген).
- Глобулярные (ферменты и гормоны).
- Промежуточные (фибриноген).
4. Практическая работа по изучению химических
свойств белков (работа в парах по инструкциям с
предварительным повторением правил техники
безопасности)
Обсуждение амфотерности белков можно начать с
вопроса: аминокислоты – соединения амфотерные,
будет ли присуще это свойство белкам?
- Растворимость белков. Различная растворимость
белков в воде связана, прежде всего, с их
молекулярной массой. Растворимость в большей
степени зависит также от природы радикалов
аминокислотных звеньев. - Гидролиз белков – разрушение первичной
структуры. В лаборатории этот процесс проводится
в присутствии кислот и щелочей при нагревании. В
организме он проходит под действием ферментов. - Денатурация белков. Необратимая – полное
разрушение пространственной структуры белка.
Денатурация происходит под действием солей
тяжелых металлов, высокой температуры, излучения
– демонстрация видеофрагмента.
Обратимая денатурация – частичное разрушение
пространственной структуры белка. Обратный
процесс называется ренатурация.
- Цветные реакции белков.
Цветные реакции применяются для установления
белковой природы веществ, идентификации белков и
определение их аминокислотного состава в
различных биологических жидкостях. В
клинической лабораторной практике эти методы
используются для определения количества белка в
плазме крови, аминокислот в моче и крови, для
выявления наследственных и приобретенных
патологий обмена у новорожденных.
– Биуретовая реакция на пептидную связь;
– Ксантопротеиновая реакция.
- Горение белков. Учащиеся поджигают шерстяную
нитку и делают вывод.
Вывод. Денатурация приводит к нарушению
антигенной чувствительности белка, а иногда и к
полному блокированию ряда иммунологических
реакций, к инактивации ферментов и нарушению
обмена веществ. Ученые предполагают, что
процессы старения связаны с медленно
протекающей денатурацией. Реакция гидролиза
белков приводит к образованию аминокислот, из
которых в клетках организма образуются белки,
характерные для данного организма.
1. Знакомство с основными функциями белков.
Белки – основная структурная часть любого
живого организма, а также неотъемлемая часть
пищи животных и человека. При исключении из
рациона белкового компонента, несмотря на
достаточную калорийность пищи, у живых
организмов наблюдаются патологические явления:
остановка роста, изменение состава крови и т.д. С
чем же связано огромное значение белков для
живых организмов?
С сообщением “Функции белков в организме”
выступают учащиеся:
– каталитическая функция,
– защитная функция,
– строительная функция,
– сигнальная функция,
– транспортная,
– двигательная.
Вывод. приоритетная роль белков в клетке
объясняется многообразием их функций. Поэтому
они являются основой жизни.
Учащиеся составляют краткий конспект по
выступлениям.
Каталитическая функция белков. Опыт
проводит учитель.
Прилейте по 2 мл Н2О2 в пробирке с
кусочками мяса, картофелем (сырой, вареный).
Запишите наблюдаемые вами явления в таблицу.
Предлагает записать уравнение, выполненной
реакции.
Дайте объяснения вашим наблюдениям.
Что брали? Что делали? Что наблюдали?
Объяснения.
Вывод. При варке картофеля, мяса
произошла денатурация белка фермента каталазы,
разрушилась 3-ая структура белка и это привело в
разрушению активного центра фермента. Выделение
кислорода при действии Н2О2 на сырой
картофель и мясо свидетельствует о проявлении
каталитической функции белка – фермента
каталазы.
2Н2О2 = 2Н2О + О2
2. Выступление учащегося – превращение белков в
организме. В качестве дополнения слово
предоставляется специалистам врачебной
практики (учащиеся заранее готовят сообщения,
опираясь не только на учебную литературу, но и
через беседы с врачами – практиками районной
поликлиники).
Врач-генетик. Сообщение о том, что
генетическими болезнями страдают не только
жертвы этих болезней, но и их семьи. Родителей
часто мучает чувство вины.
Генетические консультации врачей генетиков
могут помочь супругам определить, на сколько
велик риск рождения у них больного ребенка.
В ряде случаев медико-генетические
консультации выявляют у новорожденных или у
грудных детей наследственное предрасположение к
наследственным болезням, возникновение которых
в очень сильной степени зависит от определенных
внешних условий.
Врач-эндокринолог. Сообщение о биохимии
опухолей желудочно–кишечного тракта и их
влиянии на процесс белкового обмена.
Врач-косметолог. Беды нашего организма
отражаются на коже, а особенно на коже лица –
самой уязвимой части тела.
Сообщение о влияние кремов на кожу.
Врач-невропатолог. Сообщение о том, что
эндокринная и нервная системы действуют
координировано, поддерживая постоянство
внутренней среды организма. Взаимодействие
между нервной и эндокринной системами
осуществляется в основном посредством
гипоталамуса. Оказывают стрессы, поэтому
здоровый образ жизни, снижение стрессов является
залогом здоровья.
Врач-терапевт. Белки в иммунной
системе.
Иммунная система – это самостоятельная
система организма, представленная своими
функциями и органами.
Основные функции иммунной системы:
1) распознать “чужое”, разрушить,
нейтрализовать, вывести из организма;
2) обеспечить препятствие внедрению и
размножению чужеродных антигенов;
3) Запомнить строение, свойства “чужого”,
быстрее встречать его как “чужое” и сохранять в
иммунологической памяти;
Начальные события в клеточном взаимодействии
включают два этапа:
Прямое физическое взаимодействие между
клетками, либо действие лиманда (антигена) –
этого белка на клетку. В результате следует
второй этап.
Синтез и секреция биологически активных
веществ на клетку-мишень. Это обеспечивает
формирование иммунных реакций. Белки в крови
обеспечивают защитные реакции организма.
Например, антитела участвуют в формировании
иммунных реакций. Тромбин обеспечивает
свертываемость крови. Иммунная система состоит
из В-системы и Т-системы, иначе происходят сбои в
реализации иммунных реакций. Пагубное влияние на
состояние иммунной системы оказывают внешние
условия (природно-климатические, промышленное
воздействие, изменение места жительства) и
факторы риска (алкоголь, наркотики, курение).
3. Новости из области синтезирования нового
вида белка – сообщение учителя.
США: учёные создали самоорганизующиеся белки.
Исследователи из университета Джона Хопкинса
(Johns Hopkins University) создали новый класс белков,
которые способны самостоятельно собираться в
гель.
Этот гель представляет собой
макромолекулярные белковые сети, погружённые в
воду. При добавлении белков в ёмкость их
подключение к растущей сети происходит
автоматически, за счёт специальных концевых
молекул-модулей, обеспечивающих стыковку.
Эти концевые модули могут быть трёх разных
видов, и “сконструированы” так, чтобы
притягивать друг друга. Так что каждая молекула в
сети соединена с тремя соседями.
В середине нового искусственного белка учёные
научились размещать произвольный набор
аминокислот, способных выдавать определённые
биохимические сигналы живым клеткам. В
частности, это сигналы для поощрения
дифференциации и роста клеток нужного типа.
Эта работа, как рассчитывают американцы,
поможет найти новые методы восстановления
повреждённых (или больных) тканей человека.
IV этап урока:
закрепление
пройденного материала
Для закрепления новых понятий проводится
логический брифинг. Учащимся в течение 3-х мин.
необходимо заполнить таблицу.
Другие названия белка.
Мономеры белка.
Группы атомов, обуславливающие амфотерные
свойства белков.
Связь, поддерживающая I структуру белков.
Структура белка, представляющая спираль.
Полное разрушение пространственных структур
белков.
Реакция, лежащая в основе получения белков.
Гормон поджелудочной железы.
Биологические катализаторы.
Болезнь, вызываемая недостатком инсулина в
организме.
Связи, поддерживающие вторичную структуру
белка?
Структура белка, определяющая биологическую
активность белка.
Процесс взаимодействия белков с водой.
Структура белка, которая разрушается при
нагревании белка с водой.
Структура белка, которая поддерживается
эфирными и дисульфидными мостиками.
Учитель предлагает учащимся самостоятельно
сделать вывод.
Итак, понятие “жизнь” и “белок” неразрывно
связаны. Чтобы ответить на вопрос “что такое
жизнь?”, надо знать, что такое белок. Чем больше о
белках мы узнаем, тем глубже проникаем в понятие
“жизнь”. Насколько многообразны белки,
настолько сложна, загадочна и многолика жизнь.
Подтверждением служат слова Гете: “Я всегда
говорил и не устаю повторять, что мир бы не мог
существовать, если бы был так просто устроен”.
V этап. Итоги, д/з.
Оценивание работы учащихся.
Домашнее задание: § 3.2.1 (учебник биологии) и §
27 (учебник химии).
Задания для проектов (рисунки, рассказы, схемы,
сказки и т.д.):
- Какие характеристики живого (рост, развитие,
раздражимость, размножение, обмен веществ) вы
связали бы со свойствами белков? - Какова взаимосвязь между функциями белков и
необходимостью белковой пищи для человека? - Как белки попадают в организм и что с ними
происходит?
Положительные аспекты урока:
– интерес к предмету;
– взаимосвязь с другими предметами;
– умение делать обобщения, сравнение
(логическое мышление);
– практические навыки для учащихся;
– применение в жизни.
Литература
- В.Б. Захаров, С.Г.Мамонтов, Н.И.Сонин, “Общая
биология” – учебник для 10-11 класса
общеобразовательных учреждений – Дрофа: Москва.
2010 года. - О.С Габриэлян, И.Г.Остроумова “Химия. 10 класс” –
ООО “Дрофа”: Москва. 2009 года.
Приложение 1
Приложение 2
Приложение 3
Источник
