Какие химические свойства алкенов

Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.
Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан.
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида)
Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия:
Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон:
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания пропилена:
2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
Источник
Алкены обладают большой реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. π–Связь менее прочная, чем σ-связь. Она легко разрушается под воздействием различных реагентов.
Наличие подвижной, легко поляризуемой π–связи приводит к тому, что алкены легко вступают в реакции присоединения.
В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
Реакции присоединения
1. Гидрирование или гидрогенизация (присоединение водорода)
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия при нагревании и повышенном давлении.
При гидрогенизации олефины превращаются в предельные углеводороды.
2. Галогенирование (присоединение галогенов)
Присоединение галогенов по двойной связи С=С происходит легко при обычных условиях (при комнатной температуре, без катализатора). Образуются дигалогеналканы:
Реакция с бромной водой (р-р Br2 в Н2О) является качественной реакцией на наличие двойной связи. Происходит обесцвечивание красно-бурой окраски бромной воды.
Видеоопыт «Взаимодействие этилена с бромной водой»
3. Гидрогалогенирование (присоединение галогеноводородов)
При взаимодействии алкенов с галогеноводородами (НCl, НBr) образуются галогеналканы.
Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X — галоген).
Присоединение галогеноводородов к алкенам несимметричного строения происходит по правилу В.В. Марковникова.
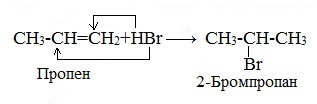
Гидрохлорирование этилена
Присоединение против правила Марковникова происходит в том случае, когда заместитель при двойной связи оттягивает электронную плотность на себя, т.е проявляет электроноакцепторные свойства (–I и/или –М-эффект).
В молекуле трихлопропена Сl3C-CH=CH2 группа СCl3 проявляет отрицательный индуктивный эффект и π -электронная плотность связи С=С смещается к менее гидрогенизированному атому углерода. В результате на атоме С(2) возникает частичный отрицательный заряд δ- , а на атоме С(1) – частичный положительный заряд δ+. При взаимодействии с галогеноводородом водород присоединяется к менее гидрогенизированному атому углерода, а галоген – к более гидрогенизированному:
Также в присутствии какого-либо органического пероксида полярные молекулы галогеноводородов реагируют с алкенами не по правилу Марковникова.
Это связано с тем, что в присутствии перекиси реакция присоединения идет не по электрофильному, а по радикальному механизму.
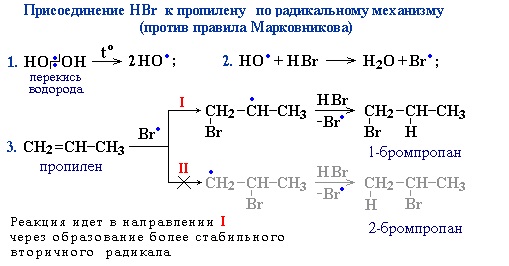 4. Гидратация (присоединение воды)
4. Гидратация (присоединение воды)
При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются одноатомные спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов.
Присоединение воды к несимметричным алкенам идет по правилу Марковникова.
Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, содержащихся в газах крекинга нефти (попутных газов), а также в коксовых газах.
5. Реакции полимеризации
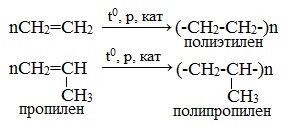
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и др.
Реакции окисления
1. Горение
А) Полное (избыток О2).
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
Как и все углеводороды, алкены горят в кислороде, и при этом образуют диоксид углерода и воду:
Видеоопыт «Горение этилена»
Б) Неполное (недостаток О2).
2. Неполное каталитическое окисление
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 2000С серебряным катализатором, то образуется оксид алкена (эпоксид). Циклические оксиды широко используются в органическом синтезе.
3. Окисление перманганатом калия в нейтральной или щелочной среде (реакция Вагнера)
Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов.
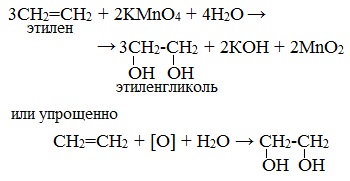
В результате этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4 и выпадает коричневый осадок оксида марганца (IV).
Видеоопыт «Взаимодействие этилена с раствором перманганата калия»
Эта реакция используется как качественная реакция на алкены и другие непредельные углеводорода.
4. Окисление перманганатом калия в кислой среде
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи с образование а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):

Изомеризация алкенов
Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
Изомеризация алкенов приводит или к перемещению π–связи:
или к перестройке углеродного скелета:
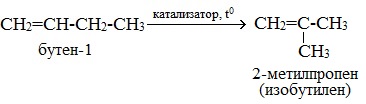
Алкены (непредельные углеводороды)
Источник
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:

При образовании связи σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:

Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120о друг к другу:

Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
Например, молекуле этилена C2H4 соответствует плоское строение.

Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи.

Изображение с сайта orgchem.ru
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны.
| цис-Бутен-2 | транс-Бутен-2 |

| |
Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
В названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
Например, алкен имеет название 2-метилпропен.
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами:
1. Углеродная цепь, в составе которой есть двойная связь, считается главной.
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи.
3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи.
4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
Радикалы, содержащие двойную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH2=CH- | винил |
| CH2=CH-CH2— | аллил |
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.
Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан.
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида)
Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия:
Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон:
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания пропилена:
2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
Например, при дегидрировании этана может образоваться этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
2. Крекинг алканов
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Дегидрогалогенирование галогеналканов
Галогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование) атомов водорода и галогена от галогеналкана.
Например, при взаимодействии хлорэтана с спиртовым раствором гидроксида натрия образуется этилен.
При отщеплении галогена и водорода от некоторых галогеналканов могут образоваться различные органические продукты. В таком случае выполняется правило Зайцева.
Правило Зайцева: отщепление атома водорода при дегидрогалогенировании и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Например, при взаимодействии 2-хлорбутана со спиртовым раствором гидроксида натрия преимущественно образуется бутен-2. Бутен-1 образуется в небольшом количестве (примерно 20%). В реакции мы указываем основной продукт.
4. Дегидратация спиртов
При нагревании спиртов (выше 140оС) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота) или катализаторов (оксид алюминия) протекает дегидратация. Дегидратация — это отщепление молекул воды.
При дегидратации спиртов образуются алкены.
Например, при дегидратации этанола при высокой температуре образуется этилен.
Дегидратация более сложных мол

