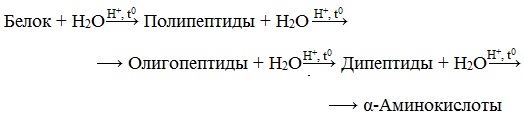Какие химические свойства характерны для белков

По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
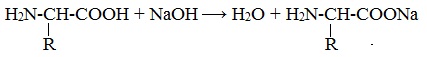
При действии же кислот он выступает в форме катиона:
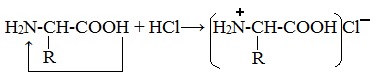
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
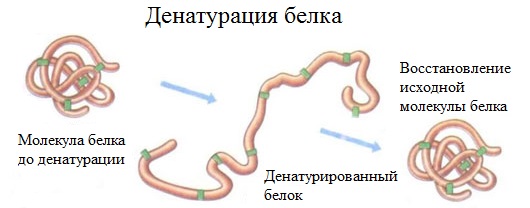
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.

![]()
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: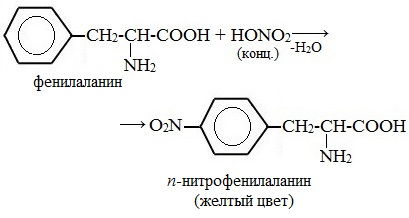
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.

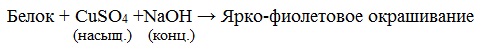
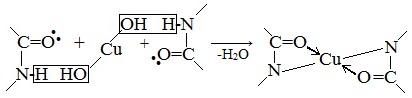
Причина появления окраски – образование комплексных соединений с координационным узлом: 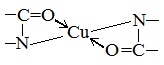
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)

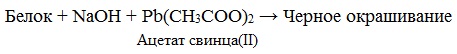
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки
Источник
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали | |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
Источник
Áåëêè – ïðèðîäíûå ïîëèïåïòèäû ñ îãðîìíîé ìîëåêóëÿðíîé ìàññîé. Îíè âõîäÿò â ñîñòàâ âñåõ æèâûõ îðãàíèçìîâ è âûïîëíÿþò ðàçëè÷íûå áèîëîãè÷åñêèå ôóíêöèè.
Ñòðîåíèå áåëêà.
Ó áåëêîâ ñóùåñòâóåò 4 óðîâíÿ ñòðîåíèÿ:
- ïåðâè÷íàÿ ñòðóêòóðà áåëêà – ëèíåéíàÿ ïîñëåäîâàòåëüíîñòü àìèíîêèñëîò â ïîëèïåïòèäíîé öåïè, ñâåðíóòûõ â ïðîñòðàíñòâå:

- âòîðè÷íàÿ ñòðóêòóðà áåëêà – êîíôîðìàöèÿ ïîëèïåïòèäíîé öåïè, ò.ê. ñêðó÷èâàíèå â ïðîñòðàíñòâå çà ñ÷åò âîäîðîäíûõ ñâÿçåé ìåæäó NH è ÑÎ ãðóïïàìè. Åñòü 2 ñïîñîáà óêëàäêè: α-ñïèðàëü è β– ñòðóêòóðà.
α-ñïèðàëü Íà îäíîì âèòêå óêëàäûâàþòñÿ 4 àìèíîêèñëîòíûõ îñòàòêà, êîòîðûå íàõîäÿòñÿ ñíàðóæè ñïèðàëè. |
β-ñòðóêòóðà. Ïîëèïåïòèäíàÿ öåïü ðàñòÿíóòà, åå ó÷àñòêè ðàñïîëàãàþòñÿ ïàðàëëåëüíû äðóã äðóãó è óäåðæèâàþòñÿ âîäîðîäíûìè ñâÿçÿìè. |
- òðåòè÷íàÿ ñòðóêòóðà áåëêà – ýòî òðåõìåðíîå ïðåäñòàâëåíèå çàêðó÷åííîé α-ñïèðàëü èëè β-ñòðóêòóðû â ïðîñòðàíñòâå:

Ýòà ñòðóêòóðà îáðàçóåòñÿ çà ñ÷åò äèñóëüôèäíûõ ìîñòèêîâ –S-S- ìåæäó öèñòåèíîâûìè îñòàòêàìè.  îáðàçîâàíèè òàêîé ñòðóêòóðû ó÷àñòâóþò ïðîòèâîïîëîæíî çàðÿæåííûå èîíû.
- ÷åòâåðòè÷íàÿ ñòðóêòóðà áåëêà îáðàçóåòñÿ çà ñ÷åò âçàèìîäåéñòâèÿ ìåæäó ðàçíûìè ïîëèïåïòèäíûìè öåïÿìè:

Ñèíòåç áåëêà.
 îñíîâå ñèíòåçà ëåæèò òâåðäîôàçíûé ìåòîä, â êîòîðîì ïåðâàÿ àìèíîêèñëîòà çàêðåïëÿåòñÿ íà ïîëèìåðíîì íîñèòåëå, à ê íåé ïîñëåäîâàòåëüíî ïîäøèâàþòñÿ íîâûå àìèíîêèñëîòû. Ïîñëå ïîëèìåð îòäåëÿþò îò ïîëèïåïòèäíîé öåïè.
Ôèçè÷åñêèå ñâîéñòâà áåëêà.
Ôèçè÷åñêèå ñâîéñòâà áåëêà îïðåäåëÿþòñÿ ñòðîåíèåì, ïîýòîìó áåëêè äåëÿò íà ãëîáóëÿðíûå (ðàñòâîðèìûå â âîäå) è ôèáðèëëÿðíûå (íåðàñòâîðèìûå â âîäå).
Õèìè÷åñêèå ñâîéñòâà áåëêîâ.
1. Äåíàòóðàöèÿ áåëêà (ðàçðóøåíèå âòîðè÷íîé è òðåòè÷íîé ñòðóêòóðû ñ ñîõðàíåíèåì ïåðâè÷íîé). Ïðèìåð äåíàòóðàöèè – ñâåðòûâàíèå ÿè÷íûõ áåëêîâ ïðè âàðêå ÿèö.
2. Ãèäðîëèç áåëêîâ – íåîáðàòèìîå ðàçðóøåíèå ïåðâè÷íîé ñòðóêòóðû â êèñëîì èëè ùåëî÷íîì ðàñòâîðå ñ îáðàçîâàíèåì àìèíîêèñëîò. Òàê ìîæíî óñòàíîâèòü êîëè÷åñòâåííûé ñîñòàâ áåëêîâ.
3. Êà÷åñòâåííûå ðåàêöèè:
Áèóðåòîâàÿ ðåàêöèÿ – âçàèìîäåéñòâèå ïåïòèäíîé ñâÿçè è ñîëåé ìåäè (II) â ùåëî÷íîì ðàñòâîðå. Ïî îêîí÷àíèþ ðåàêöèè ðàñòâîð îêðàøèâàåòñÿ â ôèîëåòîâûé öâåò.
Êñàíòîïðîòåèíîâàÿ ðåàêöèÿ – ïðè ðåàêöèè ñ àçîòíîé êèñëîòîé íàáëþäàåòñÿ æåëòîå îêðàøèâàíèå.
Áèîëîãè÷åñêîå çíà÷åíèå áåëêà.
1. Áåëêè – ñòðîèòåëüíûé ìàòåðèàë, èç íåãî ïîñòðîåíû ìûøöû, êîñòè, òêàíè.
2. Áåëêè – ðåöåïòîðû. Ïåðåäàþò è âîñïðèíèìàþò ñèãíàë, ïîñòóïàþùèõ îò ñîñåäíèõ êëåòîê èç îêðóæàþùåé ñðåäû.
3. Áåëêè èãðàþò âàæíóþ ðîëü â èììóííîé ñèñòåìå îðãàíèçìà.
4. Áåëêè âûïîëíÿþò òðàíñïîðòíûå ôóíêöèè è ïåðåíîñÿò ìîëåêóëû èëè èîíû â ìåñòî ñèíòåçà èëè íàêîïëåíèÿ. (Ãåìîãëîáèí ïåðåíîñèò êèñëîðîä ê òêàíÿì.)
5. Áåëêè – êàòàëèçàòîðû – ôåðìåíòû. Ýòî î÷åíü ìîùíûå ñåëåêòèâíûå êàòàëèçàòîðû, êîòîðûå óñêîðÿþò ðåàêöèè â ìèëëèîíû ðàç.
Åñòü ðÿä àìèíîêèñëîò, êîòîðûå íå ìîãóò ñèíòåçèðîâàòüñÿ â îðãàíèçìå – íåçàìåíèìûå, èõ ïîëó÷àþò òîëüêî ñ ïèùåé: òèçèí, ôåíèëàëàíèí, ìåòèíèí, âàëèí, ëåéöèí, òðèïòîôàí, èçîëåéöèí, òðåîíèí.
Источник
Белки
в природе
Белки – это молекулы жизни. Каждый живой
организм содержит большое количество различных белковых молекул, при этом
каждому виду присущи особые, свойственные только ему белки. Даже белки,
выполняющие у различных видов одну и ту же функцию, отличаются друг от друга.
Например, у всех позвоночных животных – рыб, птиц, млекопитающих – красные
клетки крови содержат белок гемоглобин, переносящий кислород. Но гемоглобин у
каждого вида животных свой, особенный. Молекула гемоглобина лошади отличается
от соответствующего белка человека в 26 местах, свиньи – в 10 местах, а гориллы
– всего лишь одной аминокислотой.
Функции белков в организме очень
разнообразны. Есть белки – переносчики веществ (молекул, ионов) и электронов;
есть биокатализаторы, ускоряющие реакции в миллиарды раз и отличающиеся
удивительной специфичностью, есть регуляторы различных биологических процессов
в организме – гормоны, например, инсулин, вазопрессин, окситоцин. Белки
защищают организм от инфекции, они способны узнавать и уничтожать чужеродные
объекты: вирусы, бактерии, клетки. Контакты клетки с внешней средой также
выполняют разнообразные белки, умеющие различать форму молекул, регистрировать
изменение температуры, ничтожные примеси веществ, отличать один цвет от другого.
Свойства
белков
Свойства белков весьма разнообразны и
определяются их строением.
1. По растворимости в воде белки делятся
на два класса:
глобулярные белки –
растворяются в воде или образуют коллоидные растворы; фибриллярные белки
– в воде нерастворимы.
2. Денатурация. При нагревании, изменении
кислотности среды происходит разрушение вторичной и третичной структуры белка с
сохранением первичной. Это явление называют денатурацией.
Пример
денатурации
– свертывание яичных белков при варке яиц. Денатурация бывает обратимой
(при употреблении алкоголя,
солёной пищи) и необратимой. Необратимая денатурация может быть
вызвана высокими температурами, радиацией,
при отравлении организма солями тяжелых металлов, спиртами, кислотами.
ВИДЕО:
Свертывание белков при нагревании
Осаждение белков солями тяжелых металлов
Осаждение белков спиртом
3. Гидролиз белков – это
необратимое разрушение первичной структуры в кислом или щелочном растворе с
образованием аминокислот. Анализируя продукты гидролиза, можно установить
количественный состав белков.
4.
Для белков известно несколько качественных реакций.
1.
Все
соединения, содержащие пептидную связь, дают фиолетовое окрашивание при
действии на них солей меди (II) в щелочном растворе. Эта реакция
называется биуретовой.
ВИДЕО:
ВИДЕО:
Биуретовая реакция белков
2.
Белки,
содержащие остатки ароматических аминокислот (фенилаланин, тирозин) дают желтое
окрашивание при действии концентрированной азотной кислоты – ксантопротеиновая
реакция.
ВИДЕО:
ВИДЕО:
Качественные реакции на белки: биуретовая и ксантопротеиновая
Ксантопротеиновая реакция белков
5. Амфотерные свойства белков
Очень важным для жизнедеятельности живых
организмов является буферное свойство белков, т.е. способность связывать как
кислоты, так и основания, и поддерживать постоянное значение рН различных систем
живого организма.
Превращение
белков в организме
Животные организмы строят свои белки из
аминокислот тех белков, которые они получают с пищей. Поэтому наряду с жирами и
углеводами белки – обязательный компонент нашей пищи.
Животные и растительные белки в
пищеварительном тракте человека расщепляются на аминокислоты. В процессе
переваривания пищи происходит гидролиз белков под влиянием ферментов. В желудке
они расщепляются на более или менее крупные «осколки» – пептиды, которые далее
в кишечнике гидролизуются до аминокислот. Последние всасываются ворсинками
кишечника в кровь и поступают во все ткани и клетки организма. Здесь из
аминокислот под действием ферментов синтезируются белки, свойственные тканям
человеческого тела. Для синтезирования белков необходимо наличие определенных
аминокислот. Но в одних белках, поступающих с пищей, имеются все необходимые
человеку аминокислоты, а в других не все. Организм человека может сам
синтезировать некоторые аминокислоты или заменять их другими. Но 10 аминокислот
он образовать не в состоянии. Их должен непременно
получать с пищей. Эти кислоты называются
незаменимыми (см. Приложения).
Белки, содержащие все необходимые
аминокислоты, называют полноценными. Остальные
белки – неполноценные. Полноценными являются белки
молока, сыра, мяса, рыбы, яиц, бобовых.
Синтезом белков в клетках управляет ДНК. Он осуществляется на поверхности
рибосом с помощью РНК. В организме человека белки почти не откладываются в
запас. Излишки аминокислот в клетках печени превращаются в углеводы — глюкозу и
гликоген или в резервный жир. Поэтому артистам балета слишком больших количеств
белков в пище нужно избегать. Но и намеренное голодание, когда вследствие
больших энерготрат организм, израсходовав запасы углеводов и жира, начинает
тратить резервы белка, очень вредно. Это тратятся белки цитоплазмы клеток.
Судьба аминокислот в организме различна
1. Основная их масса расходуется на
синтез белков, которые идут на увеличение белковой массы организма при его
росте и на обновление белков, распадающихся в процессе жизнедеятельности.
2. Синтез белков идет с поглощением
энергии.
3. Аминокислоты используются в организме
и для синтеза небелковых азотсодержащих соединений, например нуклеиновых
кислот.
4. Часть аминокислот подвергается
постепенному распаду и окислению.
Успехи
в изучении и синтезе белков
Основные сведения о составе и строении
белков были получены при изучении их гидролиза (гидролиз белков – необратимое
разрушение первичной структуры в кислом или щелочном растворе с образованием
аминокислот). Установлено, что в результате гидролиза любого белка получается
смесь α-аминокислот, причем наиболее часто встречаются в составе белков 20 α-аминокислот.
Как же аминокислоты образуют белковую
молекулу? Еще в 80-х годах прошлого века русский ученый-биохимик А.Я. Данилевский на основании своих
опытов впервые высказал гипотезу о пептидной связи между остатками аминокислот
в белковой молекуле. В 1899 году исследованиями белков занялись немецкие
химики-органики Эмиль Фишер и Франц Гофмейстер. Они высказали
предположение, что в белках аминокислоты связаны за счет аминогруппы одной
кислоты и карбоксила другой. При образовании такой связи выделяется молекула
воды. Эта гипотеза была блестяще подтверждена экспериментально в 1907 году и
получила название “полипептидной теории”.
Фишеру удалось синтетически получить
полипептиды, в молекулы которых входили различные аминокислотные остатки,
соединенные пептидными связями.
Химический синтез широко применяют для
получения пептидов, в т.ч. биологически активных гормонов и их разнообразных
аналогов, используемых для изучения взаимосвязи структуры и биологической
функции, а также пептидов, несущих антигенные детерминанты различных белков и
применяемых для приготовления соответствующих вакцин. Первые химические синтезы
белка в 60-е гг. (инсулина овцы и рибонуклеазы S), осуществленные в растворе с
помощью тех же методов, которые используют при синтезе пептидов, были связаны с
чрезвычайно большими сложностями. В каждом случае требовалось провести сотни
химических реакций и окончательный выход белка был очень низок (менее 0,1%), в
результате чего полученные препараты не удалось очистить. Позже были
синтезированы некоторые химически чистые белки, в частности инсулин человека
(П. Зибер и др.) и нейротоксин II из ядра среднеазиатской кобры (В.Т. Иванов).
Однако до сих пор химический синтез белка представляет весьма сложную проблему
и имеет скорее теоретическое, чем практическое значение. Более перспективны
методы генетической инженерии, которые позволяют наладить промышленное
получение практически важных белков и пептидов.
Упрощенный синтез полипептидов можно
представить так:
Вспомните: связь между остатками аминокислот,
а именно: между группами С = О одной кислоты и N-H другой кислоты – называется
пептидной (амидной), группа атомов –СО─NH ─ называется пептидной (амидной)
группой.
Пептидная или белковая цепь представляет
собой продукт поликонденсации аминокислот. Один из концов цепи, где находится
остаток аминокислоты со свободной аминогруппой, называется N-концом, сама
аминокислота – N-концевой; другой конец цепи с остатком аминокислоты, имеющим
карбоксильную группу, называется С-концом, кислота – С-концевой.
Пептидную цепь всегда записывают,
начиная с N-конца. В названии пептида за основу принимают С-концевую кислоту,
остальные аминокислоты указывают как заместители с суффиксом –ил-, перечисляя
их последовательно, начиная с N-конца. Название полученного дипептида: ГЛИЦИЛАЛАНИН
ВИДЕО:
Качественное определение азота в органических соединениях
Источник