Какие химические свойства характерны для фосфора
Химические свойства азота
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N). По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
А также растворами кислот, например:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным. Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение. Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен. По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Взаимодействие фосфора с неметаллами
Реакционная способность фосфора является более высокой, чем у азота. Так, фосфор способен гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
а при недостатке кислорода оксид фосфора (III):
Реакция с галогенами также протекает интенсивно. Так, при хлорировании и бромировании фосфора в зависимости от пропорций реагентов образуются тригалогениды или пентагалогениды фосфора:
Ввиду существенно более слабых окислительных свойства йода по сравнению с остальными галогенами, возможно окисление фосфора йодом только до степени окисления +3:
В отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
Фосфиды активных металлов подобно нитридам гидролизуются водой:
А также водными растворами кислот-неокислителей:
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
Тем не менее, тем, кто претендует на 100 баллов, для собственного спокойствия, можно запомнить следующие особенности взаимодействия фосфора с растворами щелочей на холоду и при нагревании.
На холоду взаимодействие белого фосфора с растворами щелочей протекает медленно. Реакция сопровождается образованием газа с запахом тухлой рыбы — фосфина и соединения с редкой степенью окисления фосфора +1:
При взаимодействии белого фосфора с концентрированным раствором щелочи при кипячении выделяется водород и образуется фосфит:
Источник
Фосфор – жизненно важный элемент из пятой группы периодической таблицы Менделеева. Химические свойства фосфора зависят от его модификации. Наиболее активным веществом является белый фосфор, окисляющийся на воздухе. Фосфор имеет две валентности (III и V) и три степени окисления – +5, +3, -3.

Фосфор и соединения
Фосфор имеет три аллотропические модификации, отличающиеся химическими и физическими свойствами:
- белый;
- красный;
- чёрный.
Под фосфором в химических реакциях чаще всего понимают белый фосфор (P4). Красный фосфор вступает в реакции при определённых условиях. Например, реагирует с водой при нагревании и под давлением. Чёрный фосфор практически инертен.

Рис. 1. Светящийся белый фосфор.
Фосфор реагирует с простыми и сложными веществами, образуя:
- фосфин;
- фосфорную кислоту;
- фосфиды;
- оксиды.
Фосфин (РН3) – плохо растворимый в воде ядовитый газ, аналог аммиака. В отсутствии кислорода при нагревании разлагается на простые вещества – фосфор и водород.
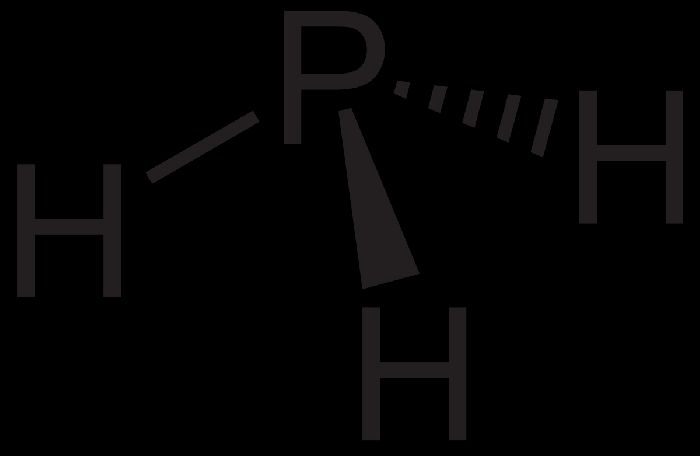
Рис. 2. Фосфин.
Фосфорная или ортофосфорная кислота (H3PO4) образуется при взаимодействии фосфора или оксида фосфора (V) с водой.
Фосфиды – соли, образующиеся при взаимодействии с металлами или неметаллами. Они неустойчивы и легко разлагаются под действием кислот или воды.
Фосфор может образовывать два оксида – P2O3 и P2O5.
H3PO4 – кислота средней силы, проявляющая амфотерные свойства при взаимодействии с сильной кислотой. Фосфорная кислота образует фосфаты.
Химические свойства
Основные химические свойства фосфора и его соединений описаны в таблице.
Вещество | Реакция | Особенности | Уравнение |
Фосфор | С O2 | При избытке O2 образует оксид фосфора (V) | – 4P + 5O2 → 2P2O5; – 4P + 3O2 → 2P2O3 |
С металлом | Является окислителем | 3Mg + 2P → Mg3P2 | |
С галогенами и неметаллами | Не реагирует с водородом | 2P + 3S → P2S3 | |
С Н2О | 8Р + 12Н2О → 5РН3 + 3Н3РО2 | ||
С кислотами | 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O | ||
Со щелочами | P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 | ||
РН3 | С O2 | Воспламеняется на воздухе | РН3 + 2O2 → H3PO4 |
С галогенами и неметаллами | РН3 + 2I2 + 2H2O → H(PH2O2) + 4HI | ||
С кислотами | Проявляет свойства восстановителя | РН3 + 3H2SO4 → H2(PHO2) + 3SO2 + 3H2O | |
H3PO4 | С металлами | С активными металлами | 2H3PO4 + 3Ca → Ca3(PO4)2 + 3H2↑ |
С Н2О | Подвергается диссоциации | H3PO4 + H2O ↔ H3O+ + H2PO4– | |
Со щелочами | Образует кислые или щелочные фосфаты | H3PO4 + 3NaOH → Na3PO4 + 3H2O | |
С оксидами | 2H3PO4 + 3K2O → 2K3PO4 + 3H2O | ||
С солями | 2H3PO4 + 3CaCO3 → Ca3(PO4)2 + 3H2O + 3CO2↑ | ||
С аммиаком | H3PO4 + 3NH3 → (NH4)3PO4 | ||
P2O3 | С галогенами и неметаллами | – 2P2O3 + 6Cl2 → 4PCl3O + O2; – 2P2O3 + 9S → P4S6 + 3SO2 | |
С Н2О | Медленно реагирует с холодной водой и быстро – с горячей | P2O3 + 3H2O → 2H3PO3 | |
Со щелочами | P2O3 + 4NaOH → 2Na2HPO3 + H2O | ||
P2O5 | С Н2О | Реагирует с взрывом | 2P2O5 + 6H2O → 4H3PO4 |
С кислотами | Реакция замещения | 4HNO3 + 2P2O5 → 4HPO3 + 2N2O5 | |
Фосфиды | С Н2О | Образуют гидроксиды металлов и фосфин | Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3 |
С кислотами | Реакция замещения | Ca3P2 + 6HCl → 3CaCl2 + 2PH3 |
При нагревании оксид фосфора распадается. Причём P2O3 образует красный фосфор, а P2O5 – оксид фосфора (III) и кислород.

Рис. 3. Красный фосфор.
Использование
Широкое применение имеют соединения фосфора:
- из фосфатов получают удобрения и моющие средства;
- фосфорная кислота используется для окрашивания ткани;
- оксид фосфора (V) осушает жидкости и газы.
Красный фосфор используется в производстве спичек и взрывчатых веществ.
Что мы узнали?
Фосфор – активный неметалл, реагирующий с простыми и сложными веществами. В результате реакций образует оксиды (III) и (V), фосфин, фосфорную кислоту и фосфиды. Соединения фосфора вступают в реакцию с металлами, неметаллами, кислотами, щелочами, водой. Фосфор и его соединения используются в промышленности и сельском хозяйстве.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Алина Батарова
5/5
Оценка доклада
Средняя оценка: 4.8. Всего получено оценок: 169.
Источник
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс “40 шагов к 100 баллам на ЕГЭ по химии“.
Создать карусель Добавьте описание
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии:
Создать карусель Добавьте описание
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
Создать карусель Добавьте описание
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Белый фосфор
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего).
Покрытие бумаги раствором белого фосфора в сероуглероде
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Плавление белого фосфора
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Создать карусель Добавьте описание
Черный фосфор
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор, который очень хорошо проводит электрический ток.
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Соединения фосфора
Типичные соединения фосфора:
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи:
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например, метафосфорную кислоту.
Создать карусель Добавьте описание
3. Красный и черный фосфор получают из белого фосфора.
Создать карусель Добавьте описание
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами.
1.1. При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
Горение белого фосфора
Горение красного фосфора
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Создать карусель Добавьте описание
1.3. При взаимодействии фосфора с серой образуются сульфиды:
Создать карусель Добавьте описание
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Создать карусель Добавьте описание
Еще пример: натрий взаимодействует с фосфором с образованием фосфида натрия:
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например, азотная кислота окисляет фосфор до фосфорной кислоты:
Создать карусель Добавьте описание
Реакция красного фосфора с бертолетовой солью.
Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Красный фосфор + бертолетова соль
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
Создать карусель Добавьте описание
Или с гидроксидом кальция:
Источник
~Апельсиновое Настроение~
Просветленный
(41370)
10 лет назад
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
[править]
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
4P + 5O2 → 2P2O5 (с избытком кислорода) ,
4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода) .
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
2P + 3Ca → Ca3P2,
2P + 3Mg → Mg3P2.
с неметаллами — восстановитель:
2P + 3S → P2S3,
2P + 3Cl2 → 2PCl3.
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водой, при этом диспропорционирует:
4Р + 6Н2О → РН3 + 3Н3РО2 (фосфатная кислота) .
Взаимодействие со щелочами
В растворах щелочей диспропорционирование происходит в большей степени:
4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2.
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO;
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
6P + 5KClO3 → 5KCl + 3P2O5
cav
Профи
(687)
10 лет назад
Химические свойства Фосфора.
Конфигурация внешних электронов атома Фосфор 3s23p3; в соединениях наиболее характерны степени окисления +5, +3, и -3. Подобно азоту, Фосфор в соединениях главным образом ковалентен. Ионных соединений, подобных фосфидам Na3P, Са3Р2, очень мало. В отличие от азота, Фосфор обладает свободными 3d-орбиталями с довольно низкими энергиями, что приводит к возможности увеличения координационного числа и образованию донорно-акцепторных связей.
Фосфор химически активен, наибольшей активностью обладает белый Фосфор; красный и черный Фосфор в химических реакциях гораздо пассивнее. Окисление белого Фосфора происходит по механизму цепных реакций. Окисление Фосфора обычно сопровождается хемилюминесценцией. При горении Фосфора в избытке кислорода образуется оксид (V) Р4O10 (или Р2О5), при недостатке – в основном оксид (III) Р4О6 (или Р2О3). Спектроскопически доказано существование в парах P4O7, Р4O8, Р2О6, РО и других оксидов фосфора. Оксид Фосфора (V) получают в промышленного масштабах сжиганием элементарного Фосфора в избытке сухого воздуха. Последующая гидратация Р4O10 приводит к получению орто- (Н3РО4) и поли-(Нn+2РnО3n+1) фосфорных кислот. Кроме того, Фосфор образует фосфористую кислоту Н3РО3, фосфорноватую кислоту Н4Р2О6 и фосфорноватистую кислоту Н3РО2, а также надкислоты: надфосфорную Н4Р2О8 и мононадфосфорную Н3РО5. Широкое применение находят соли фосфорных кислот (фосфаты) , в меньшей степени – фосфиты и гипофосфиты.
Фосфор непосредственно соединяется со всеми галогенами с выделением большого количества тепла и образованием тригалогенидов (РХ3, где X – галоген) , пентагалогенидов (РХ5) и оксигалогенидов (например, РОХ3). При сплавлении Фосфора с серой ниже 100 °С образуются твердые растворы на основе Фосфора и серы, а выше 100 °С происходит экзотермическая реакция образования кристалличических сульфидов P4S3, P4S5, P4S7, P4S10, из которых только P4S5 при нагревании выше 200 °С разлагается на P4S3 и P4S7, а остальные плавятся без разложения. Известны оксисульфиды фосфора: P2O3S2, P2O2S3, P4O4S3, P6O10S5 и P4O4S3. Фосфор по сравнению с азотом менее способен к образованию соединений с водородом. Фосфористый водород фосфин РН3 и дифосфин Р2Н4 могут быть получены только косвенным путем. Из соединений Фосфора с азотом известны нитриды PN, P2N3, P3N5 – твердые, химически устойчивые вещества, полученные при пропускании азота с парами Фосфора через электрическую дугу; полимерные фосфонитрилгалогениды – (PNX2)n (например, полифосфонитрилхлорид) , полученные взаимодействием пентагалогенидов с аммиаком при различных условиях; амидоимидофосфаты – соединения, как правило, полимерные, содержащие наряду с Р-О-Р связями Р-NH-Р связи.
При температурах выше 2000°С Фосфор реагирует с углеродом с образованием карбида РС3- вещества, не растворяющегося в обычных растворителях и не взаимодействующего ни с кислотами, ни со щелочами. При нагревании с металлами Фосфор образует фосфиды.
Фосфор образует многочисленные фосфорорганические соединения.
Zwillemonie
Ученик
(135)
5 лет назад
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Инна Бондаренко
Знаток
(297)
4 года назад
А) Характеристика фосфора.
1. Фосфор — элемент пятой группы и третьего периода, Z = 15,
АГ (Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов, 16
Нейтронов и 15 электронов. Строение его электронной оболочки
Можно отразить с помощью следующей схемы:
+15Р 2ё; 8ё; 5ё.
Атомы фосфора проявляют как окислительные свойства (принимают недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами — металлами, водородом и т. п. ) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т. п. , приобретая при этом степени окисления +3 и+5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами. 3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе) .
4. Неметаллические свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы (соседние элементы в периоде) . 5. Высший оксид фосфора имеет формулу Р205. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р205 + ЗН20 =*2Н3Р04.
При взаимодействии его с основными оксидами и основаниями он дает соли.
Р205 + 3MgO = Mg3(P04)2; Р205 + 6КОН = 2К3Р04+ ЗН20.
6. Высший гидроксид фосфора — фосфорная кислота Н3Р04,
раствор которой проявляет все типичные свойства кислот:
взаимодействие с основаниями и основными оксидами:
Н3Р04 + 3NaOH = Na3P04 + ЗН20. 2Н3Р04 + ЗСаО = Ca3(P04)2i + ЗН20.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Источник
