Какие химические свойства характерны для металлов и как они связаны со строением их атомов

В одной из предыдущих частей мы уже говорили, что металлы характеризуются металлическими свойствами, то есть способностью отдавать электроны, а чуть позднее, это было вот тут, упомянули о том, что говорить о металлической связи мы можем тогда, когда эта самая связь образуется между атомами химических элементов металлов.
Сегодня мы попробуем раскрыть большую часть первоначальных сведений, касающихся металлической связи, что, кстати, позволит понять в том числе и природу физических свойств металлов, поэтому наберитесь терпения, возможно, будет интересно!
Различные металлические воплощения
Начнём мы несколько издалека, а именно с определения химии (неожиданно). Я не удивлю Вас, если скажу, что
Химия – это наука о веществах, их свойствах и превращениях.
Попробуем коротко раскрыть смысл, заложенный в данном определении. Для этого мы должны прийти к единой точки зрения относительно таких понятий, как вещества и их свойства.
Вещество – это то, из чего состоит физическое тело. И вне всяких сомнений металлы непосредственно относятся к веществам, положенным в основу огромного количества физических тел, так железо (Fe) или медь (Cu) являются веществом для таких физических тел, как гвоздь или проволока. Но мы идём дальше.
А как определить, что такое свойства вещества? Давайте размышлять. Например, у меня есть различные свойства. Рост, вес, возраст и т.д. Совокупность всех моих свойств в конечном итоге отличает меня от Вас. Понимаете? Проводя аналогию с веществами, можно сказать, что
Свойства вещества – это то, что отличает одни вещества от других.
Физические свойства металлов.
И если физические свойства металлов нам из нашей повседневной практики известны достаточно хорошо, то вопрос о том, чем могут быть обусловлены эти свойства, я думаю, большинству из нас не покажется столь уж простым.
Дело в том, что в химии существует понимание: свойства вещества обусловлены, во-первых, составом вещества, во-вторых, его строением.
Свойства любого вещества обусловлены его составом и строением
И состав и строение в каждом конкретном случае по понятным причинам может значительно изменяться, внося свои существенные коррективы в итоговый результат, но наша задача выделить в этом общее, характерное для металлов!
Общую составляющую состава мы уже коротко обсудили, она включает в себе систему, состоящую из атомов химических элементов металлов, объединённых химической связью, что коротко может быть описано как Ме – Ме.
Чтобы добраться до общего, характеристического для металлов по части строения, нам вновь придётся поразмышлять. Итак, если металлы характеризуются металлическими свойствами, то есть, способностью отдавать электроны, то возникает логичный вопрос: кому они отдают электроны? Представьте, если я хочу отдать электроны, и Вы хотите отдать электроны, как мы можем найти общий язык?
Как выяснилось, атомы химических элементов металлов при образовании химической связи между собой отдают электроны в общее пользование, а в некотором роде освобождают эти электроны, и последние заполняют собой межузловое пространство металлической кристаллической решётки.
Схема металлической кристаллической решётки
Таким образом мы вводим новое для нас понятие:
Кристаллическая решётка – совокупность упорядоченно расположенных в пространстве структурных единиц твёрдого вещества.
Структурные единицы, входящие в состав кристаллической решётки называются узлами. Для удобства работы нашего представления узлы кристаллической решётки соединяют воображаемыми линиями.
В узлах же металлической кристаллической решётки находятся так называемые атом-ионы. Почему?
Дело в том, что освобождая электроны, или отдавая электроны в общее пользование для всей металлической кристаллической решётки, атом металла (Ме) перестаёт быть атомом и приобретает положительный заряд , то есть, становится ионом (катионом).
Схема металлической химической связи
Данный процесс обратим. (Стрелочка, направленная как в одну сторону, так и в другую, – символ обратимости). То есть, в действительности происходит беспокойный переход атома металла в состояние иона (катиона) с освобождением электронов и наоборот.
Почему же при отдаче электронов атом металла приобретает положительный заряд? Дело в том, что в случае отдачи электронов совокупный отрицательный заряд электронной оболочки уменьшается, а положительный заряд ядра остаётся неизменным и начинает преобладать над отрицательным зарядом электронной оболочки, что приводит к совокупному положительному заряду всей частицы, то есть к состоянию иона (катиона).
Переход атома кальция (Ca) в состояние иона (катиона) кальция
Теперь мы наконец-то готовы определить, что же такое металлическая связь:
Металлическая связь – это химическая связь, образованная за счёт обобществлённых (свободных) электронов, между атом-ионами металлов.
Именно наличием в межузловом пространстве металлической кристаллической решётки свободных обобществлённых электронов и объясняются все физические свойства металлов, такие как электропроводность, металлический блеск, ковкость и так далее.
Возможно, поподробнее мы об этом когда-нибудь и поговорим. А на этом у меня всё. Спасибо. Пока.
Источник
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
Ряд активности металлов
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
активные металлы | металлы средней активности | неактивные металлы |
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из растворов солей те металлы, которые в ряду активности стоят после него (правее).
3. Металлы, находящиеся в ряду активности левее водорода, способны вытеснять его из растворов кислот.
4. Щелочные и щелочноземельные металлы в любых водных растворах взаимодействуют прежде всего с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
Взаимодействие цинка с серой
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
Например, при взаимодействии лития с азотом образуется нитрид лития:
6Li0+N02→2Li+13N−3.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca0+2P0→Ca+23P−32.
Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
Взаимодействие натрия с водой
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe_3O_4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
Реакция алюминия с серной кислотой
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
Взаимодействие железа с сульфатом меди
Источник
Металлы – твёрдые элементы, сплавы которых широко применяются в промышленности, строительстве и повседневной жизни. Пластичность, твёрдость, тепло- и электропроводность, а также способность к плавке и ковке обусловлены строением металлов.

Строение
Электронное строение атома металла включает:
- положительно заряженное ядро;
- отрицательно заряженные электроны.
Ядро состоит из протонов и нейтронов. Количество протонов, заряд ядра и число электронов соответствуют порядковому номеру металла в периодической таблице.
Электроны в металлических атомах расположены намного дальше от ядра, чем электроны неметаллов. Этим объясняется лёгкость отделения валентных электронов, поэтому металлы всегда являются восстановителями в химических реакциях.
Атомы всех металлов, за исключением ртути, образуют кристаллические решётки. Кристаллическая решётка состоит из повторяющихся комплексов атомов – элементарных кристаллических ячеек, которые бывают трёх видов. Их отличия описаны в таблице строения металлов.
Вид решётки | Характеристика | Примеры |
Кубическая объёмно-центрированная (ОЦК) | Восемь ионов находятся по углам условного куба, один – в середине | Fe, Cr, Mo, W, V |
Кубическая гранецентрированная | Ионы располагаются в углах куба и в центре каждой грани. Центр куба свободен | Cu, Ag, Ni, Pb, Al |
Гексагональная плотноупакованная | Шестигранная призма. В углах и в центре между ними находятся ионы. Посередине призмы лежат ионы, образующие треугольник | Zn, Ti, Mg, Co, Zr |
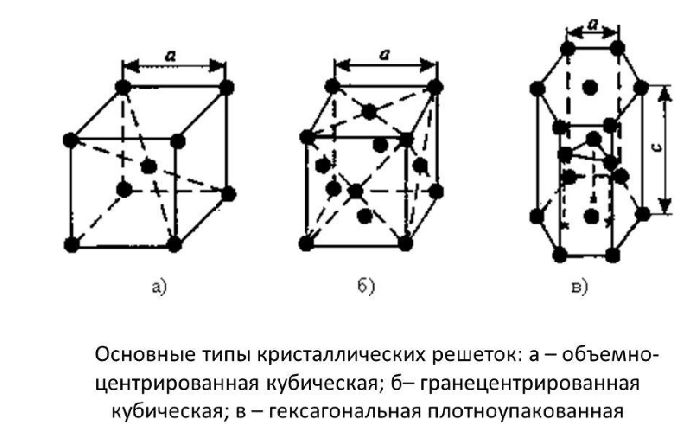
Рис. 1. Виды решёток металлов.
Физические свойства
Металлы отличаются от неметаллов характерными физическими свойствами:
- имеют металлический блеск;
- проводят электрический ток и тепло;
- не имеют запаха;
- обладают серебристо-серым цветом (исключение – медь и золото).
Благодаря пластичности и плавке металлы могут образовывать сплавы – смеси химических элементов. Большую часть сплавов составляют металлы, остальное – случайные примеси и специально вводимые вещества. Сплавы отличаются высокой прочностью, упругостью, хрупкостью. Широко применяются сплавы на основе железа (чёрные металлы) и алюминия (цветные металлы).
Высокую электропроводность обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается.
Виды
Классификация металлов приведена в таблице.
Признак | Вид | Пример |
Температура кипения | Легкоплавкие (Т<1000°С) | K, Al, Zn |
Тугоплавкие (Т>1000°С) | Au, Cu, Ni | |
Плотность | Лёгкие (ρ<5 г/см3) | Li |
Тяжёлые (ρ>5 г/см3) | Os | |
Твёрдость | Мягкие – режутся ножом | Na, Rb, Cs |
Твёрдые – используются для резки | Cr |
В химии по структуре орбиталей атома металла различают s-, p-, d-, f-металлы.
Химические свойства
Металлы являются восстановителями и вступают в реакцию с неметаллами, образуя оксиды, гидроксиды, соли. Самыми активными являются щелочные и щелочноземельные металлы, расположенные в I и II группах таблицы Менделеева. Благородные металлы (Au, Ag, Pt) малоактивны и не взаимодействуют с кислородом и водой.
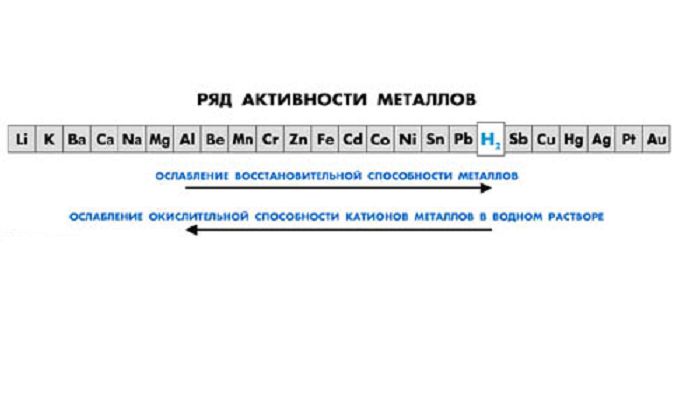
Рис. 2. Шкала активности металлов.
Особенности химического взаимодействия металлов с другими элементами описаны в таблице.
Взаимодействие | Продукты | Уравнение |
С кислородом | Оксиды | 2Mg + O2 → 2MgO |
С серой | Сульфиды | Zn + S → ZnS |
С азотом | Нитриды | 6Li + N2 → 2Li3N |
С фосфором | Фосфиды | 3Ca + 2P → Ca3P2 |
С галогенами | Галогениды | 2Na + Cl2 → 2NaCl |
С водой | Гидроксиды | 2Na + 2H2O → 2NaOH + H2 |
С кислотами | Соли | 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 |
С солями (замещают менее активные металлы) | Соль | 2Fe + Cu2SO4 → Fe2SO4 + 2Cu |
Золото растворяется в царской водке (смеси соляной и азотной кислот), серебро – в концентрированной азотной и горячей серной кислотах.

Рис. 3. Золото.
Что мы узнали?
Рассмотрели особенности строения атомов металлов, физические и химические свойства. Металлы состоят из элементарных кристаллических ячеек, отличающихся конфигурацией. Элементы обладают металлическим блеском, электропроводностью, пластичностью, твёрдостью. Металлы – восстановители. Наиболее активные находятся в I и II группах таблицы Менделеева. Металлы реагируют с кислородом, водой, кислотами, галогенами и неметаллами.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Hoyr Hftx
10/10
Александр Котков
10/10
Сергей Ефремов
6/10
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 230.
Источник
Лекция Химия
Тема: Металлы, особенности строения атомов, способы
получения и свойства
План
1. Особенности строения атомов металлов.
2. Способы получения металлов.
3.Физические свойства металлов.
4. Химические свойства металлов.
1. Особенности строения атомов металлов
Более 80% известных элементов образуют простые вещества — металлы. К ним относятся s-элементы I и II групп (исключение — водород), все d– и f – элементы, а также р-элементы III группы (кроме бора), IV группы (олово, свинец), V группы cурьма, висмут) и VI группы (полоний).
Особенности строения атомов металлов:
небольшое число электронов на внешнем энергетическом уровне (как правило, один-три электрона). Исключение — атомы р-элементов IV-VI групп;
малые заряды ядер и большие радиусы атомов по сравнению с атомами неметаллов данного периода;
сравнительно слабая связь валентных электронов с ядром;
низкие значения электроотрицательности.
В связи с этим атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы, т. е. металлы – восстановители.
Однако способность отдавать электроны проявляется у металлов неодинаково. В периодах с увеличением зарядов ядер атомов уменьшаются их радиусы, увеличивается число электронов на внешнем уровне и усиливается связь валентных электронов с ядром. Поэтому в периодах слева направо восстановительная способностъ атомов металлов уменьшается.
В главных подгруппах с возрастанием атомных номеров элементов увеличиваются радиусы их атомов и уменьшается притяжение (валентных электронов к ядру. Поэтому в главных подгруппах сверху вниз восстановительная активность атомов металлов возрастает. Следовательно, наиболее активными восстановителями являются щелочные и щелочно-земельные металлы.
Только некоторые металлы (золото, платина) находятся в природе в виде простых веществ (в самородном состоянии). Металлы, расположенные в электрохимическом ряду напряжений между оловом и золотом, встречаются как в виде простых веществ, так и в составе соединений. Большинство же металлов находятся в природе в виде соединений — оксидов, сульфидов, карбонатов и т. д. Распространенность металлов в природе уменьшается в ряду:
Al, Fe, Ca, Na, К, Mg, Ti, Mn, Cr, Ni, Zn, Cu, Sn, Pb, W, Hg, Ag. Аu
Содержание в земной коре (массовая доля, %) уменьшается
Получение металлов из их соединений — задача металлургии. Металлургия — наука о промышленном получении металлов из природного сырья. Различают черную (производство железа и его сплавов) и цветную (производство всех остальных металлов сплавов) металлургию. Любой металлургический процесс является процессом восстановления ионов металла различными восстановителями:
Men+ + пе– = Me
В зависимости от условий проведения процесса восстановления различают несколько способов получения металлов.
2. Способы получения металлов
С или СО (карботермия)
PbO + C = Pb + CO
Fe203 + 3СО = 2Fe + 3C02
Сульфиды предварительно обжигают:
2ZnS + 302 = 2ZnO + 2S02
ZnO + С = Zn + 2СО
Fe, Cu, Pb, Sn, Cd, Zn
Al, Mg и др.
(металлотермия)
Cr203 + 2AI = 2Cr + Al203
TiCI4 + 2Mg = Ti + 2MgCl2
Mn, Cr, W, Mo, Ti, V
H2(водородотермия)
Mo03 + 3H2 = Mo + 3H20
Оксиды активных металлов (МgО, СаО, А1203 и др.) водородом не восстанавливаются
Cu, Ni, W, Fe, Mo, Cd, Pb
Электрометаллургия – восстановление электрическим током
Виды электролиза
Примеры
Получаемые металлы
Электролиз расплавов
NaCl = Na+ + Cl-
расплав
К Na+ + е- = Na 2
А Cl- + 2е- = Cl2 1
2NaCl электролиз 2Na + Cl2
2Al2O3 электролиз 4Al + 3O2
Na3(AlF6)
Щелочные металлы, Be, Mg, Ca (из расплавленных хлоридов), Al – из расплавленного оксида
Электролиз растворов
NiSO4 = Ni2+ + SO42-
раствор
К Ni2+ + 2е- = Ni 2
А 2Н2О – 4е- = O2 + 4Н+ 1
2NiSO4 + 2Н2О электролиз 2Ni + О2 + Н2SO4
Zn, Cd, Co, Mn, Fe
Гидрометаллургия – восстановление из растворов солей
Примеры
Получаемые металлы
Металл, входящий в состав руды, переводят в раствор, затем восстанавливают более активным металлом:
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
CdO + H2SO4 = CdSO4 + H2O
CdSO4 + Zn = ZnSO4 + Cd
Cd, Ag, Au, Cu
Задания для самостоятельной работы
1. Атому магния в степени окисления +2 соответствует электронная конфигурация:
а) 1s2 2s2 2р6 3s2 3р6; в) 1s2 2s2 2р4;
б) 1s2 2s2 2р6; г) 1s2 2s2 2р6 3s2;
2. При частичном восстановлении водородом 30 г оксида кобальта. В получили смесь оксида и металла массой 26,8 г. Определите количество вещества водорода, вступившего в реакцию, и массовую долю кобальта в полученной смеси.
3. При электролизе раствора сульфата меди (II) в растворе образовалась кислота (около анода), на нейтрализацию которой затрачен раствор объемом 16 см (р = 1,05 г/см3) с массовой долей гидроксида калия 6%. Вычислите массу меди, которая выделилась на катоде.
4. Для восстановления марганца из оксида марганца(1/) путем алюмотермии было смешано 10,8 г алюминия и 26,2 г оксида. Определите, какое из исходных веществ осталось и какова его масса.
3. Физические свойства металлов
Все металлы обладают металлической кристаллической решеткой, особенности которой определяют их общие физические и механические свойства.
Общие свойства металлов:
1).Все металлы являются твердыми веществами, за исключением ртути.
2). Металлический блеск и непрозрачность металлов — результат отражения световых лучей.
3). Электро- и теплопроводность обусловлены наличием в металлических решетках свободных электронов.
С повышением температуры электропроводность металлов уменьшается, а с понижением температуры — увеличивается. Около абсолютного нуля для многих металлов характерно явление сверхпроводимости.
4). Металлы обладают ковкостью и пластичностью. По определению М. В. Ломоносова, «металлом называется светлое тело, которое ковать можно». Металлы легко прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке, прессованию.
Специфические физические свойства металлов:
1). по значению плотности металлы делят на легкие (плотность меньше 5 г/см3): Na, Са, Mg, Al, Ti — и тяжелые (плотность больше 5 г/см3): Zn, Cr, Sn, Mn, Ni, Сu, Ag, Pb, Hg, Аи, W, Os – самый тяжелый;
2). по значению температуры плавления — на легкоплавкие (tпл < 1000 °С): Hg, Na, Sn, Pb, Zn, Mg, Al, Ca, Ag — и тугоплавкие (tпл > 1000 °C): Au, Cu, Mn, Ni, Fe, Ti, Cr, Os, W – самый тугоплавкий;
3). из металлов самые мягкие — щелочные (их можно резать ножом), самый твердый — хром (царапает стекло).
4). по отношению к магнитным полям металлы подразделяют на три группы:
а) ферромагнитные — способны намагничиваться под действием даже слабых магнитных полей (Fe, Со, Ni);
б) парамагнитные — проявляют слабую способность к намагничиванию даже в сильных магнитных полях (Al, Cr, Ti);
в) диамагнитные — не притягиваются к магниту (Sn, Сu, Bi).
4. Химические свойства металлов
Если атомы большинства неметаллов могут как отдавать, так и присоединять электроны, проявляя окислительно-восстановительную двойственность, то атомы металлов способны только отдавать валентные электроны, проявляя восстановительные свойства: Me – пе– = Meп+(окисление)
восстановитель
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
1). Взаимодействие металлов с простыми веществами — неметаллами
Металлы при определенных условиях взаимодействуют с неметаллами, например с кислородом образуют оксиды:
2Mg + 02 = 2MgO 4А1 + 302 = 2А1203
Из щелочных металлов только литий сгорает на воздухе с образованием оксида:
4Li + 02 = 2Li20
оксид лития
Основной продукт окисления натрия — пероксид:
2Na + 02 = Na202
пероксид
натрия
При горении других щелочных металлов образуются супероксиды, например:
+1 -1 0 0 -1 +1
2К + 202 = К204 ( К-О-О-О-О—К)
супероксид
калия
Оксиды натрия и калия могут быть получены при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
Na202 + 2Na = 2Na20
На реакции пероксида натрия с оксидом углерода (1V) основана регенерация воздуха в изолированных помещениях (например, на подводных лодках):
2Na2О2 + 2СО2 = 2Na2CО3 + О2
При нагревании металлы реагируют с другими неметаллами:
Mg + Br2 = MgBr2
4А1 + 3С = А14С3
бромид
карбид
магния
алюминия
2А1 + N2 = 2A1N
3Fe + С = Fe3C
нитрид
карбид
алюминия
железа
3Са + 2Р = Са3Р2
Са + 2С = СаС2
фосфид
карбид
кальция
кальция
Сu + S = CuS
2Mg + Si = Mg2Si
сульфид
силицид
меди (II) магния
Если металл проявляет переменную степень окисления, то активные неметаллы (фтор, хлор, бром, кислород) окисляют его до более высокой степени окисления, в которой он образует устойчивое в данных условиях соединение, а менее активные — до более низкой степени окисления. Так, железо проявляет в соединениях степени окисления +2 и +3 (иногда +6), из них +3 наиболее устойчива. В связи с этим при взаимодействии железа с хлором, бромом оно окисляется до степени окисления +3, а при взаимодействии с серой или иодом — до степени окисления +2:
2Fe + ЗС12 = 2 FeCl3 Fe + S = FeS
Щелочные и щелочно-земельные металлы при нагревании вступают в реакцию с водородом, образуя гидриды. Атомы водорода в данных соединениях имеют отрицательную степень окисления:
2Na + Н2 = 2NaH Ва + Н2 = BaH2
гидрид гидрид
натрия бария
Гидриды представляют собой кристаллические тугоплавкие солеобразные вещества белого цвета. Они активные восстановители за счет водорода в минимальной степени окисления (-1). Так, гидриды горят в атмосфере хлора, кислорода, энергично разлагаются водой с образованием щелочи и выделением водорода:
КН + С12 = КС1 + НС1 СаН2 + 02 = Са(ОН)2
ВаН2 + 2Н20 = Ва(ОН)2 + 2Н2
Гидриды применяют для получения водорода в полевых условиях (для водородной сварки), восстановления металлов из их оксидов, а также в органическом синтезе.
2). Взаимодействие металлов со сложными веществами
Если химические реакции протекают в водных растворах, то восстановительная активность металла определяется его положением в электрохимическом ряду напряжений.
А). Взаимодействие с водой
С водой при обычной температуре реагируют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды) и гидроксиды которых растворимы в воде (на поверхности металла не образуется защитная пленка). К таким металлам относятся щелочные и щелочно-земельные металлы:
2Na + 2Н20 = 2NaOH + Н2
Fe + Н20 (так как Fe(OH)2 нерастворим в воде)
При нагревании с водой или парами воды взаимодействуют металлы от магния до олова. Реакция протекает с образование» гидроксидов или оксидов и выделением водорода:
Mg + 2Н20 = Mg(OH)2 + Н2 3Fe + 4Н20 = Fe304 + 4H2
Б). Взаимодействие с щелочами
С растворами щелочей взаимодействуют металлы, которые в ряду напряжений стоят до водорода (металл вытесняет водород из воды), а их оксиды и гидроксиды амфотерны (оксидные и гидроксидные пленки растворяются в растворе щелочи). К таким металлам относятся цинк, алюминий, олово, бериллий, свинец и некоторые другие. Процесс протекает в три стадии:
1) растворение в щелочи пленки амфотерного оксида, которая покрывает поверхность металла;
2) взаимодействие металла, освобожденного от защитной оксидной пленки, с водой с образованием нерастворимого амфотерного гидроксида;
3) растворение образовавшейся пленки гидроксида в растворе щелочи.
Рассмотрим пример:
А1203 + 2NaOH + ЗН20 = 2Na[Al(OH)4]
амфотерный
2А1 + 6Н20 = 2А1(0Н)3 + ЗН2
амфотерный
2А1(ОН)3 + 2NaOH = 2Na[Al(OH)4)
амфотерный
(В результате второй реакции образовалось 2 моль А1(ОН)3, поэтому в уравнении третьей реакции записываем тоже 2 моль А1(ОН)3.)
Если просуммировать два последних уравнения, то получим уравнение реакции алюминия с раствором щелочи:
2А1 + 2NaOH + 6Н20 = 2Na[Al(OH)4) + ЗН2
Таким образом, при взаимодействии металла с раствором щелочи роль последней сводится к снятию с поверхности металла оксидной и гидроксидной пленки, а металл взаимодействует с водой.
Эти же металлы реагируют со щелочами при нагревании:
Zn + 2NaOH = Na2Zn02 + Н2
тв.
Металлы, высшие оксиды которых обладают амфотерными или кислотными свойствами, реагируют с щелочными расплава ми окислителей. В качестве окислителей используют нитраты калия или натрия, хлорат калия и др.
При взаимодействии с щелочными расплавами окислителей металлы образуют соли анионного типа, в которых, как правило, проявляют высшую степень окисления, например: +6
Fe + 3KN03 + 2КОН = K2Fe04 + 3KN02 + Н20
феррат калия
Аналогичные продукты образуются и при взаимодействии щелочных расплавов окислителей с оксидами металлов, в которых металлы проявляют промежуточную степень окисления: +3 +6
Fe203 + КСЮ3 + 4КОН = 2K2Fe04 + КС1 + 2Н20
В). Взаимодействие с кислотами
С разбавленными кислотами, которые проявляют окислительные свойства за счет ионов водорода (разбавленная серная, фосфорная, сернистая, все бескислородные и органические кислоты и др.), реагируют металлы:
расположенные в ряду напряжений до водорода (эти металлы способны вытеснять водород из кислоты);
образующие с этими кислотами растворимые соли (на поверхности этих металлов не образуется защитная солевая пленка).
В результате реакции образуются растворимые соли и выделяется водород:
2А1 + 6НС1 = 2А1С13 + 3Н2 Mg + H2S04 = MgS04 + H2
разб.
Сu + H2S04 (так как Сu стоит после Н2)
разб.
Pb + H2S04 (так как PbS04 нерастворим в воде)
разб.
С кислотами-окислителями — азотной и концентрированной серной, которые, как вам известно, проявляют окислительные свойства за счет атомов серы и азота в высших степенях окисления, взаимодействуют практически все металлы, расположенные в ряду напряжений как до, так и после водорода, кроме золота и платины. Так как окислителями в этих кислотах являются ионы кислотных остатков, а не ионы водорода, то прн их взаимодействии с металлами не выделяется водород. Металл под действием данных кислот окисляется до характерной (устойчивой) степени окисления и образует соль, а продукт восстановления кислоты зависит от активности металла и от степени разбавления кислоты.
Г). Взаимодействие металлов с кислотами-окислителями -2
активный металл Li — Zn Соль + H2S + Н20
+6 0
H2S04 (конц.) металл средней активности Cd — Pb Соль + S + Н20
+4
неактивный металл (после Н2) Соль + S02 + Н20
и Fe (при нагревании)
+4
HNO3((конц.) независимо от активности металла Соль + N02 + Н20
активный металл Li — Zn Соль + N2 + Н20
+1
HN03 (разб.) металл средней активности Fe — Pb Соль + N2O + Н20
+4
неактивный металл (после Н2) Соль + N0 + Н20
и Fe (при нагревании)
-3
HN03 (оч. разб.) активный металл Соль+ NH4N03 + H20
На основании схемы составим уравнения реакций меди и магния с концентрированной серной кислотой:
0 +6 +2 +4 0 +6 +2 -2
Сu+ 2H2S04 = CuS04 + S02 + 2Н20 4Mg + 5H2S04 = 4MgS04 + H2S + 4H20
kонц. kонц.
Следует иметь в виду, что на схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот. Так, при взаимодействии серной кислоты с цинком или магнием в зависимости от концентрации кислоты могут образоваться различные продукты восстановления серной кислоты:
Zn + 2H2S04 = ZnS04 + S02 + 2H20
70%-ная
3Zn + 4H2S04 = 3ZnS04 + S + 4H20
40% -ная
4Zn + 5H2S04 = 4ZnS04 + H2S + 4H20
25% -ная
Восстановление серной кислоты до сероводорода может протекать в растворе с массовой долей кислоты 25% и выше (если массовая доля серной кислоты ниже 25% , то она считается разбавленной). Однако по мере повышения концентрации кислоты возможность образования сероводорода уменьшается, так как при этом окислительные свойства серной кислоты усиливаются, а сероводород — активный восстановитель за счет атома серы в минимальной степени окисления (H2S). Поэтому концентрированная серная кислота окислит его до серы или до сернистого газа:
-2 +6 0
3H2S + H2S04 = 4S + 4Н20 (менее концентрированная H2S04)
-2 +6 +4
Н2S + 3H2S04 = 4S02 + 4H20 (более концентрированная H2S04)
Степень восстановления азотной кислоты при взаимодействии с одним и тем же металлом, например магнием или цинком, также определяется ее концентрацией. Концентрированная кислота восстанавливается до оксида азота (IV), так как низшие оксиды, образованные в ходе реакции, окисляются кислотой. По мере ее разбавления возрастает возможность образования продукта наиболее полного восстановления:
Mg + 4HN03 = Mg(N03)2 + 2N02 + 2H20
60% -ная
3Mg + 8HN03 = 3Mg(NOg)2 + 2NO + 4H20
30% -ная
4Mg + 10HN03 = 4Mg(N03)2 + N20 + 5H20
20% -ная
5Mg + 12HN03 = 5Mg(N03)2 + N2 + 6H20
10% -ная
4Mg + 10HN03 = 4Mg(N03)2 + NH4N03 + 3H20
3% -ная
Некоторые металлы (железо, алюминий, хром) не взаимодействуют с концентрированной серной и азотной кислотами при обычной температуре, так как происходит пассивация металла. Это явление связано с образованием на поверхности металла тонкой, но очень плотной оксидной пленки, которая и защищает металл. По этой причине концентрированную азотную и серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, проявляющими окислительные свойства за счет ионов Н+, он образует соли, в которых его степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых он проявляет более устойчивую степень окисления:
0 +2
Fe + H2S04 = FeS04 + H2
разб.
0 +3
2Fe + 6H2S04 = Fe2(S04)3 + 3S02 + 6H20
конц.
Д).Взаимодействие с растворами солей
Каждый металл, начиная с магния, вытесняет все следующие за ним в ряду напряжений металлы из растворов их солей:
Fe + CuS04 = FeS04 + Сu
Такие металлы, как литий, натрий, калий, кальций, барий. использовать для вытеснения менее активных металлов из водных растворов солей нельзя, так как при обычных условиях они реагируют с водой.
Источник
