Какие химические свойства характерны для оксида кальция

Оксид кальция, характеристика, свойства и получение, химические реакции.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Оксид кальция – неорганическое вещество, имеет химическую формулу CaO.
Краткая характеристика оксида кальция
Физические свойства оксида кальция Иные свойства оксида кальция
Получение оксида кальция
Химические свойства оксида кальция
Химические реакции оксида кальция
Применение и использование оксида кальция
Краткая характеристика оксида кальция:
Оксид кальция – неорганическое вещество, порошок от белого до бледно-жёлтого цвета либо бесцветные кристаллы. Не имет запаха.
Так как валентность кальция равна двум, то оксид кальция содержит один атом кислорода и один атом кальция.
Химическая формула оксида кальция CaO.
Оксид кальция широко известен как негашёная известь.
Оксид кальция в воде не растворяется, а вступает в реакцию с ней. Практически не растворяется в этаноле. Не растворяется в диэтиловом эфире.
Оксид кальция относится к высокотоксическим веществам. Класс опасности 2. Это едкое вещество, особенно опасен при смешивании с водой.
Препарат в виде пыли и капель взвеси раздражает слизистые оболочки органов дыхания, попадая на кожу, вызывает тяжелые ожоги, особенно сильно действует на слизистую оболочку глаз.
Предельно допустимая концентрация в воздухе рабочей зоны производственных помещений – 3 мг/м3.
При работе с препаратом следует применять индивидуальные средства защиты (респираторы, защитные очки, резиновые перчатки), а также соблюдать меры личной гигиены. Не допускать попадания препарата на слизистые оболочки и на кожу.
Помещения, в которых проводятся работы с препаратом, должны быть оборудованы общей приточно-вытяжной вентиляцией, а места наибольшего пыления – укрытиями с местной вытяжной вентиляцией. Испытания препарата в лабораториях следует проводить в вытяжном шкафу.
При проведении анализа окиси кальция с использованием горючего газа следует соблюдать меры противопожарной безопасности.
См. ГОСТ 8677-76 Реактивы. Кальция оксид. Технические условия (с Изменением N 1).
Физические свойства оксида кальция:
| Наименование параметра: | Значение: |
| Химическая формула | CaO |
| Синонимы и названия иностранном языке | calcium oxide (англ.) известь негашеная (рус.) кальция окись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | порошок от белого до бледно-жёлтого цвета либо бесцветные кристаллы, без запаха |
| Цвет | бесцветный, от белого до бледно-жёлтого |
| Вкус | —* |
| Запах | не имеет |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3370 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,37 |
| Температура кипения, °C | 2850 |
| Температура плавления, °C | 2570 |
| Температура возгонки (сублимации), °C | не имеет |
| Температура разложения, °C | не имеет |
| Молярная масса, г/моль | 56,0774 |
* Примечание:
— нет данных.
Получение оксида кальция:
Оксид кальция получается в результате следующих химических реакций:
- 1. путем термического разложения известняка:
Сa2СО3 → CaО + СО2 (t = 900-1200 oC).
Это промышленный способ получения оксида кальция. Технологически данный процесс в промышленности реализуют в специальных шахтных печах.
- 2. путем сжигания кальция на воздухе:
2Сa + О2 → 2CaО (t = 300 oC).
- 3. путем термического разложения гидроксида кальция:
Сa(OH)2 → СaO + H2О (t = 520-580 oC).
- 4. путем термического разложения нитрата кальция:
2Сa(NO3)2 → 2СaO + 4NO2 + O2 (t = 450-500 oC).
Химические свойства оксида кальция. Химические реакции оксида кальция:
Оксид кальция относится к основным оксидам.
Химические свойства оксида кальция аналогичны свойствам основных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида кальция с хлором:
2CaO + 2Cl2 → 2CaCl2 + O2 (t = 700 oC).
В результате реакции образуется хлорид кальция и кислород.
2. реакция оксида кальция с кремнием:
2CaO + 5Si → 2CaSi2 + SiO2 (t = 1300 oC).
В результате реакции образуется силицид кальция и оксид кремния.
3. реакция оксида кальция с углеродом:
CaО + 3С → CaС2 + СО (t = 1900-1950 oC);
2CaO + 5C → 2CaC2 + CO2 (t = 700 oC).
В результате реакции образуется карбид кальция и оксид углерода.
4. реакция оксида кальция с алюминием:
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 oC);
2Al + 6CaO → 3CaO•Al2O3 + 3Ca (to);
2Al + 6CaO → Ca3Al2O6 + 3Ca (to).
В результате реакции образуется кальций и соответственно алюминат кальция, оксид алюминия-кальция и алюмината трикальция.
5. реакция оксида кальция с водой:
CaО + Н2О → Ca(ОН)2.
Оксид кальция реагирует с водой, образуя гидроксид кальция. Процесс имеет название «гашение извести». Химическая реакция происходит с выделением энергии (тепла).
6. реакция оксида кальция с оксидом углерода (углекислым газом):
CaО + СО2 → CaСО3.
Оксид кальция реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат кальция.
7. реакция оксида кальция с оксидом серы:
CaО + SО2 → CaSО3;
CaО + SО3 → CaSО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит кальция, во втором случае – сульфат кальция.
8. реакция оксида кальция с оксидом кремния:
CaО + SiО2 → CaSiО3 (t = 1100-1200 oC).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат кальция.
9. реакция оксида кальция с оксидом фосфора:
CaO + P2O5 → Ca(PO3)2;
3CaO + P2O5 → Ca3(PO4)2 (to);
2CaO + P2O5 → Ca2P2O7.
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль соответственно: метафосфат кальция, фосфат кальция и дифосфата кальция.
Аналогично проходят реакции оксида кальция и с другими кислотными оксидами.
10. реакция оксида кальция с оксидом алюминия:
CaО + Al2O3 → Ca(AlО2)2 (t = 1200-1300 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат кальция.
11. реакция оксида кальция с оксидом марганца:
CaО + MnO2 → CaMnO3 (t°);
Mn2O3 + CaO → CaMn2O4 (t = 900 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соответственно: соль – манганит кальция либо оксид марганца-кальция.
Аналогично проходят реакции оксида кальция и с другими амфотерными оксидами.
12. реакция оксида кальция с оксидом свинца:
СaО + 2PbO2 → Сa2PbО4 (tо).
В результате реакции образуется соль – плюмбит кальция. Реакция протекает при сплавлении реакционной смеси.
Аналогично проходят реакции оксида кальция и с другими оксидами.
13. реакция оксида кальция с тетраоксидом диазота:
СaО + 2N2О4 → N2O3 + Сa(NO3)2 (t = 250 °C).
Реакция идет в жидком тетраоксиде диазота. В результате реакции образуются оксид азота (III) и соль – нитрат кальция.
14. реакция оксида кальция с плавиковой кислотой:
СaO + 2HF → СaF2 + H2O.
В результате химической реакции получается соль – фторид кальция и вода.
15. реакция оксида кальция с азотной кислотой:
СaO + 2HNO3 → 2Сa(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат кальция и вода.
Аналогично проходят реакции оксида кальция и с другими кислотами.
16. реакция оксида кальция с бромистым водородом (бромоводородом):
СaO + 2HBr → СaBr2 + H2O.
В результате химической реакции получается соль – бромид кальция и вода.
17. реакция оксида кальция с йодоводородом:
СaO + 2HI → СaI2 + H2O.
В результате химической реакции получается соль – йодид кальция и вода.
Применение и использование оксида кальция:
Оксид кальция используется в производстве строительных материалов, в качестве пищевой добавки E-529.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид кальция реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида кальция
реакции с оксидом кальция
Коэффициент востребованности
4 895
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 января 2018; проверки требуют 34 правки.
Окси́д ка́льция (окись кальция, негашёная и́звесть) — белое кристаллическое вещество, формула CaO.
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь, или «пушонка») находят обширное использование в строительном деле.
Получение[править | править код]
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ, на практике в виде корки на металле:
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Физические свойства[править | править код]
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической кристаллической решётке, по типу хлорида натрия.
Химические свойства[править | править код]
Оксид кальция относится к основным оксидам. Энергично взаимодействует с водой с выделением тепла и образованием гидроксида кальция, насыщенный раствор которого является сильным основанием:
+ 63,7 кДж/моль.
При температуре выше 580 °C [источник не указан 976 дней] эта реакция обратима.
Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли:
При нагревании с углеродом в высокотемпературной печи или электрической дуге образует карбид кальция (используемый для получения ацетилена):
Несмотря на массовое промышленное производство ацетилена более эффективными способами, эта реакция сохраняет небольшое практическое значение, так как карбид кальция является удобным источником ацетилена в лабораторной практике и в аппаратах для сварочных работ.
Применение[править | править код]
В настоящее время в основном используются в производстве строительных материалов, высокоглиноземистого цемента, силикатного кирпича и т.д.
До второй половины XX века известь широко использовали в качестве строительной побелки — прокаленный мел или известняк (оксид кальция) при смешивании с водой образует ярко-белую гашеную известь (Ca(OH)2), обладающую хорошими адгезионными свойствами к различным поверхностям. Далее известь медленно поглощает из воздуха углекислый газ, покрываясь коркой карбоната кальция. В настоящее время известковый раствор при строительстве жилых домов практически не применяется в виду значительной гигроскопичности (склонности поддерживать высокую влажность, провоцирующую рост плесени) и сложности производства работ, уступив место более эффективным материалам.
В лабораторной практике оксид кальция используется как дешевый и эффективный агент для осушения растворителей и жидких веществ.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E-529.
В промышленности водный раствор используют в одном из способов удаления диоксида серы из дымовых газов. В результате реакции гашеной извести Са(OH)2 и диоксида серы получается осадок сульфита кальция СаSO3. В настоящее время вытеснен современными абсорберами на основе четвертичных аммонийных соединений, способных обратимо связывать SO2 и CO2.
Использовался в «саморазогревающейся» посуде. Оксид кальция, помещенный между двух стенок емкости, при прокалывании капсулы с водой реагирует с ней с выделением тепла.
Безопасность[править | править код]
Оксид кальция относится к высокоопасным веществам. (Класс опасности 2). Это едкое вещество, особенно опасен при смешивании с водой.
В виде пыли или капель взвеси раздражают слизистые, вызывая чихание и кашель.
Действие CaO, подобно действию щелочи, состоит в омылении жиров, поглощении из кожи влаги, растворении белков, раздражении и прижигании тканей.
Сильно действует на слизистую глаз. На слизистой рта и носа наблюдаются поверхностные изъязвления; иногда прободение носовой перегородки.
Страдают также глубокие дыхательные пути.
Примечания[править | править код]
Литература[править | править код]
- Крупский А. К., Менделеев Д. И. Известь, в технике // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Монастырев А. Производство цемента, извести. Москва, 2007.
- Штарк Йохан, Вихт Бернд. Цемент и известь (перевод с немецкого). Киев, 2008.
- Осин Б.В. Негашеная известь как новое вяжущее вещество. Москва, 1954
Источник
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.

Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
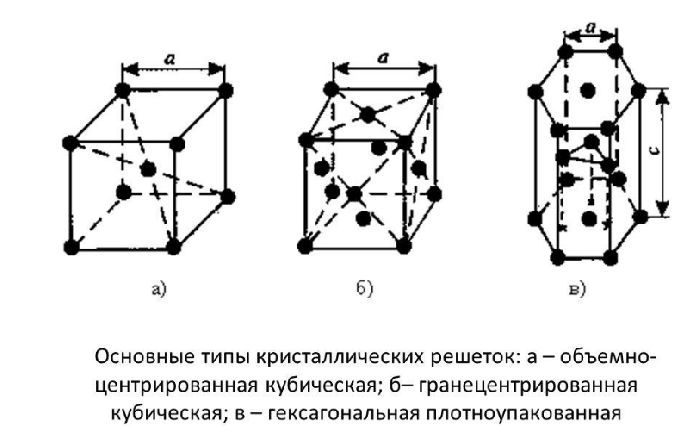
Рис. 1. Кубические гранецентрированные кристаллические решётки.
Общее описание вещества представлено в таблице.
Признак | Значение |
Формула соединения оксид кальция | CaO |
Температура плавления | 2627°C |
Температура кипения | 2850°C |
Растворимость | В глицерине. В этаноле не растворяется, с водой образует гидроксид |
Молярная масса | 56,077 г/моль |
Плотность | 3,37 г/см3 |
Химическая связь в кристалле | Ионная |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.

Рис. 2. Порошок оксида кальция.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Это природное вещество, встречающееся в форме минералов – арагонита, ватерита, кальцита. Входит в состав мрамора, мела, известняка.
Реакция получения оксида кальция из известняка выглядит следующим образом:
CaCO3 → CaO + CO2.
Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле –
2Ca + O2 → 2CaO;
- при термической обработке гидроксида или солей кальция –
Ca(OH)2 → CaO + H2O; 2Ca(NO3)2 → 2CaO + 4NO2 + O2.
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции | Что образуется | Молекулярное уравнение |
С водой | Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла | CaO + H2O → Ca(OH)2 |
С кислотами | Растворяется, образуя соли | CaO + 2HCl → CaCl2 +H2O |
С оксидами неметаллов (кислотными остатками) | Образуются соли | CaO + SO2 → CaSO3 |
С углеродом при нагревании | Образуется карбид кальция | CaO + 3С → СаС2 + CO |
С алюминием | Восстанавливает кальций. Образуется оксид алюминия | 3CaO + 2Al → Са + Al2O3 |
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупорных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.

Рис. 3. Цемент, кирпич, гипс получают из оксида кальция.
Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Сергей Ефремов
4/10
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 80.
Источник
Оксид кальция – это кристаллическое соединение белого цвета. Другие названия этого вещества – негашеная известь, окись кальция, «кирабит», «кипелка». Оксид кальция, формула которого CaO, и его продукт взаимодействия с (H2O) водой – Ca(OH)2 («пушонка», или гашеная известь) нашли широкое применение в строительном деле.
Как получают оксид кальция?
1. Промышленный способ получения данного вещества заключается в термическом (под воздействием температуры) разложении известняка (кальция карбоната):
CaCO3 (известняк) = CaO (кальция оксид) + CO2 (углекислый газ)
2. Также кальция оксид можно получить посредством взаимодействия простых веществ:
2Ca (кальций) + O2 (кислород) = 2CaO (кальция оксид)
3. Третий способ получения оксида кальция заключается в термическом разложении кальция гидроксида (Ca(OH)2) и кальциевых солей нескольких кислородсодержащих кислот:
2Ca(NO3)2 (нитрат кальция) = 2CaO (получаемое вещество) + 4NO2 (оксид азота) + O2 (кислород)
Физические свойства оксида кальция
1. Внешний вид: кристаллическое соединение белого цвета. Кристаллизуется по типу хлорида натрия (NaCl) в кубической кристаллической гранецентрированной решетке.
2. Молярная масса составляет 55,07 грамм/моль.
3. Плотность равна 3,3 грамм/сантиметр³.
Термические свойства оксида кальция
1. Температура плавления равна 2570 градусов
2. Температура кипения составляет 2850 градусов
3. Молярная теплоёмкость (при стандартных условиях) равна 42.06 Дж/(моль·К)
4. Энтальпия образования (при стандартных условиях) составляет -635 кДж/моль
Химические свойства оксида кальция
Оксид кальция (формула CaO) – это основной оксид. Поэтому он может:
– растворяться в воде (H2O) с выделением энергии. При этом образуется гидроксид кальция. Эта реакция выглядит так:
CaO (оксид кальция) + H2O (вода) = Ca(OH)2 (кальциевый гидроксид) + 63,7 кДж/моль;
– реагировать с кислотами и кислотными оксидами. При этом образуются соли. Вот примеры реакций:
CaO (кальциевый оксид) + SO2 (сернистый ангидрид) = CaSO3 (сульфит кальция)
CaO (кальциевый оксид) + 2HCl (соляная кислота) = CaCl2 (кальциевый хлорид) + H2O (вода).
Применение оксида кальция:
1. Основные объемы рассматриваемого нами вещества используются при производстве силикатного кирпича в строительстве. Раньше негашеную известь использовали в качестве известкового цемента. Его получали при ее смешивании с водой (H2O). В результате оксид кальция переходил в гидроксид, который потом, поглощая из атмосферы углекислый газ (CO2), сильно твердел, превращаясь в кальция карбонат (CaCO3). Несмотря на дешевизну этого метода, в настоящее время цемент известковый практически не применяется в строительстве, так как он обладает способностью хорошо впитывать и накапливать в себе жидкость.
2. В качестве огнеупорного материала оксид кальция подходит как недорогой и доступный материал. Плавленый кальциевый оксид имеет устойчивость к воздействию воды (H2O), что позволило его применять в качестве огнеупора там, где использование дорогостоящих материалов нецелесообразно.
3. В лабораториях используют высший оксид кальция для сушения тех веществ, которые с ним не реагируют.
4. В пищевой отрасли данное вещество зарегистрировано в качестве пищевой добавки под обозначением Е 529. Используется в качестве эмульгатора для создания однородной смеси из несмешиваемых между собой веществ – воды, масла и жира.
5. В промышленности кальциевый оксид используют для удаления сернистого ангидрида (SO2) из дымовых газов. Применяют, как правило, 15% раствор водяной. В результате реакции, в которой взаимодействуют гашеная известь и диоксид серы, получается гипс CaCO4 и CaCO3. При проведении экспериментов ученые добивались показателя в 98% отчистки дыма от диоксида серы.
6. Используется в специальной «самогреющейся» посуде. Емкость с небольшим количеством кальциевого оксида располагается между двух стенок сосуда. При прокалывании капсулы в воде начинается реакция с выделением некоторого количества тепла.
Источник
