Какие химические свойства характерны для спиртов
Спирты – кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у
насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда – метанол – CH3OH.
Общая формула их гомологического ряда – CnH2n+1OH.
Классификация спиртов
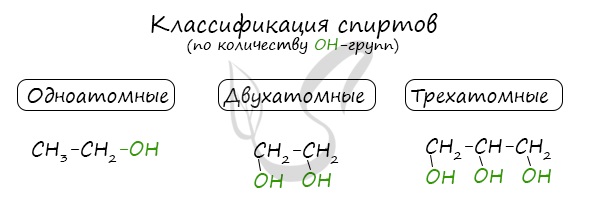
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH – гликоли), трехатомными (3 группы
OH – глицерины) и т.д.
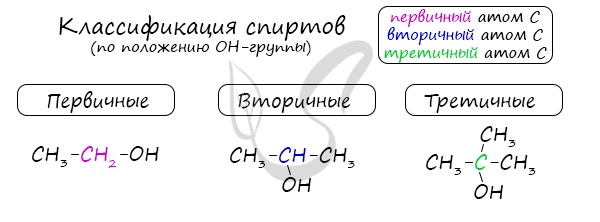
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода),
вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
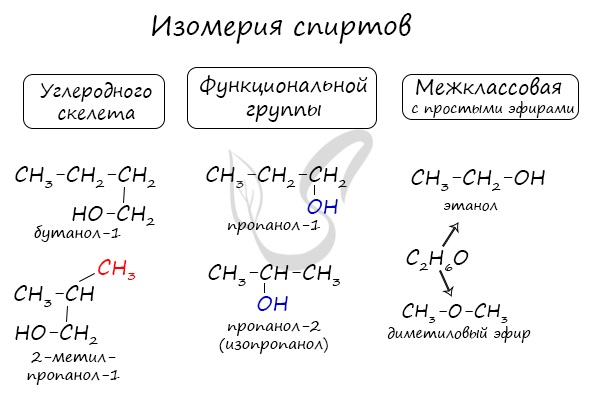
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса “ол” к названию алкана с соответствующим числом атомов углерода: метанол,
этанол, пропанол, бутанол, пентанол и т.д.
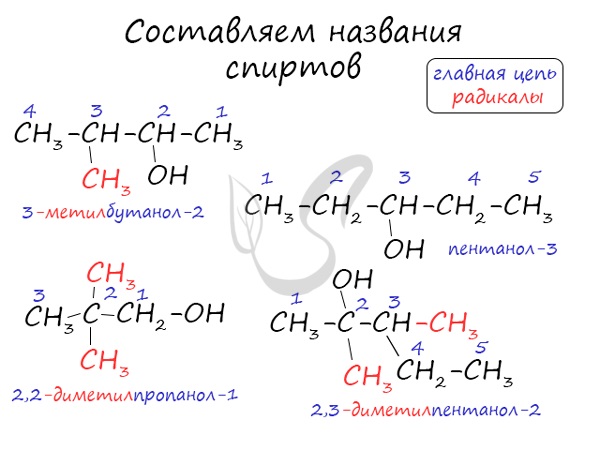
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с
простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
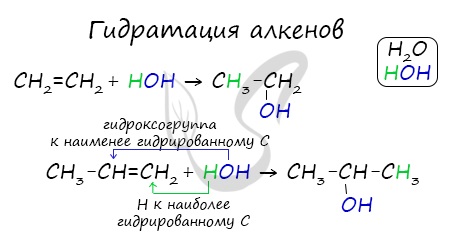
- Гидратация алкенов
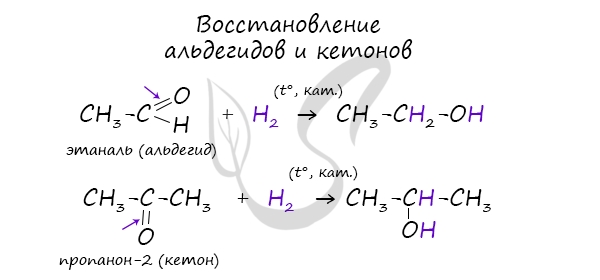
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
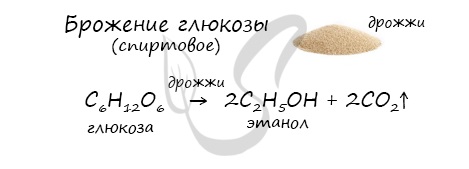
- Получение этанола брожением глюкозы
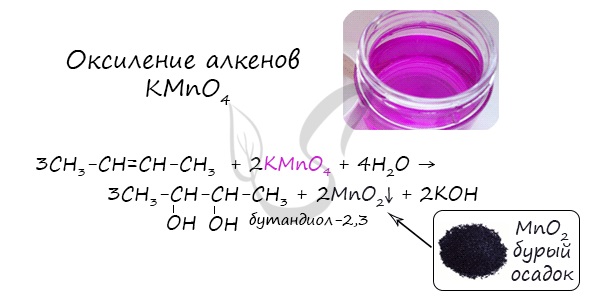
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПиртовым раствором щелочи получаются Пи-связи (π-связи) – алкены, а в реакциях с водным раствором
щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных
химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.

В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы – образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения.
У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии – кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир – CH3-O-CH3
- Метилэтиловый эфир – CH3-O-C2H5
- Диэтиловый эфир – C2H5-O-C2H5
- Окисление спиртов
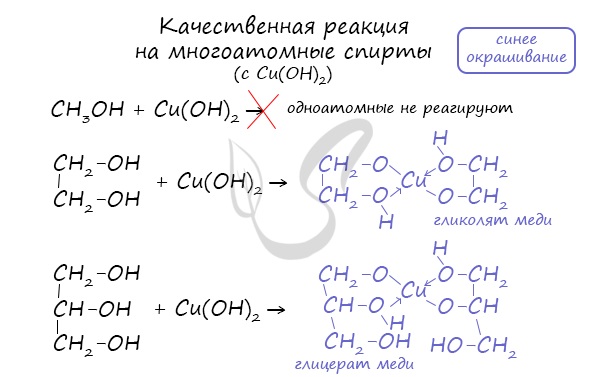
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся
алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
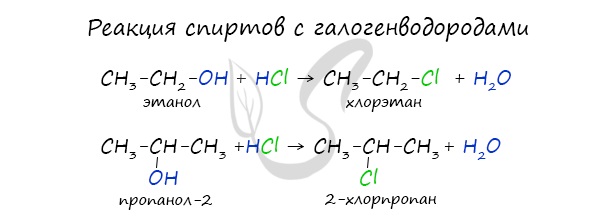
В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный – образуются алкены.
Названия простых эфиров формируются проще простого – по названию радикалов, входящих в состав эфира. Например:

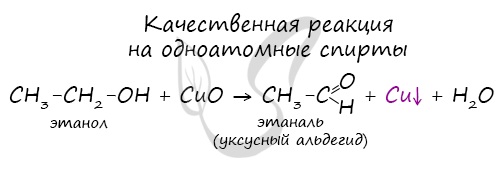
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при
которых углеродный скелет подвергается деструкции.
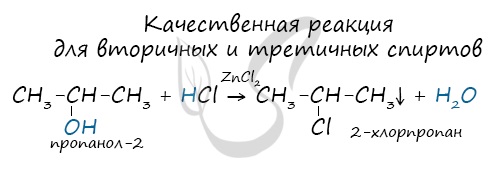
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой
реакции выпадает маслянистый осадок.
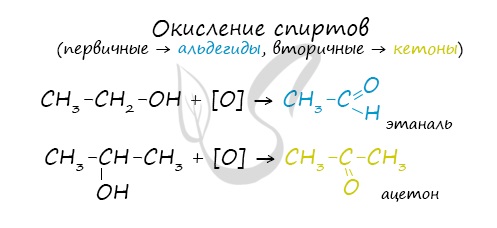
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов. Альдегиды могут быть окислены далее – до карбоновых кислот, в отличие
от кетонов, которые являются “тупиковой ветвью развития” и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор
окрашивается в характерный синий цвет.
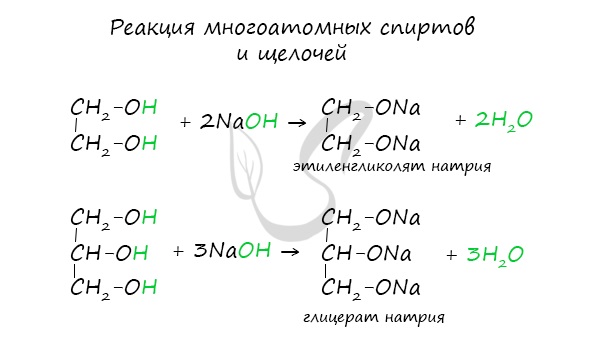
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов).
Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Строение гидроксогруппы
Благодаря положительному индуктивному эффекту (+I) углеводородного радикала водород в OH-группе менее подвижен, чем в воде.

С увеличением числа углеводородных заместителей у атома углерода, соединенного с гидроксильной группой, индуктивный эффект увеличивается и кислые свойства спиртов (то есть способность отщеплять протон $H^+$) еще больше снижаются:

Кислотные свойства спиртов могут увеличиваться при введении в радикал электроотрицательных атомов или групп, например, галогенов. В этом случае за счет отрицательного индуктивного эффекта (-I) общая электронная пара между кислородом и водородом в гидроксиле смещается к кислороду и кислые свойства протона $H^+$ увеличиваются:

Таким образом. в целом спирты проявляют нейтральные свойства. Рассмотрим их подробнее.
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
1. Подобно воде, спирты реагируют с щелочными металлами с образованием алкоголятов и выделением водорода:
$mathrm{2R–OH + 2Na = 2R–ONa + H_2}$
Образующие алкоголяты необратимо гидролизуются водой.
2. С карбоновыми кислотами спирты образуют сложные эфиры (реакция этерификации):
$mathrm{R–OH + R’–COOH rightleftharpoons R’–COOR + H2O}$
3. Гидроксильная группа может быть замещена галогеном при действии галогеноводородов или галогенидов фосфора ($PBr_3, PCl_5$):
$mathrm{R–OH + HHal = R–Hal + H_2O}$
$mathrm{R–OH + PCl_5 = R–Cl + HCl + POCl_3}$
Галогеналканы также можно получить из спиртов действием галогенводородной кислоты в присутствии серной кислоты:
$C_2H_5OH + HClxrightarrow[]{H_2SO_4}C_2H_5Cl + H_2O$
4. Спирты вступают в реакции элиминирования. Так, в зависимости от условий, дегидратация спиртов может приводить к образованию алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация), при этом, благодаря индуктивному эффекту, дегидратация третичных спиртов проходит проще, чем первичных.
5. При каталитическом дегидрировании одноатомных спиртов образуются альдегиды или кетоны:

6. Первичные спирты в мягких условиях окисляются последовательно до альдегидов и затем – до кислот:

При окислении метанола перманганатом калия происходит окислительно-восстановительная реакция, в результате которой образуется образуется карбонат калия, а марганец восстанавливается до С.О. +4 (нейтральная среда):
$CH_3-OH + 2KMnO_4 = K_2CO_3 + 2MnO_2 + 2H_2O$
$C^{-2} – 6bar{e} rightarrow C^{+4} hspace{1cm}| 1$
$Mn^{+7} – 6bar{e} rightarrow Mn^{+4} hspace{0.6cm}| 2$
Вторичные спирты окисляются до кетонов:

Окисление третичных спиртов проходит с большим трудом. При этом происходит его окислительная деструкция с образованием смеси карбонильных и карбоксильных соединений. В жестких условиях спирты также окисляются до углекислого газа.
Горение спиртов сопровождается выделением углекислого газа и воды:
$2C_3H_7OH + 9O_2 = 6CO_2uparrow + 8H_2O$
7. Кроме реакций, затрагивающих OH-группу, возможно радикальное галогенирование углеводородного радикала.
простые Эфиры
Определение
Простые эфиры – органические вещества состава R–O–R’, где R и R’ – углеводородные радикалы.
Выделяют симметричные (с одинаковыми радикалами) и несимметричные (с разными радикалами) эфиры. Существуют циклические эфиры, которые получаются из многоатомных спиртов, например оксиран, диоксан.
В отличие от спиртов, у эфиров более низкие температуры плавления и кипения. Диметиловый эфир – газ, большинство эфиров – жидкости. Эфиры хорошо растворяются в воде. Являются органическими растворителями.
Для простых эфиров характерна изомерия углеродного скелета и метамерия (расположение атома кислорода в УВ цепи). Понятие метамерии редко используется в органической химии.
Химические свойства простых эфиров
Простые эфиры достаточно инертные вещества.
1. Расщепление (разрыв С-О-связи). Эфирная связь расщепляется под действием концентрированных галогеноводородных кислот при нагревании:
$mathrm{R–O–R’ + HHal = RHal + R’OH}$
Под действием избытка кислоты образовавшийся спирт дает соответствующее галогенпроизводное.
В случае эфира с ароматическим радикалом (Ar) расщепление происходит следующим образом:
$mathrm{Ar–O–R + HHal =RHal + ArOH}.
Реакционная способность галогеноводородных кислот в этих реакциях уменьшается от иодноводородной к хлороводородной.
Под действием концентрированной серной кислоты (лучше олемума) происходит расщепление эфиров с образованием спиртов (и продуктов их дегидратации) и сульфоновых кислот:
$mathrm{C_2H_5–O–C_2H_5 + HO–SO_3H = C_2H_5SO_3H + C_2H_5OH}$
2. Окисление простых эфиров. При окислении простых эфиров образуются органические пероксидные соединения. При стоянии на воздухе образуются перекиси эфиров R–O–O–R’. Наличие перекисей определяется по покраснению водного раствора соли Мора (двойная соль железа (II) и роданида натрия. Перекиси очень опасные вещества: даже в небольших количествах они взрывоопасны.
Получение простых эфиров
1. Простые симметричные эфиры получают межмолекулярной дегидратацией соответствующих спиртов в присутствии концентрированной серной кислоты при нагревании при температуре ниже $140-150^оС$. Этот способ позволяет получить симметричные алкильные эфиры.
2. Для синтеза несимметричных эфиров используется синтез Вильямсона: алкоголят- или фенолят-ион реагирует с галогензамещенным углеводородом (аналог реакции Вюрца):
$mathrm{CH_3Cl + Na–O–C(CH_3)_3 = CH_3–O–C(CH_3)_3 + NaCl}$
$mathrm{C_6H_5ONa + C_2H_5Br = C_6HH_5–O–C_2H_5 + NaBr}$
Выбирая реагенты для синтеза Вильямсона следует учитывать тенденцию к элиминированию, которое является конкурентным по отношению к образованию эфира. Эта тенденция уменьшается в ряду от третичных к первичным галогенпроизводным. Поэтому для получения этилтриметипропанового эфира необходимо использовать этилгалогенид, а не третбутиллогенид.
3. Для получения метиловых эфиров используют диметилсульфат $mathrm{(CH_3)_2SO_4}$.
Применение простых эфиров
Эфиры используются в органическом синтезе, в качестве растворителей, раньше широко использовались в медицине. Первый наркоз с помощью диэтилового эфира был проведен Пироговым при операциях раненых в Первой мировой войне. Сегодня диэтиловый эфир используется в стоматологии для быстрого высушивания поверхности пломбируемого зуба.
$
Источник
Общая формула гомологического ряда предельных одноатомных спиртов CnH2n+1OH . В названии спиртов присутствует суффикс – ол.
В зависимости от числа гидроксильных групп спирты делят на одно- (CH3OH — метанол, C2H5OH — этанол), двух- (CH2
(OH)-CH2-OH — этиленгликоль) и трехатомные (CH2(OH)-CH(OH)-CH2-OH — глицерин). В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают первичные (R-CH2-OH), вторичные (R2CH-OH) и третичные спирты (R3C-OH).
Для предельных одноатомных спиртов характерна изомерия углеродного скелета (начиная с бутанола), а также изомерия положения гидроксильной группы (начиная с пропанола) и межклассовая изомерия с простыми эфирами.
СН3-СН2-СН2-СН2-ОН (бутанол – 1)
СН3-СН(СН3)- СН2-ОН (2-метилпропанол – 1)
СН3-СН(ОН)-СН2-СН3 (бутанол – 2)
СН3-СН2-О-СН2-СН3 (диэтиловый эфир)
Химические свойства спиртов
1. Реакция, протекающие с разрывом связи О-Н:
— кислотные свойства спиртов выражены очень слабо. Спирты реагируют с щелочными металлами
2C2H5OH + 2K → 2C2H5OK + H2
но не реагируют с щелочами. В присутствии воды алкоголяты полностью гидролизуются:
C2H5OK + Н2О → C2H5OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода
— образование сложных эфиров под действием минеральных и органических кислот:
CH3-CO-OH + H-OCH3 ↔ CH3COOCH3 + H2O
— окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты.
R-CH2-OH + [O] → R-CH = O + [O] → R-COOH
Вторичные спирты окисляются в кетоны:
R-CH(OH)-R’ + [O] → R-C(R’) = O
Третичные спирты более устойчивы к окислению.
2. Реакция с разрывом связи С-О.
— внутримолекулярная дегидратация с образованием алкенов (происходит при сильном нагревании спиртов с водоотнимающими веществами (концентрированная серная кислота)):
CH3-CH2-CH2-OH → CH3-CH = CH2 + H2O
— межмолекулярная дегидратация спиртов с образованием простых эфиров (происходит при слабом нагревании спиртов с водоотнимающими веществами
(концентрированная серная кислота)):
2C2H5OH → C2H5-O-C2H5 + H2O
— слабые основные свойства спиртов проявляются в обратимых реакциях с галогеноводородами:
C2H5OH + HBr →C2H5Br + H2O
Физические свойства спиртов
Низшие спирты (до С15) – жидкости, высшие – твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в оде падает. Спирты имеют высокие температуры кипения и плавления за счет образования водородных связей.
Получение спиртов
Получение спиртов возможно с помощью биотехнологического (брожение) способа из древесины или сахара.
К лабораторным способам получения спиртов относятся:
— гидратация алкенов (реакция протекает при нагревании и в присутствии концентрированной серной кислоты)
СН2 = СН2 + Н2О → СН3ОН
— гидролиз алкилгалогенидов под действием водных растворов щелочей
СН3Br + NaOH → CH3OH + NaBr
СН3Br + Н2О → CH3OH + HBr
— восстановление карбонильных соединений
CH3-CH-O + 2[H] → CH3– CH2-OH
Примеры решения задач
Источник
В зависимости от типа углеводородного радикала, а также в некоторых случаях особенностей прикрепления группы -ОН к этому углеводородному радикалу соединения с гидроксильной функциональной группой разделяют на спирты и фенолы.
Спиртами называют соединения, в которых гидроксильная группа соединена с углеводородным радикалом, но не присоединена непосредственно к ароматическому ядру, если таковой имеется в структуре радикала.
Примеры спиртов:
Если в структуре углеводородного радикала содержится ароматическое ядро и гидроксильная группа, при том соединена непосредственно с ароматическим ядром, такие соединения называют фенолами.
Примеры фенолов:
Почему же фенолы выделяют в отдельный от спиртов класс? Ведь, например, формулы

очень похожи и создают впечатление веществ одного класса органических соединений.
Однако непосредственное соединение гидроксильной группы с ароматическим ядром существенно влияет на свойства соединения, поскольку сопряженная система π-связей ароматического ядра сопряжена также и с одной из неподеленных электронных пар атома кислорода. Из-за этого в фенолах связь О-Н более полярна по сравнению со спиртами, что существенно повышает подвижность атома водорода в гидроксильной группе. Другими словами, у фенолов значительно ярче, чем у спиртов выражены кислотные свойства.
Химические свойства спиртов
Одноатомные спирты
Реакции замещения
Замещение атома водорода в гидроксильной группе
1) Спирты реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от защитной пленки Al2O3), при этом образуются алкоголяты металлов и выделяется водород:
Образование алкоголятов возможно только при использовании спиртов, не содержащих растворенной в них воды, так как в присутствии воды алкоголяты легко гидролизуются:
CH3OK + Н2О = СН3ОН + KOH
2) Реакция этерификации
Реакцией этерификации называют взаимодействие спиртов с органическими и кислородсодержащими неорганическими кислотами, приводящее к образованию сложных эфиров.
Такого типа реакции являются обратимыми, поэтому для смещения равновесия в сторону образования сложного эфира, реакцию желательно проводить при нагревании, а также в присутствии концентрированной серной кислоты как водоотнимающего агента:
Замещение гидроксильной группы
1) При действии на спирты галогеноводородных кислот происходит замещение гидроксильной группы на атом галогена. В результате такой реакции образуются галогеналканы и вода:
2) При пропускании смеси паров спирта с аммиаком через нагретые оксиды некоторых металлов (чаще всего Al2O3) могут быть получены первичные, вторичные или третичные амины:
Тип амина (первичный, вторичный, третичный) будет в некоторой степени зависеть от соотношения исходного спирта и аммиака.
Реакции элиминирования (отщепления)
Дегидратация
Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Реакции окисления
Горение
Спирты легко вступают в реакцию горения. При этом образуется большое количество тепла:
2СН3-ОН + 3O2 = 2CO2 + 4H2O + Q
Неполное окисление
Неполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот.
В случае неполного окисления вторичных спиртов возможно образование только кетонов.
Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д.
При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов.
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Замещение атомов водорода гидроксильных групп
Многоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al2O3); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта:
2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп.
Большая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения.
Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно.
3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Данная реакция катализируется сильными неорганическими кислотами и является обратимой. В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами.
В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта.
Замещение гидроксильных групп
Реакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами.
Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена:
Химические свойства фенолов
Как уже было сказано в самом начале данной главы, химические свойства фенолов заметно отличаются от химических свойств спиртов. Связано это с тем, что одна из неподеленных электронных пар атома кислорода в гидроксильной группе сопряжена с π-системой сопряженных связей ароматического кольца.
Реакции с участием гидроксильной группы
Кислотные свойства
Фенолы являются более сильными кислотами, чем спирты, и в водном растворе в очень небольшой степени диссоциированы:
Большая кислотность фенолов по сравнению со спиртами в плане химических свойств выражается в том, что фенолы, в отличие от спиртов, способны реагировать со щелочами:
Однако, кислотные свойства фенола выражены слабее, чем даже у одной из самых слабых неорганических кислот – угольной. Так, в частности, углекислый газ, при пропускании его через водный раствор фенолятов щелочных металлов, вытесняет из последних свободный фенол как еще более слабую, чем угольная, кислоту:
Очевидно, что любой другой более сильной кислотой фенол также будет вытесняться из фенолятов:
3) Фенолы являются более сильными кислотами, чем спирты, а спирты при этом реагируют с щелочными и щелочноземельными металлами. В связи с этим очевидно, что и фенолы будут реагировать с указанными металлами. Единственное, что в отличие от спиртов, реакция фенолов с активными металлами требует нагревания, так как и фенолы, и металлы являются твердыми веществами:
Реакции замещения в ароматическом ядре
Гидроксильная группа является заместителем первого рода, и это значит, что она облегчает протекание реакций замещения в орто- и пара-положениях по отношению к себе. Реакции с фенолом протекают в намного более мягких условиях по сравнению с бензолом.
Галогенирование
Реакция с бромом не требует каких-либо особых условий. При смешении бромной воды с раствором фенола мгновенно образуется белый осадок 2,4,6-трибромфенола:
Нитрование
При действии на фенол смеси концентрированных азотной и серной кислот (нитрующей смеси) образуется 2,4,6-тринитрофенол – кристаллическое взрывчатое вещество желтого цвета:
Реакции присоединения
Поскольку фенолы являются ненасыщенными соединениями, возможно их гидрирование в присутствии катализаторов до соответствующих спиртов:
Источник
