Какие химические свойства можно предположить у вещества

Все химические элементы разделяют на металлы и неметаллы в зависимости от строения и свойств их атомов. Также на
металлы и неметаллы классифицируют образуемые элементами простые вещества, исходя из их физических и химических свойств.
В Периодической системе химических элементов Д.И. Менделеева неметаллы расположены по диагонали: бор – астат и над ней в главных подгруппах.
Для атомов металлов характерны сравнительно большие радиусы и небольшое число электронов на внешнем уровне от 1 до 3 (исключение: германий, олово свинец – 4;
сурьма и висмут – 5; полоний – 6 электронов).
Атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем уровне от 4 до 8 (исключение бор, у него таких электронов –
три).
Отсюда стремление атомов металлов к отдаче внешних электронов, т.е. восстановительные свойства, а для атомов неметаллов – стремление к приему недостающих до
устойчивого восьмиэлектронного уровня электронов, т.е. окислительные свойства.
В металлах – металлическая связь и металлическая кристаллическая решетка. В узлах решетки находятся положительно заряженные ионы металлов, связанные
посредством обобществленных внешних электронов, принадлежащих всему кристаллу.
Это обуславливает все важнейшие физические свойства металлов: металлический блеск, электро- и теплопроводность, пластичность (способность изменять форму под
внешним воздействием) и некоторые другие, характерные для этого класса простых веществ.
Металлы I группы главной подгруппы называют щелочными металлами.
Металлы II группы: кальций, стронций, барий – щелочноземельными.
В химических реакциях металлы проявляют только восстановительные свойства, т.е. их атомы отдают электроны, образуя в результате положительные
ионы.
1. Взаимодействуют с неметаллами:
а) кислородом (с образованием оксидов)
Щелочные и щелочноземельные металлы окисляются легко при обычных условиях, поэтому их хранят под слоем вазелинового масла или керосина.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO
Обратите внимание: при взаимодействии натрия – образуется пероксид, калия – надпероксид
2Na + O2 = Na2O2, К + О2 = КО2
а оксиды получают прокаливанием пероксида с соответствующими металлом:
2Na + Na2O2 = 2Na2O
Железо, цинк, медь и другие менее активные металлы медленно окисляются на воздухе и активно при нагревании.
3Fe + 2O2 = Fe3O4 (смесь двух оксидов: FeO и Fe2O3)
2Zn + O2 = 2ZnO
2Cu + O2 = 2CuO
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
б) водородом (с образованием гидридов)
2Na + H2 = 2NaH
Ca + H2 = CaH2
в) хлором (с образованием хлоридов)
2K + Cl2 = 2KCl
Mg + Cl2 = MgCl2
2Al + 3Cl2 =2AlCl3
Обратите внимание: при взаимодействии железа образуется хлорид железа (III):
2Fe + 3Cl2 = 2FeCl3
г) серой (с образованием сульфидов)
2Na + S = Na2S
Hg + S = HgS
2Al + 3S = Al2S3
Обратите внимание: при взаимодействии железа образуется сульфид железа (II):
Fe + S = FeS
д) азотом (с образованием нитридов)
6K + N2 = 2K3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2. Взаимодействуют со сложными веществами:
Необходимо помнить, что по восстановительной способности металлы расположены в ряд, который называют электрохимическим рядом напряжений или активности
металлов (вытеснительный ряд Бекетова Н.Н.):
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au, Pt
а) водой
Металлы, расположенные в ряду до магния, при обычных условиях вытесняют водород из воды, образуя растворимые основания – щелочи.
2Na + 2H2O = 2NaOH + H2↑
Ba + H2O = Ba(OH) 2 + H2↑
Магний взаимодействует с водой при кипячении.
Mg + 2H2O = Mg(OH) 2 + H2↑
Алюминий при удалении оксидной пленки бурно реагирует с водой.
2Al + 6H2O = 2Al(OH) 3 + 3H2↑
Остальные металлы, стоящие в ряду до водорода, при определенных условиях тоже могут вступать в реакцию с водой с выделением водорода и образованием
оксидов.
3Fe + 4H2O = Fe3O4 + 4H2↑
б) растворами кислот
(Кроме концентрированной серной кислоты и азотной кислоты любой концентрации. См. раздел «Окислительно-восстановительные реакции».)
Обратите внимание: не используют для проведения реакций нерастворимую кремниевую кислоту
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Металлы, стоящие в ряду от магния до водорода, вытесняют водород из кислот.
Mg + 2HCl = MgCl2 + H2↑
Обратите внимание: образуются соли двухвалентного железа.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Образование нерастворимой соли препятствует протеканию реакции. Например, свинец практически не реагирует с раствором серной кислоты из-за образования на
поверхности нерастворимого сульфата свинца.
Металлы, стоящие в ряду после водорода, НЕ вытесняют водород.
в) растворами солей
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Для остальных металлов выполняется правило:
Каждый металл вытесняет из растворов солей другие металлы, расположенные в ряду правее него, и сам может быть вытеснен металлами, расположенными левее
него.
Cu + HgCl2 = Hg + CuCl2
Fe + CuSO4 = FeSO4 + Cu
Как и в случае с растворами кислот, образование нерастворимой соли препятствует протеканию реакции.
г) растворами щелочей
Взаимодействуют металлы, гидроксиды которых амфотерны.
Zn + 2NaOH + 2H2O = Na2 [Zn(OH) 4] + H2↑
2Al + 2KOH + 6H2O = 2K[Al(OH) 4] + 3H2↑
д) с органическими веществами
Щелочные металлы со спиртами и фенолом.
2C2H5OH + 2Na = 2C2H5ONa + H2↑
2C6H5OH + 2Na = 2C6H5ONa + H2↑
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение
углеродного скелета молекулы (реакция А.Вюрца):
CH2Cl-CH2-CH2Cl + Zn = C3H6(циклопропан) + ZnCl2
2CH2Cl + 2Na = C2H6(этан) + 2NaCl
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. При этом образуются одинарные (в молекулах H2, F2,
Cl2, Br2, I2), двойные (в молекулах О2), тройные (в молекулах N2) ковалентные связи.
1. молекулярное
При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, O3, F2,
Cl2) или твердые вещества (I2, P4, S8) и лишь единственный бром (Br2) является жидкостью. Все эти вещества молекулярного строения, поэтому
летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. атомное
Эти вещества образованы кристаллами, в узлах которых находятся атомы: (Bn, Сn, Sin, Gen, Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением
ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма
мала.
Многие элементы – неметаллы образуют несколько простых веществ – аллотропных модификаций. Аллотропия может быть связана с разным составом молекул: кислород
О2 и озон О3 и с разным строением кристаллов: аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен. Элементы – неметаллы, имеющие аллотропные
модификации: углерод, кремний, фосфор, мышьяк, кислород, сера, селен, теллур.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение
электроотрицательности. В ряду неметаллов
At, B, Te, H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F
электроотрицательность возрастает и усиливаются окислительные свойства.
Отсюда следует, что для простых веществ – неметаллов будут характерны как окислительные, так и восстановительные свойства, за исключением фтора – самого
сильного окислителя.
1. Окислительные свойства
а) в реакциях с металлами (металлы всегда восстановители)
2Na + S = Na2S (сульфид натрия)
3Mg + N2 = Mg3N2 (нитрид магния)
б) в реакциях с неметаллами, расположенными левее данного, то есть с меньшим значением электроотрицательности. Например, при взаимодействии фосфора и серы
окислителем будет сера, так как фосфор имеет меньшее значение электроотрицательности:
2P + 5S = P2S5 (сульфид фосфора V)
Большинство неметаллов будут окислителями в реакциях с водородом:
H2 + S = H2S
H2 + Cl2 = 2HCl
3H2 + N2 = 2NH3
в) в реакциях с некоторыми сложными веществами
Окислитель – кислород, реакции горения
CH4 + 2O2 = CO2 + 2H2O
2SO2 + O2 = 2SO3
Окислитель – хлор
2FeCl2 + Cl2 = 2FeCl3
2KI + Cl2 = 2KCl + I2
CH4 + Cl2 = CH3Cl + HCl
Ch2=CH2 + Br2 = CH2Br-CH2Br
2. Восстановительные свойства
а) в реакциях с фтором
S + 3F2 = SF6
H2 + F2 = 2HF
Si + 2F2 = SiF4
б) в реакциях с кислородом (кроме фтора)
S + O2 = SO2
N2 + O2 = 2NO
4P + 5O2 = 2P2O5
C + O2 = CO2
в) в реакциях со сложными веществами – окислителями
H2 + CuO = Cu + H2O
6P + 5KClO3 = 5KCl + 3P2O5
C + 4HNO3 = CO2 + 4NO2 + 2H2O
H2C=O + H2 = CH3OH
3. Реакции диспропорционирования: один и тот же неметалл является и окислителем и восстановителем
Cl2 + H2O = HCl + HClO
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Источник
- Главная
- Вопросы & Ответы
- Вопрос 2749507
Таня Масян
более месяца назад
Просмотров : 74
Ответов : 1
Лучший ответ:
Энджелл
Гидрирование (реакция с H₂)
галогенирование (например, с Cl₂)
разложение
с активными металлами
с солями
с щелочами
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Зачетный Опарыш
Замени произведения квадратом числа, найди значение выражений. 4 умножить на 4= ? ПОМОГИТЕ ЕСЛИ НЕ СЛОЖНО
более месяца назад
Смотреть ответ
Просмотров : 10
Ответов : 1
Суррикат Мими
Выполни деление с остатком.52:7= 36:11=78:9= 27:4= 27:10= 156:10=64:10= 384:100=
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
Васян Коваль
Скажите сколько килограммов в 65 центнерах 60 килограммов???(ответе плиз)))
более месяца назад
Смотреть ответ
Просмотров : 11
Ответов : 1
Онтонио Веселко
В каких предложениях следует поставить запятую?1. Наступило утро и солнце тало медленно подниматься над горизонтом 2. Молодые и активные ребята помогают пенсионерам 3. Звонкие ручьи и молодые листочки возвещают о наступлении весны4. И строгие члены жюри и болельщики в зале были единодушны в оценки…
более месяца назад
Смотреть ответ
Просмотров : 34
Ответов : 1
Мари Умняшка
Выразите сожаление, что вам не удается это сделать.1 Will you come to see us?Sorry,I’m not sure I’ll be able to como to see you.2 Will you do this work?3Will you celebrate Christmas with your parents?4Will you make a cake yourself?
более месяца назад
Смотреть ответ
Просмотров : 4
Ответов : 1
Источник
Глава 8. Альдегиды и кетоны
От чего зависят химические свойства веществ?
В каких условиях проявляются химические свойства вещества?
Какие химические свойства можно предположить у альдегидов?
Приведите примеры реакций полимеризации и поликонденсации углеводородов, запишите уравнения их реакций (или схемы) и дайте им определение.
Химические свойства альдегидов, как и других соединений, обусловлены их строением и, прежде всего, их наиболее реакционноспособными химическими связями. Таковыми являются химические связи атомов функциональной группы. Химические свойства альдегиды могут проявлять и за счет углеводородного радикала, который испытывает определенное влияние функциональной группы. Химические свойства проявляются в химических реакциях.
Поскольку важнейшей химической закономерностью является зависимость химических свойств соединения от его строения, еще раз обратимся к особенностям химического и электронного строения молекул альдегидов.
Наиболее реакционноспособными в альдегидах являются связь между атомом углерода и водорода С—Н и π-связь в альдегидной группе
Проблема. Опираясь на свои знания о строении альдегидов, предскажите возможные для них типы химических реакций.
Альдегиды вступают в реакции разного типа. Но прежде всего это реакции, обусловленные наличием альдегидной группы. Вместе с тем альдегидная группа влияет на углеводородный радикал, делая некоторые его атомы водорода более подвижными. Рассмотрим наиболее типичные реакции альдегидов.
1. Реакции окисления альдегидов
Для альдегидов характерны реакции окисления, причем альдегиы окисляются легче, чем спирты. Реакции осуществляются по месту связи С—Н альдегидной группы. Схема реакции окисления:
В качестве окислителей можно использовать K2Cr2C7 в кислой среде, оксиды и гидроксиды меди, серебра. Окислять альдегиды могут даже слабые окислители — оксиды и гидроксиды тяжелых металлов.
Лабораторный опыты
1. Окисление формальдегида аммиачным раствором оксида серебра (см. ссылку на с. 112). В чистую пробирку (держите ее вертикально!) внесите 5 капель раствора формальдегида. Прибавьте к ним 5 капель аммиачного раствора оксида серебра и слегка нагрейте на спиртовке (соблюдая правила нагревания жидкостей). Что наблюдаете? Образуется блестящее «зеркало». Как только оно получилось, нагревание прекратите. Содержимое пробирки слейте в специальную емкость, пробирки с «зеркалом» положите в специальном месте, указанном учителем (остатки серебра пойдут на переработку). Реакция «серебряного зеркала» является характерной, или качественной, реакцией на альдегиды.
Запишем уравнение реакции:
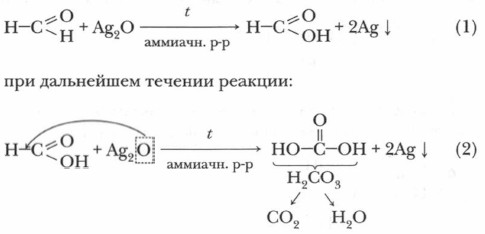
Реакция «серебряного зеркала» требует соблюдения особых условий: чистые, хорошо вымытые пробирки и выдержанная концентрация необходимых растворов. В этом случае на стенках пробирки ровно оседает серебро, образуя зеркальный налет.
В этой реакции формальдегид окисляется в угольную кислоту, а оксид серебра (I) восстанавливается до чистого металла — серебра.
2. Реакция ацетальдегида с гидроксидом меди(II). В чистую пробирку прилейте к сульфату меди (II) около 1 мл раствора гидроксида натрия (щелочь должна быть в избытке). Наблюдайте, что образовалось и какого цвета. Образовался нерастворимый осадок гидроксида меди (II) голубого цвета. К нему прибавьте 0,5 мл раствора ацетальдегида, пробирку взбалтывайте до образования светло-синего раствора. Смесь слабо нагрейте. Как изменяется окраска раствора? Вначале можно заметить образование желтого осадка гидроксида меди(I) СuОН, который затем превращается в красный осадок. Это Сu2O.
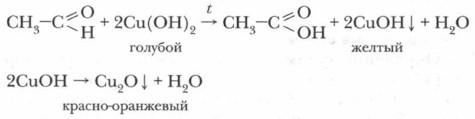
Эта реакция используется в медицинских биохимических лабораториях для обнаружения альдегидов при анализах на сахар в крови и моче.
Продолжение >>>
Источник
