Какие химические свойства у воды
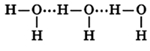
СОДЕРЖАНИЕ:
- Строение молекулы воды
- Какие связи имеет H2O?
- Физические свойства H2O
- Химические свойства H2O
- Круговорот воды в природе
- Почему не кончается вода на Земле?
- Виды воды
СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ
Молекула представляет собой совокупность атомных ядер и электронов , что является достаточно устойчивым , чтобы обладать наблюдаемыми свойствами — и есть несколько молекул , которые являются более стабильными и трудно разлагаются , чем H 2 O.
В воде, каждое ядро водорода связаны с центральным атомом кислорода парой электронов, которые делятся между ними. Химики называют эту общую электронную пару ковалентной химической связью. В H 2О, только два из шести электронов кислорода внешней оболочки используются для этой цели, оставляя четыре электрона, которые организованы в две несвязывающие пары.
Четыре электронные пары, окружающие кислород, имеют тенденцию располагаться как можно дальше друг от друга, чтобы минимизировать отталкивания между этими облаками отрицательного заряда. Это обычно приводит к тетраэдрической геометрии, в которой угол между электронными парами (и, следовательно, угол связи HOH ) составляет 109,5 °.
Однако, поскольку две несвязывающие пары остаются ближе к атому кислорода, они оказывают более сильное отталкивание на две пары ковалентных связей, эффективно сближая два атома водорода. Результатом является искаженное тетраэдрическое расположение, в котором угол Н-О-Н составляет 104,5 °.
Хотя молекула воды не несет чистого электрического заряда, ее восемь электронов распределены неравномерно. Немного более отрицательный заряд (фиолетовый) на кислородном конце молекулы и компенсирующий положительный заряд (зеленый) на водородном конце. Получающаяся полярность в значительной степени ответственна за уникальные свойства воды.
Поскольку молекулы меньше световых волн, их нельзя наблюдать непосредственно, и их необходимо «визуализировать» альтернативными способами. Внешняя оболочка показывает эффективную «поверхность» молекулы, определяемую протяженностью облака отрицательного электрического заряда, созданного восемью электронами.
КАКИЕ СВЯЗИ ИМЕЕТ H2O2
Молекула H 2 O электрически нейтральна, но положительные и отрицательные заряды распределены неравномерно. Это иллюстрируется градацией цвета на схематической диаграмме здесь. Электронный (отрицательный) заряд концентрируется на кислородном конце молекулы, отчасти благодаря несвязывающимся электронам (сплошные синие кружки) и высокому заряду ядра кислорода, который оказывает сильное притяжение на электроны.
Это смещение заряда представляет собой электрический диполь , представленный стрелкой внизу; Вы можете думать об этом диполе как о электрическом «образе» молекулы воды.
Как все мы узнали в школе, противоположные заряды притягиваются, поэтому частично положительный атом водорода на одной молекуле воды электростатически притягивается к частично отрицательному кислороду на соседней молекуле. Этот процесс называется (несколько обманчиво) водородной связью.
Обратите внимание, что водородная связь длиннее, чем ковалентная связь О-Н. Это означает, что он значительно слабее. На самом деле он настолько слаб, что данная водородная связь не может существовать дольше, чем крошечная доля секунды.
ФИЗИЧЕСКИЕ СВОЙСТВА H2O2
Давно известно, что вода обладает многими физическими свойствами, которые отличают ее от других небольших молекул сопоставимой массы. Химики называют их «аномальными» свойствами воды, но они ни в коем случае не являются загадочными. Все они являются полностью предсказуемыми последствиями того, как размер и заряд ядра атома кислорода способствуют искажению облаков электронного заряда атомов других элементов, когда они химически связаны с кислородом. Вода является одним из немногих известных веществ, чья твердая форма менее плотная, чем жидкость.
Расширение между –4 ° и 0 ° обусловлено образованием более крупных агрегатов с водородными связями. Выше 4 ° начинается тепловое расширение, поскольку колебания связей О — Н становятся более энергичными, что приводит к выталкиванию молекул дальше друг от друга.
Другое широко цитируемое аномальное свойство воды — ее высокая температура кипения. Как показывает этот график, молекула, столь же легкая, как H 2 O, «должна» кипеть при температуре около –90 ° C. То есть, он существовал бы в мире в виде газа, а не жидкости, если бы не было водородных связей. Обратите внимание, что Н-связь также наблюдается с фтором и азотом.
ХИМИЧЕСКИЕ СВОЙСТВА H2O2
Соленость воды может быть определена как концентрация всех катионов, в значительной степени Na + , K + , Mg ++ и Ca ++, а также анионов CO 3 = и SO 4 = и галогенидов, причем все HCO 3 — превращаются в CO = 3. Приведенный выше средний состав пресной воды соответствует среднему речному водоснабжению. В мягких водах Ca ++ и CO = 3 могут быть значительно снижены. В кислых водах сульфат может быть доминирующим.
КРУГОВОРОТ ВОДЫ В ПРИРОДЕ
Что происходит в естественном круговороте воды?
В естественном круговороте воды используются физические процессы для перемещения воды с поверхности земли в атмосферу и обратно.
Испарение — это когда солнце светит на воду и нагревает ее, превращая в газ, называемый водяным паром, который поднимается в воздух.
Транспирация — это когда солнце согревает людей, растения и животных, и они выпускают водяной пар в воздух.
Конденсация — это когда водяной пар в воздухе охлаждается и превращается в жидкость, образуя крошечные капельки воды в небе.
Осадки — это когда капли воды падают с неба в виде дождя, снега или града.
Сток — это когда вода течет по земле и впадает в ручьи, реки и океаны.
Инфильтрация — это когда вода падает на землю и впитывается в почву.
Перколяция — это когда вода все глубже проникает в крошечные места в почве и камне.
ПОЧЕМУ НЕ КОНЧАЕТСЯ ВОДА НА ЗЕМЛЕ
Земля содержит огромное количество воды:
- в океанах;
- озерах;
- реках;
- атмосфере;
- в скалах внутренней Земли.
В течение миллионов лет большая часть этой воды рециркулируется между внутренней Землей, океанами и реками и атмосферой. Этот циклический процесс означает, что пресная вода постоянно поступает на поверхность Земли, где мы все живем.
Вулканы выпускают огромное количество воды из внутренней Земли в атмосферу.
Наша планета также очень эффективно удерживает эту воду. Вода, будучи паром в нашей атмосфере, потенциально может сбежать в космос с Земли. Но вода не вытекает, потому что некоторые области атмосферы очень холодные. (Например, на высоте 15 километров температура атмосферы составляет всего -60 ° С!). При этой холодной температуре вода образует твердые кристаллы, которые падают обратно на поверхность Земли.
Хотя на нашей планете в целом никогда не кончится вода, важно помнить, что чистая пресная вода не всегда доступна там, где и когда она нужна людям. Фактически, половина пресной воды в мире может быть найдена только в шести странах. Более миллиарда человек живут без достаточного количества чистой воды.
Кроме того, каждая капля воды, которую мы используем, продолжается в круговороте воды. Вещи, которые мы кладем в канализацию, попадают в чью-то воду. Мы можем помочь защитить качество пресной воды на нашей планете, используя ее более разумно.
ВИДЫ ВОДЫ
«Чистая вода»
Для химика термин «чистый» имеет значение только в контексте конкретного применения или процесса. Дистиллированная или деионизированная вода, которую мы используем в лаборатории, содержит растворенные атмосферные газы и иногда немного кремнезема, но их небольшое количество и относительная инертность делают эти примеси незначительными для большинства целей.
Когда для определенных типов точных измерений требуется вода с наивысшей достижимой чистотой, ее обычно фильтруют, деионизируют и подвергают тройной вакуумной дистилляции. Но даже эта «химически чистая» вода представляет собой смесь изотопных частиц: есть два стабильных изотопа водорода (H 1 и H 2 , последний часто обозначается как D) и кислорода (O 16 и O 18 ), которые вызывают комбинации, такие как H 2O 18 , HDO 16 и т. Д. Они легко идентифицируются в инфракрасных спектрах водяного пара.
И вдобавок ко всему, два атома водорода в воде содержат протоны, магнитные моменты которых могут быть параллельными или антипараллельными, что приводит к орто- и пара- воде соответственно. Две формы обычно присутствуют в соотношении о / п 3: 1.
Количество редких изотопов кислорода и водорода в воде достаточно разнится от места к месту, поэтому теперь можно с некоторой точностью определить возраст и источник конкретного образца воды. Эти различия отражены в изотопных профилях H и O организмов. Таким образом, изотопный анализ волос человека может быть полезным инструментом для расследования преступлений и антропологических исследований.
Питьевая вода
Наша обычная питьевая вода, напротив, никогда не бывает химически чистой, особенно если она контактировала с отложениями. Подземные воды (из родников или колодцев) всегда содержат ионы кальция и магния, а также часто железо и марганец; положительные заряды этих ионов уравновешиваются отрицательными ионами карбонат / бикарбонат, а иногда и некоторым количеством хлорида и сульфата. В некоторых регионах подземные воды содержат недопустимо высокие концентрации естественных токсичных элементов, таких как селен и мышьяк.
Можно подумать, что дождь или снег будут освобождены от загрязнения, но когда водяной пар конденсируется из атмосферы, это всегда происходит на частице пыли, которая выделяет вещества в воду, и даже самый чистый воздух содержит углекислый газ, который растворяется с образованием углекислота За исключением сильно загрязненных атмосфер, примеси, улавливаемые снегом и дождем, слишком малы, чтобы вызывать беспокойство.
Различные правительства установили верхние пределы количества загрязняющих веществ, допустимых в питьевой воде; самые известные из них — Стандарты питьевой воды EPA США.
Безионная вода
Иногда можно услышать, что не содержащая минералов вода и особенно дистиллированная вода вредны для здоровья, потому что они «вымывают» необходимые минералы из организма. Дело в том, что минеральные ионы не проходят через клеточные стенки при обычной осмотической диффузии, а скорее переносятся метаболическими процессами.
Обширное исследование 2008 года не подтвердило более ранние сообщения о том, что низкий уровень кальция / магния в питьевой воде коррелирует с сердечно-сосудистыми заболеваниями. Любая сбалансированная диета должна содержать все необходимые нам минеральные вещества.
Хорошо известно, что люди, которые занимаются тяжелой физической активностью или находятся в очень жаркой среде, должны избегать употребления большого количества даже обычной воды. Чтобы предотвратить серьезные проблемы с электролитным дисбалансом, необходимо компенсировать потери солей при потливости. Это может быть достигнуто путем приема соленых продуктов или напитков (включая «спортивные напитки») или соленых таблеток.
Статью проверил и отредактировал Papa Vlada.
Первоисточник статьи опубликован на сайте про воду.
Источник
Оксид водорода (H2O), гораздо более известный всем нам под названием “вода”, без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом – в виде льда, в жикдом, собственно вода, в газообразном – в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. – это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см3;
- вода – хороший растворитель.
Строение молекулы воды
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода – положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры – чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии – образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода “охотно” вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
2Na+2H2O = 2NaOH+H2↑
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
3Fe+4H2O=FeO → Fe2O3+4H2↑
C+2H2O → CO2+2H2↑ - с основными оксидами при н.у. вода реагирует с образованием оснований:
CaO+H2O = Ca(OH)2
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
CO2+H2O = H2CO3
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества – в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества – в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества – в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды – такой “слоеный пирог” называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
CuSO4+5H2O = CuSO4·5H2O
См. далее:
- Жесткость воды
- Пероксид водорода (H2O2)
Источник

ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
ЗАПОМНИТЕ!!!
Щелочные металлы – это I группа, А – главная подгруппа – Li, Na, K, Rb, Cs, Fr
Щелочно-земельные металлы – это II группа, А – главная подгруппа (Be, Mg не относятся) – Ca, Sr, Ba, Ra
n I
Основания – это сложные вещества с общей формулой Ме(ОН)n
ОН – гидроксильная группа, с валентностью (I)
Щёлочи – это растворимые в воде основания (см. ТАБЛИЦУ РАСТВОРИМОСТИ)
I n
Кислоты – это сложные вещества с общей формулой Нn (КО)
(КО) – кислотный остаток
V-VII
Кислотный оксид – неМех Оу и Мех Оу
I, II
Основные оксиды – Мех Оу
I. Взаимодействие воды с металлами.
В зависимости от активности металла, реакция протекает при различных условиях и образуются разные продукты.
1). Взаимодействие с самыми активными металлами, стоящими в периодической системе в I А и I I А группах (щелочные и щелочно-земельные металлы) и алюминий. В ряду активности эти металлы расположены до алюминия (включительно)
Реакция протекает при обычных условиях, при этом образуется щелочь и водород.
I I
2Li + 2 H2O = 2 Li OH + H2 (протекает реакция замещения)
HOH гидроксид
лития
I I I
Ba + 2 H2O = Ba (OH)2 + H2
2 Al + 6 H2O = 2 Al (OH)3 + 3 H2
гидроксид
алюминия
ОН – гидроксогруппа, она всегда одновалентна
ВЫВОД – активные металлы – Li, Na, K, Rb, Cs, Fr, Ca, Sr, Ba, Ra + Al – реагируют так
Me + H2O = Me(OH)n + H2 (р. замещения)
основание
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Реакция протекает только с парообразной водой, т.е. при нагревании.
При этом образуются: оксид этого металла и водород.
I I I I
Fe + H2O = FeO + H2 (протекает реакция замещения)
оксид
железа
Ni + H2O = NiO + H2
(Валентность металла можно легко определить по ряду активности металлов, над их символом стоит значение, например +2, это означает, что валентность этого металла равна 2).
ВЫВОД – металлы средней активности, стоящие в ряду активности до (Н2) – Be, Mg, Fe, Pb, Cr, Ni, Mn, Zn – реагируют так
Me + Н2О = Мех Оу + Н2 (р. замещения)
Оксид
металла
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H2O = нет реакции
I I. Взаимодействие с оксидами (основными и кислотными)
С водой взаимодействуют только такие оксиды, которые при взаимодействии с водой дают растворимый в воде продукт (кислоту или щелочь).
1). Взаимодействие с основными оксидами.
С водой взаимодействуют только основные оксиды активных металлов, которые расположены в в I А и I I А группах, кроме Ве и Mg (оксид алюминия не реагирует, т.к. он амфотерный). Реакция протекает при обычных условиях, при этом образуется только щелочь.
I I I
Na2O + H2O = 2 NaOH BaO + H2O = Ba (OH)2 (протекает реакция соединения)
I
H2O + ОСНОВНЫЙ ОКСИД = Ме(ОН)m (р. соединения)
Щёлочь
Al2O3 + H2O = нет реакции
BeO + H2O = нет реакции
MgO + H2O = нет реакции
2) Взаимодействие кислотных оксидов с водой.
Кислотные оксиды реагируют с водой все. Исключение составляет только SiO2.
При этом образуются кислоты. Во всех кислотах на первом месте расположен водород, поэтому уравнение реакции записывают так:
SO3 + H2O = H2SO4 P2O5 + H2O = 2 HPO3
SO3 холодная
+ H2 O P2O5
H2SO4 + H2 O
H2P2O6
P2O5 + 3 H2O = 2 H3 PO4
Горячая
P2O5
+ H6 O3
H6 P2O8
Обратите внимание, что в зависимости от температуры воды при взаимодействии с Р2 О5 образуются разные продукты.
H2O + КИСЛОТНЫЙ ОКСИД = Hn A (р. соединения)
Кислота
Внимание! SiO2 + H2O = нет реакции
IV Взаимодействие воды c неметаллами
Примеры: Cl2 + H2O = HCl + HClO
t
C + H2O = CO + H2
уголь угарный газ
t
Si + 2H2O = SiO2 + 2H2 .
Источник
