Какие химические свойства воды бывают
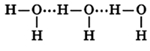
Nurjan Isaeva
11 мая · 1,7 K
Автор вопроса считает этот ответ лучшим
На сайте https://tvoiklas.ru/ представлены уроки географии, биологии и истории на… · tvoiklas.ru
- Химические:
а) реагирует со многими металлами с выделением кислорода;
б) разлагается на кислород и водород при действии электрического тока;
в) реагирует со многими оксидами неметаллов;
г) реагирует с некоторыми оксидами металлов.
- Физические:
а) высокая теплопроводность (теплоёмкость) и низкая теплоотдача;
б) несжимаемость;
в) способность к поверхностному натяжению;
г) жидкость без цвета, вкуса и запаха;
д) сцепление – водородные связи удерживают молекулы воды вместе;
е) высокая удельная температура парообразования и конденсации;
ж) способность растворять многие вещества;
з) гидроксид водорода может находиться в трёх состояниях: в жидком – вода, парообразном – водяной пар и твёрдом – лёд. При этом лёд имеет более низкую плотность;
и) при замерзании расширяется и т.д.
- Биологические
а) сохраняет объём и тургор клеток и тканей;
б) обеспечивает
охлаждение благодаря испарению с поверхности тела,
- доставку питательных веществ и кислорода ко всем клеткам тела,
- буферизацию (поддержание кислотности) внутренней среды,
- регуляцию температуры тела,
- преобразование пищи в энергию,
- усвоение питательных веществ клетками,
- вывод шлаков и отходов, появившиеся в процессе жизнедеятельности и целый ряд других функций.
Биологически вода это жизнь!!! Без воды и не туды и не сюды)) у воды много не обьяснимых функций, как она достигает самых верхних листьев дерева ведь у деревьев нет насосов))
Физические свойства воды: лед, вода, пар, ещё есть 4-ое но я не знаю вода бывает в виде плазмы, может это молния, при раскатах молнии вода делится на водород, и озон,
Химические свойства воды: растворяет практически любой состав, даже вода налитая в стакан, растворяет стекло но очень медленно, при взаимодействии с металлами вступает в реакцию и вызывает ВОДОРОД,
Какое направление наиболее перспективно: биотехнологии или химические технологии?
Что-то шарю в химии. Вегетарианец днём. Веган ночью.
Я закончил и получил степень бакалавра на химической технологии, поэтому могу сказать точно, что химия не умерла. Самое популярное сейчас направление, связанное с химией – это «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии». И популярность данного направления не за счет слова «нефтехимия» в названии. Ты как бы откусываешь кусок от всего. Но на биохимию действительно идет меньше людей, чем на химическую технологию, как следствие конкуренция там выше. И есть простое объяснение. Химическая технология охватывает не только органическую, но и неорганическую химию. А биохимия связана только с органикой от начала и до конца. Поэтому в первую очередь нужно решить, какую химию ты любишь больше.
Прочитать ещё 1 ответ
Каким свойством обладает чистая вода?
Вода является прозрачной, безвкусной жидкостью, которая не имеет никакого запаха, но при этом основные её характеристики поистине поразительны:
показатель молекулярной массы равен 18,0160;
уровень плотности — 1 г/см³;
вода является уникальным растворителем: она окисляет практически все известные виды металла и способна разрушить любую твёрдую горную породу;
сферическая капля воды отличается наименьшей (оптимальной) поверхностью объёма;
коэффициент поверхностного натяжения равен 72,75*10‾³Н/м;
вода превосходит большинство веществ по степени удельной теплоёмкости;
удивительно и то, что вода способна поглощать огромное количество тепла и при этом сама очень мало нагревается;
вода отличается и полимеризационными способностями. В таком случае свойства её становятся несколько иными, например, кипение полимеризованной воды происходит при более высоких температурах (порядка 6–7 раз выше), чем обычной.
Наш организм в основном состоит из воды. Эмбрион человека на 97% составляет вода. У новорожденного на долю воды приходится около 80% от массы тела. Наиболее интенсивно он теряет жидкость в первые дни жизни — происходит физиологическая убыль массы тела (5-7 %).
С годами количество воды в организме постоянно уменьшается. У детей в возрасте до 5 лет содержание воды в организме составляет уже около 70% от массы тела. К тому времени, когда мы достигаем 50-60-летнего возраста, наше тело содержит не более 50-60% воды.
Все мы знаем, какая эластичная и мягкая кожа у младенцев. Они изгибаются и скручиваются, оставаясь пухлыми, как наполненный водой шарик. Степень гибкости, свойственная младенцам и маленьким детям, к сожалению, с возрастом снижается.
Содержание воды в разных тканях варьирует от 20% в жировой ткани до 83-90% в почках и крови, у женщин в связи с большим количеством жировой клетчатки содержание воды ниже, чем у мужчин. Наш мозг представляет собой влажную субстанцию и состоит из воды на 85%, слюна из неё состоит на 99%, мышцы на 60%. Особенно много воды в крови — до 90%, а стекловидное тел глаза содержит ее даже 96-99%. В костях 20% воды и около 10% в верхних слоях кожи.
Именно благодаря воде обеспечивается тонкое регулирование всех процессов в организме. Вода регулирует массу и температуру нашего тела, разносит питательные вещества к клеткам и выводит шлаки и продукты распада из организма, защищает внутренние органы, участвует в процессе дыхания, растворяет минеральные соли, помогает организму усваивать питательные вещества и преобразовывать пищу в энергию.
Водный обмен регулируется жаждой, метаболизмом, ведущим к образованию воды вследствие процессов окисления, кислотно-щелочным балансом (ацидоз увеличивает диурез, алкалоз — уменьшает), а также функциональным состоянием почек, играющих решающую роль в водном обмене. Резкие сдвиги водного баланса как в сторону гипо-, так и гипергидратации неблагоприятно отражаются на общем состоянии организма человека. При этом избыток воды переносится легче, чем ее недостаток. При понижении содержания воды в организме всего на 2% человек чувствует усталость. Если оно понизится на 8%, следует ожидать серьезных проблем со здоровьем, а на 12% — вероятна остановка сердца. Попробуйте чистую воду тут: https://257267.ru/product/voda-pitevaya-admiral/
Прочитать ещё 1 ответ
Почему когда происходит кораблекрушение, люди прыгают в воду и потом тонут?
мои ответы не являются “глубокомысленными” статьями для ЯДзен. пользователь…
Во-первых, сложно тем, что психически далеко не все подготовлены. Одно дело плавать в бассейне или у берега моря, другое дело в ситуации паники.
Во-вторых, вы не учитываете принципиально важное. Вода отличный проводник тепла и когда ее температура ниже ваших 36 она будет вас охлаждать:
Я не знаю как считают, но гугл дает для Тихого океана, например, температуру среднюю 15 градусов.
А, например, во время крушения Титаника температура воды составляла минус 2 градуса. Как такое может быть? Да просто соленая вода замерзает ниже нуля и как раз -2 порог замерзания.
Прочитать ещё 62 ответа
Из чего состоит морская вода?
ООО “НПК “Диасел” – Профессиональная очистка воды · diasel.ru
Морская вода – это вода с высоким содержанием солей, средняя соленность мирового океана порядка 35 г/л. Главным образом, солесодержание морской воды связанос с наличие ионов натрия и хлора (хлоридов).
У разных морей и океанов различное содержание солей. Самым соленым является Мертвое море (350 г/л). Наименее соленым является Балтийское море (от 2 до 8 г/л).
Также в морской воде есть сульфаты, хлориды, калий, магний, нитраты, кальций, карьонаты и другие ионы. В малых количествах в морской воде присутсвует практически вся таблица Менделеева.
Прочитать ещё 1 ответ
Источник

ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
ЗАПОМНИТЕ!!!
Щелочные металлы – это I группа, А – главная подгруппа – Li, Na, K, Rb, Cs, Fr
Щелочно-земельные металлы – это II группа, А – главная подгруппа (Be, Mg не относятся) – Ca, Sr, Ba, Ra
n I
Основания – это сложные вещества с общей формулой Ме(ОН)n
ОН – гидроксильная группа, с валентностью (I)
Щёлочи – это растворимые в воде основания (см. ТАБЛИЦУ РАСТВОРИМОСТИ)
I n
Кислоты – это сложные вещества с общей формулой Нn (КО)
(КО) – кислотный остаток
V-VII
Кислотный оксид – неМех Оу и Мех Оу
I, II
Основные оксиды – Мех Оу
I. Взаимодействие воды с металлами.
В зависимости от активности металла, реакция протекает при различных условиях и образуются разные продукты.
1). Взаимодействие с самыми активными металлами, стоящими в периодической системе в I А и I I А группах (щелочные и щелочно-земельные металлы) и алюминий. В ряду активности эти металлы расположены до алюминия (включительно)
Реакция протекает при обычных условиях, при этом образуется щелочь и водород.
I I
2Li + 2 H2O = 2 Li OH + H2 (протекает реакция замещения)
HOH гидроксид
лития
I I I
Ba + 2 H2O = Ba (OH)2 + H2
2 Al + 6 H2O = 2 Al (OH)3 + 3 H2
гидроксид
алюминия
ОН – гидроксогруппа, она всегда одновалентна
ВЫВОД – активные металлы – Li, Na, K, Rb, Cs, Fr, Ca, Sr, Ba, Ra + Al – реагируют так
Me + H2O = Me(OH)n + H2 (р. замещения)
основание
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Реакция протекает только с парообразной водой, т.е. при нагревании.
При этом образуются: оксид этого металла и водород.
I I I I
Fe + H2O = FeO + H2 (протекает реакция замещения)
оксид
железа
Ni + H2O = NiO + H2
(Валентность металла можно легко определить по ряду активности металлов, над их символом стоит значение, например +2, это означает, что валентность этого металла равна 2).
ВЫВОД – металлы средней активности, стоящие в ряду активности до (Н2) – Be, Mg, Fe, Pb, Cr, Ni, Mn, Zn – реагируют так
Me + Н2О = Мех Оу + Н2 (р. замещения)
Оксид
металла
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H2O = нет реакции
I I. Взаимодействие с оксидами (основными и кислотными)
С водой взаимодействуют только такие оксиды, которые при взаимодействии с водой дают растворимый в воде продукт (кислоту или щелочь).
1). Взаимодействие с основными оксидами.
С водой взаимодействуют только основные оксиды активных металлов, которые расположены в в I А и I I А группах, кроме Ве и Mg (оксид алюминия не реагирует, т.к. он амфотерный). Реакция протекает при обычных условиях, при этом образуется только щелочь.
I I I
Na2O + H2O = 2 NaOH BaO + H2O = Ba (OH)2 (протекает реакция соединения)
I
H2O + ОСНОВНЫЙ ОКСИД = Ме(ОН)m (р. соединения)
Щёлочь
Al2O3 + H2O = нет реакции
BeO + H2O = нет реакции
MgO + H2O = нет реакции
2) Взаимодействие кислотных оксидов с водой.
Кислотные оксиды реагируют с водой все. Исключение составляет только SiO2.
При этом образуются кислоты. Во всех кислотах на первом месте расположен водород, поэтому уравнение реакции записывают так:
SO3 + H2O = H2SO4 P2O5 + H2O = 2 HPO3
SO3 холодная
+ H2 O P2O5
H2SO4 + H2 O
H2P2O6
P2O5 + 3 H2O = 2 H3 PO4
Горячая
P2O5
+ H6 O3
H6 P2O8
Обратите внимание, что в зависимости от температуры воды при взаимодействии с Р2 О5 образуются разные продукты.
H2O + КИСЛОТНЫЙ ОКСИД = Hn A (р. соединения)
Кислота
Внимание! SiO2 + H2O = нет реакции
IV Взаимодействие воды c неметаллами
Примеры: Cl2 + H2O = HCl + HClO
t
C + H2O = CO + H2
уголь угарный газ
t
Si + 2H2O = SiO2 + 2H2 .
Источник
Оксид водорода (H2O), гораздо более известный всем нам под названием “вода”, без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом – в виде льда, в жикдом, собственно вода, в газообразном – в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. – это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см3;
- вода – хороший растворитель.
Строение молекулы воды
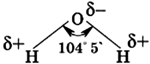
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода – положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
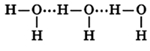
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры – чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии – образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода “охотно” вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
2Na+2H2O = 2NaOH+H2↑
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
3Fe+4H2O=FeO → Fe2O3+4H2↑
C+2H2O → CO2+2H2↑ - с основными оксидами при н.у. вода реагирует с образованием оснований:
CaO+H2O = Ca(OH)2
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
CO2+H2O = H2CO3
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества – в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества – в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества – в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды – такой “слоеный пирог” называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
CuSO4+5H2O = CuSO4·5H2O
См. далее:
- Жесткость воды
- Пероксид водорода (H2O2)
Источник
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
