Какие из перечисленных свойств соответствуют бензолу
Определение и формула
Заголовок
Простой углеводород. Относится к ароматическим углеводородам, классу органических веществ.
Вещество представляет собой прозрачную жидкость, не имеет цвета, обладает сладковатым характерным запахом. Бензол относят к ненасыщенным углеводородам. Знаменитая формула бензольного кольца была предложена нобелевским лауреатом в области химии – Лайнусом Полингом. Именно он предложил изображать бензол в виде шестигранника с окружностью внутри. Это изображение дает понимание об отсутствии двойных связей и наличии единого электронного облака, в которое охвачены все 6 атомов углерода.
Формула
C6H6
Получение бензола
Естественные источники получения
Естественный источник для получения бензола – это каменный уголь. Процесс коксования каменного угля был открыт Майклом Фарадеем в далеком 1825 году. Он изучал светильный газ, который использовали в фонарях уличного освещения, смог выделить и описать бензол. Сейчас этим способом из каменноугольной смолы бензол практически не получают. Существует множество других более продуктивных способов его получения.
Искусственные источники получения
- Искусственный каталитический риформинг бензина. Для получения используются бензиновые нефтяные фракции. В этом процессе образуется большое количество толуола. Спрос на рынке для толуола не очень большой, поэтому из него также далее получают бензол. Из тяжелых фракций нефти пиролизом через процесс деалкилирования смеси толуола, ксилола получают бензол.
- Получение методом Реппе. До 1948 года по методу Бертло получали бензол, пропуская ацетилен над активированным углем при температуре 400°C. Выход бензола был большой, но получалась многокомпонентная смесь веществ, с трудом поддающаяся очистке. В 1948 году Реппе заменил активированный уголь никелем. В результате на выходе получался бензол. Процесс называется тримеризацией ацетелена – три молекулы ацетилена превращаются в одну бензола:
3С2Н2 → С6H6.
Свойства бензола
Физические свойства
| Свойство | Описание |
|---|---|
| плотность | 0,879 г/см3 |
| молярная масса | 78,11 г/моль |
| цвет жидкости | прозрачный, бесцветный |
| температура кипения | 80,1°C |
| температура плавления | 5,5°C |
| растворимость в воде | не растворяется |
При горении выделяется большое количество копоти, так как углеводород ненасыщенный (ему не хватает 8 атомов водорода, чтобы отвечать стандартной формуле предельных углеводородов). При низких температурах бензол становится белой кристаллической массой.
Химические свойства
Бензол вступает в реакции замещения в присутствии катализаторов – обычно это соли Al(3+) или Fe(3+):
- Галогенирование – качественная реакция на бензол с Br2:
C6H6 + Br2 = C6H5Br + HBr.
- Нитрование – взаимодействие с азотной кислотой. В органической химии этот процесс сопровождается отщеплением OH-группы:
C6H6 + HO-NO2 → C6H5NO2 + H2O.
- Каталитическое алкилирование приводит к получению гомологов бензола – алкилбензолов:
С6H6 + С2H5Cl → C6H5C2H5 + HCl.
Гомологи бензола, содержащие радикал, реагирует не так как сам бензол. Реакции идут по-другому и часто на свету:
- галогенирование С6H5-CH3 + Br2 (на свету) = С6H5-CH2Br + HBr;
- нитрование – С6H5-CH3 + 3HNO3 → C6H2CH3(NO2)3.
Реакции окисления бензола идут очень сложно и не характерны для этого вещества. Окисление характерно для гомологов. Вот, например, реакция получения бензойной кислоты:
С6H5CH3 + [O] → C6H5COOH.
Процесс горения вещества происходит по стандартной схеме для всех органических веществ:
CnH2n-6 + (3n-3)2 O2 → nCO2 + (n-3)H2O.
Реакции гидрирования. Реакция проходит сложно, требуются катализаторы, давление, температура. В реакциях бензола с водородом получается циклогексан:
С6H6 + 3H2 → C6H12.
А в реакциях с алкилбензолом – метилциклогексан, где один атом водорода замещается на радикальную группу -CH3:
С6H5CH3 + 3H2 → C6H11-CH3.
Применение бензола
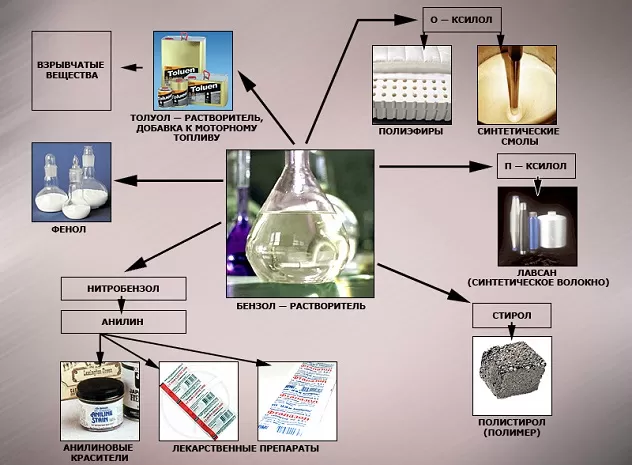
Бензол в чистом виде практически не используется. Его вырабатывают для производства других важных соединений, таких как, например, этилбензол, из которого получают стирол и полистирол.
Львиную долю бензола пускают на производства фенола, который необходим в производстве капрона, красителей, пестицидов, лекарств. Знаменитое лекарство аспирин невозможно получать без участия фенола.
Циклогексан из бензола необходим для производства пластмасс и искусственных волокон, нитробензол идет на выработку анилина, который используют для производства каучуков, красителей и гербицидов.
Тест по теме «Бензол»
Источник
Что такое бензол?
Бензол – это органическое вещество, при обычных условиях представляет собой бесцветную жидкость со специфическим сладковатым запахом. Является простейшим ароматическим углеводородом. Входит в состав сырой нефти. Не растворим в воде, сильно токсичен. Химическая формула C6H6. Первый раз был получен Майклом Фарадеем, который выделил его из конденсата светильного газа (смесь водорода 50 %, метана 34 %, угарного газа 8 %).
Физические и химические свойства
Молярная масса равна 78,11 г/моль. При температуре 80,1 °C начинает кипеть, при -5 °С — плавиться. Плотность равна 0.879 г/см³. Вступает в реакции замещения:
· галогенирования, при котором атом водорода заменяется хлором или бромом, такие реакции проходят при нагревании с обязательным участием катализатора;
· нитрования (введение нитрогруппы в бензольное кольцо), итогом которой становится тяжёлая желтоватая жидкость с запахом горького миндаля – нитробензол, такая реакция может использоваться как качественная на определение;
· алкилирование галогеналканами (реакция Фриделя-Крафтса), эта реакция позволяет ввести углеводородный радикал в бензольное кольцо, и считается одним из методов получения гомологов бензола;
· алкилирование алкенами.
Бензол может вступать в реакцию горения, в результате которой образуются вода и углекислый газ.
Получение
Сейчас существует несколько методов получения бензола:
· добыча методом коксования каменного угля – активно применялась почти до середины ХХ века, бензол, полученный таким способом, не подходит для некоторых технологических процессов в современном производстве;
· методика аромаизинга бензиновых фракций нефти используется в США (в РФ и странах Европы этим методом получают половину всего бензола);
· термическое разложение тяжелых и лёгких фракций нефти – во время процесса попутно образуются толуол и ксилолы, обычно их сразу отправляют на процесс деалкилирования, и тоже получают бензол;
· тримеризация ацетилена – газ пропускают при высокой температуре над средой из активированного угля, при этом образуется бензол, плюс еще несколько ароматических углеводородов.
Важно: мировой спрос на бензол сейчас составляет более 42 млн. т, по прогнозам экспертов, к концу 2020 года эта цифра составит более 57 млн. т. Ежегодно даже рынку США не хватает ~600 тысяч тонн этого вещества.
Применение
Почему бензола требуется так много? Он необходим в производстве синтетического каучука (резина для автомобильных шин), пластмассы, синтетического волокна, красителей, ПАВ и пр. Бензол может использоваться как растворитель и экстрагент в промышленном производстве красок, его добавляют в бензин для повышения октанового числа (не более 1% по современным нормам).
Опасен ли бензол?
Влияние на человека
Это вещество является самым распространённым ксенобиотиком антропогенного происхождения (чужеродное для живых организмов вещество, не участвующее в естественном биотическом круговороте). Внимание! Бензол сильно ядовит – минимальная смертельная доза при приеме внутрь составляет всего 15 миллилитров. Он относится к веществам третьего класса опасности для человека по мировому стандарту NFPA 704 (как хлор и серная кислота). Его кратковременное воздействие может привести к серьёзным временным или умеренным остаточным последствиям. Сильный канцероген.
Горючесть
Быстро испаряется при нормальном атмосферном давлении и температуре, легко рассеивается в воздухе и легко возгорается. Температура вспышки ниже 23 °C. Поэтому по стандарту NFPA 704 это вещество имеет четвёртый класс, то есть является максимально огнеопасным.
Меры предосторожности
Работа с бензолом строго регламентируется. Во время лабораторных экспериментов его рекомендуется использовать в малом количестве (не более 50 мл). Все действия должны проводиться в защитных перчатках из фторкаучука, так же обязательна защита глаз и органов дыхания. Запрещается работать в закрытом, невентилируемом помещении, с температурой воздуха больше 30°С.
Купить бензол вы можете в магазине Химик24. Реализация оптом и в розницу.
Источник
Наверно каждый человек помнит о таком веществе, как бензол, еще с курса органической химии. Данное углеводородное соединение было открыто химиком Фарадеем в 1825 г., однако название «бензол» оно приобрело еще в далеком XVII веке.
Бензол является ароматическим углеводородным соединением, представляющим собой прозрачную жидкость, которая имеет слегка сладковатый запах. Структурная формула бензола – C6H6.
Это вещество является составной частью нефтепродуктов, применяется в промышленной и медицинской областях, входит в состав пластмассы, резины и различных красок.
Характеристики и физические свойства бензола
Некоторые углеводородные соединения сильно похожи на бензол. Однако они отличаются видом реакции, в которую вступают. Так, этилен, являющийся ненасыщенным углеводородом, вступает в реакцию присоединения, в то время как бензол вступает в реакцию замещения. Это происходит из-за того, что атомы бензола располагаются в одной плоскости.

Еще одним отличием является наличие в формуле бензола бензольного кольца. Таким образом, если в химической формуле вещества имеется бензольное кольцо — однозначно это бензол.
Строение этого углеводорода представлено в виде шестиугольника.
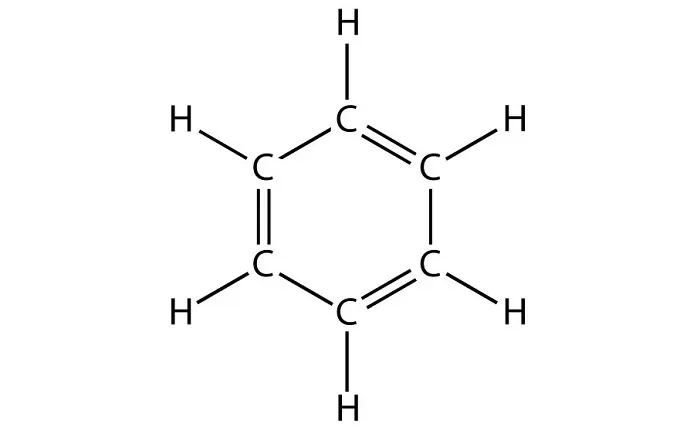
Данный углеводород имеет следующие физические свойства:
вещество представляет собой жидкость, имеющую не совсем приятный запах;
температура плавления бензола составляет 5,50C;
температура кипения — 800C;
общая плотность вещества — 0,879 г/см3;
молярная масса 78,1 г/моль;
без проблем реагирует с органическими растворителями;
при попадании воздуха образует взрывоопасное соединение;
в процессе горения на свету видны следы копчения;
растворим в воде, нагретой до 250C.
Получение бензола
Российским ученым-химиком Зелинским Н. Д. было доказано, что бензол возможно получить не только в процессе коксования угля, при котором данное сырье нагревается, выделяя бензол и иные летучие вещества. Данное вещество может быть образовано из циклогексана, в случае взаимодействия его с платиной или палладием.
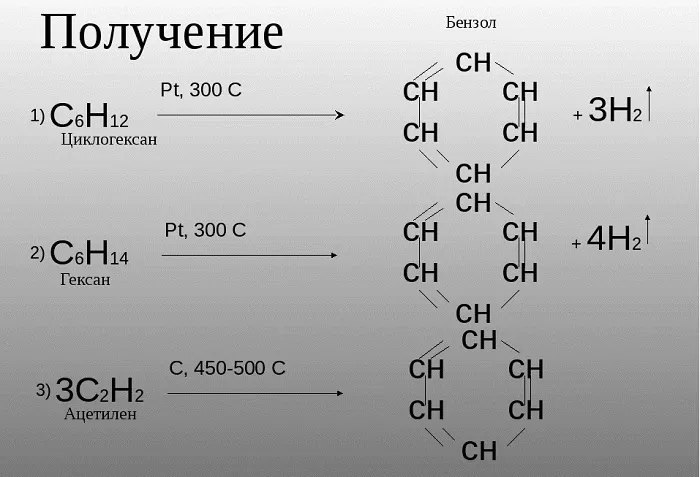
Также, бензол можно получить путем нагревания гексана.
Зелинский также считал, что бензол возможно получить путем тримеризации ацетилена:
3HС ≡ CH (Cакт., 550C) → C6H6
В настоящее время, большой популярностью пользуются такие способы получения бензола, как получение его из циклопарафинов и предельных углеводородов. Связано это прежде всего, с тем, что необходимость этого вещества сильно возросла.
Химические свойства бензола
Бензол активно вступает в реакции с кислотами, а также веществами из класса алкенов, галогенов, аренов и хлоралканов. В основном данный углеводород вступает в реакцию замещения. Высокая температура и сильное давление оказывают влияние на разрыв бензольного кольца.
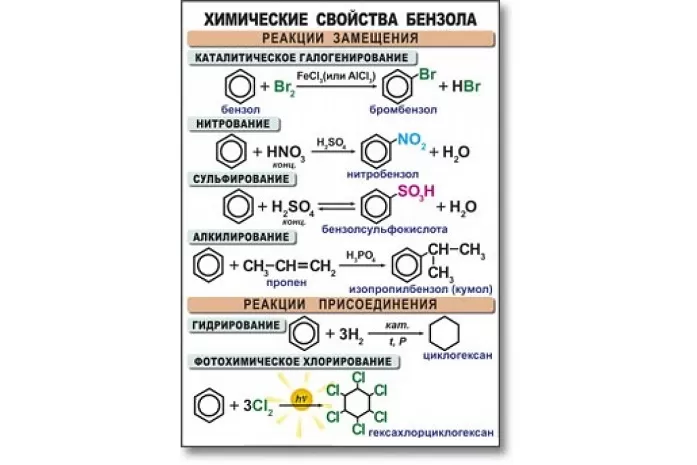
Уравнения реакции бензола:
- в случае наличия катализатора, бром вступает в реакцию с хлором, образуя при этом хлорбензол:
С6H6 + 3Cl2 → C6H5Cl + Hcl2;
- алкилирование бензола. Алкилбензол образуется в результате соединения бензола с алканами:
C6H6 + C2H5Br → C6H5C2H5 + HBr3;
- нитрование и сульфирование бензола:
C6H6 + H2SO4 → C6H5SO3H + H2O,
C6H6 + HNO3 → C6H5NO2 + H2O;
- галогенирование бензола:
С6H5 – CH3 + Br = C6H5 – CH2Br + HBr;
- к гомологам бензола относятся алкилбензолы, которые вступают в реакцию окисления, образуя при этом бензойную кислоту:
C6H5CH3 + [O] → C6H5COOH.
Применение бензола
В настоящее время бензол применяется во многих областях нашей жизни.
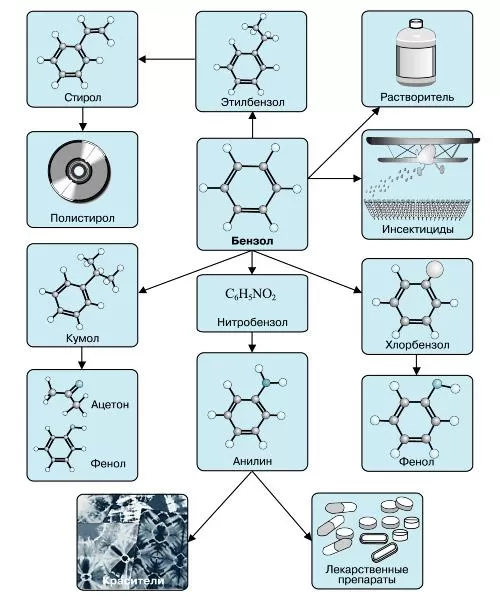
Наиболее часто данный углеводород применяется для синтезирования иных органических веществ. Используя реакцию нитрирования получают нитробензол; хлорирования — хлорбензол (растворитель), и другие вещества.
Хлорбензол часто используется в сфере сельского хозяйства, поскольку он является прекрасным средством для защиты растений. Данным веществом, при замене в его структуре молекул водорода молекулами хлора, протравливают семена растений, чтобы защитить их от грызунов и насекомых.
В области химической промышленности бензол играет немаловажную роль. Помимо его участия при создании других веществ, он также выступает в качестве растворителя. С помощью бензола возможно растворить любое органическое соединение.
Сегодня этот углеводород чаще всего используется при синтезировании этилбензола и кумола. Однако он редко применяется в чистом виде. В основном используются его производные компоненты. Этилбензол успешно применяется в качестве одного из компонентов автомобильного топлива, а также для синтезирования ионообменной смолы.
Помимо сельскохозяйственной и химической промышленности, бензол успешно применяется в области медицины.
Впервые бензол начали применять для лечения такого заболевания, как белокровие. В начале 20 века медики всего земного шара использовали бензол для лечения лейкемии, однако вскоре выяснилось, что вылечить эту болезнь таким методом нельзя.
Сначала бензол принимали перорально, затем стали вводить в качестве инъекции. Такое его применение было связано с тем, что первоначальные исследования показали возможность данного вещества снижать уровень лейкоцитов в крови, но вскоре выяснилось, что его применение в этих целях очень опасно.
Источник
Бромирование бензола
Бензол, в отличие от алкенов, не взаимодействует с бромной водой, но вступает в реакцию с бромом в присутствии катализатора бромида железа.
Продукты реакции после промывания: бромбензол, раствор бромоводорода.
Верны ли три приведённых утверждения о физических свойствах бромбензола? Выберите правильные ответы.
Бромбензол – густая вязкая жидкость, образующая слой на дне стакана.
Бромбензол растворим в воде
Плотность бромбензола менее 1 г/см3
Бромбензол является жидкостью
Физические свойства аренов
Познакомьтесь с физическими свойствами аренов (табл.1).
Таблица 1
Некоторые физические свойства аренов
Название | Формула | Тпл., ºС | Ткип., ºС | Плотность, г/см3 |
Бензол | С6Н6 | 5,5 | 80 | 0,879 |
Толуол | С6Н5СН3 | –95 | 111 | 0,867 |
Этилбензол | С6Н5С2Н5 | –95 | 136 | 0,867 |
Изопропилбензол (кумол) | С6Н5СН(СН3)2 | –96 | 152 | 0,862 |
Представьте на шкале температур интервалы, в которых арены являются жидкостями. Отметьте на шкале комнатную температуру (20 ºС), чтобы убедиться, какие из веществ являются при этой температуре жидкостями.
Для выполнения задания нужно внимательно прочитать данные таблицы (обратить внимание на приведенные температуры плавления и кипения).
Качественные реакции на углеводороды
Соберите мозаику
Вспомните, какие свойства бензол проявляет как непредельный углеводород, а какие делают его схожим на предельные углеводороды.
Превращения
Укажите последовательность веществ, полученных в процессе:
С2Н2 → Х → Y → Z → C6Н5СООН, выбрав из соединений:
С6Н5Br, С6Н6, С6Н5СН3. Укажите связями молекулярные формулы веществ для участков схемы превращений.
Подумайте, какое вещество можно получить из ацетилена, чтобы можно было перейти к новому гомологическому ряду органических веществ.
Растворимость бензола
Укажите свойства бензола, используя выпадающие списки.
Растворимость в воде | |
Растворимость в спирте |
Гомологи бензола
Составьте формулы гомологов бензола, используя в качестве основы радикалы фенил (С6Н5—) и его более активный аналог с двумя свободными связями (радикал —С6Н4—), а также приведённые в таблице заместители. Определите, сколько разных гомологов можно создать для каждой из основ, и укажите общее количество.

Если у радикала одна свободная связь, к ней может быть присоединен только один из двух возможных заместителей. Но при анализе второго радикала стоит быть внимательным: одинаковы ли два соединения: первое, у которого в верхнем положении заместитель этил, а в правом – метил; второе, у которого в верхнем положении заместитель метил, а в правом – этил.
Решение задачи о свойствах толуола
Название гомологов бензола
Найдите и выделите разными цветами названия трёх гомологов бензола.
Сравнение отношения бензола и толуола к брому
Цель:
- изучить свойства бензола и толуола в реакции с галогенами.
Задачи:
- на основе химических реакций ароматических углеводородов с галогенами сравнить химические свойства бензола и толуола.
Приборы и реактивы:
Используемые при выполнении работы реактивы: бромная вода (Br2), толуол (C6H5CH3), бензол (C6H6).
Для выполнения работы необходимы: штатив для пробирок, пробирки (2 шт.), флаконы для реактивов (3 шт.), штатив с зажимом, пипетка, спиртовка, спички.
Выполните лабораторную работу.
Источник
