Какие из представленных оксидов проявляют только кислотные свойства
Источник
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?

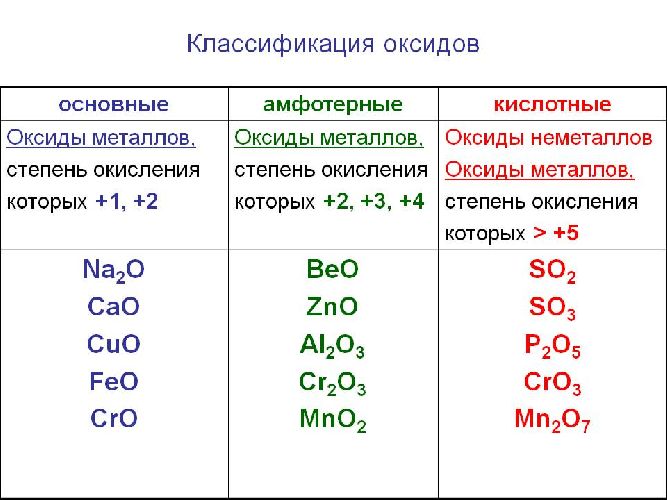
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).

Рис. 1. Виды оксидов.
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
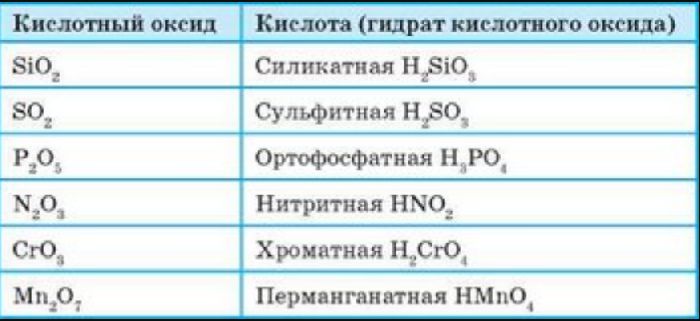
Рис. 2. Кислотные оксиды с соответствующими кислотами.
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |

Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Владимир Мартынов
7/10
Polina Malchikova
9/10
Дима Кулагин
10/10
Сергей Ефремов
9/10
Артём Макушенко
10/10
Наталия Григорьева
10/10
Данила Волков
9/10
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 988.
Источник
Классификация химических веществ важна для понимания химических процессов, а без номенклатуры мы вряд ли сможем понимать друг друга. Умения различать классы веществ и правильно называть их – один их первых навыков, которые получают школьники при изучении химии в школе. Разумеется, не обходится без них и экзамен, будь то ОГЭ или ЕГЭ по химии.
Фото: thermalsprayusa.com
Для начала напомню, что существуют вещества простые, состоящие из атомов одного вида, и сложные, состоящие из атомов разных видов. Простые вещества разделяются на металлы (примеры: натрий Na, медь Cu, золото Au) и неметаллы (примеры: сера S, фосфор Р, водород О2. Обратите внимание, что молекулы газов, за исключением инертных, в обычных условиях состоят из двух атомов. Тем не менее, это простые вещества, поскольку в молекуле присутствуют атомы только одного вида: кислород О2, озон О3, азот N2).
Теперь перейдём к веществам сложным. Среди них выделяют оксиды, гидроксиды, кислоты и соли. Первый класс, который мы рассмотрим, – оксиды. Оксиды всегда состоят из двух элементов, один из которых кислород. Они могут быть основным (образованы металлом и кислородом), кислотными (образованы неметаллом и кислородом) и амфотерными (в зависимости от условий проявляющими свойства основных или кислотных).
Теперь переходим к разбору заданий, похожие на которые могут встретиться в ОГЭ по химии.
Задание 1.
Какая формула соответствует оксиду железа (III)?
1. Fe2O3
2. FeO
3. Fe(OH)3
4. FeSO4
Ответ: 1.
Объяснение: варианты 4 и 3 можно сразу исключить, поскольку в них присутствуют не только элемент и кислород, как должно быть в оксиде (Fe(OH)3 – гидроксид железа (III) и FeSO4 – сульфат железа (II)). Вариант 2 тоже не подходит, потому что в нём железо имеет валентность II. Таким образом, правильный вариант 1.
Задание 2.
Кислотному оксиду SO3 соответствует кислота:
1. H2SO3
2. Na2SO4
3. H2SO4
4. SF6
Ответ: 3.
Объяснение: для начала поймём, какая валентность у вещества в задании. SO3 – оксид серы (VI), то есть сера здесь имеет валентность VI. Значит, нам нужно найти кислоту, где у серы та же валентность. В варианте 1 представлена сернистая кислота, валентность серы в ней IV. В варианте 2 представлена не кислота, а соль 9сульфат натрия). В варианте 4 тоже не кислота, а фторид серы. А вот в варианте 3 представлена серная кислота, где валентность серы как раз VI.
Задание 3.
В какой паре представлены два основных оксида?
1. Al2O3 и ZnO
2. N2O5 и CO2
3. BaO и B2O3
4. Li2O и MgO
Ответ: 4.
Основные оксиды образованы металлом и кислородом. В варианте 1 представлены амфотерный оксид алюминия и основной оксид цинка. В варианте 2 представлены кислотные оксиды: оксид азота (V) и оксид углерода (IV). В варианте 3 представлены основной оксид бария и кислотный оксид бора. В варианте 4 представлены основные оксиды: оксид лития и оксид магния, это и есть нужный вариант.
Задание 4.
Какой оксид является амфотерным?
1. К2О
2. Р2О5
3. Al2O3
4. SO2
Ответ: 3.
Объяснение: амфотерных оксидов, которые изучают в школе, не так много, так что можно их запомнить. Яркий пример – оксид алюминия, то есть вариант 3. Вариант 1 – это основной оксид калия, вариант 2 – кислотный оксид фосфора (V), вариант 4 – кислотный оксид серы (IV).
Задание 5.
В какой паре представлены кислотный и основной оксиды?
1. Fe2O3 и CaO
2. Cl2O7 и Na2O
3. ВаО и FeO
4. CO2 и SiO2
Ответ: 2.
Объяснение: кислотный оксид образован неметаллом и кислородом, основной – неметаллом и кислородом. Посмотрим на наши варианты. Вариант 1 – это амфотерный оксид железа (III) и основной оксид кальция. Вариант 2 – это кислотный оксид хлора (VII) и основной оксид натрия. Вариант 3 – это основной оксид бария и основной оксид железа (II). Вариант 4 – это кислотный оксид углерода (IV) и кислотный оксид кремния. Таким образом, подходит вариант 2.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
