Какие из веществ могут проявлять только окислительные свойства
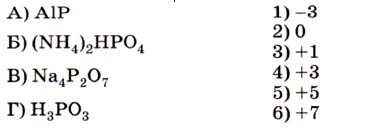
Опубликовано 1 год назад по предмету
Химия
от АхадМуратов
Не тот ответ, который вам нужен?
Найди нужный
Самые новые вопросы
![]()
Математика – 6 месяцев назад
Сколько здесь прямоугольников
![]()
История – 1 год назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
![]()
Литература – 1 год назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
![]()
Русский язык – 1 год назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
![]()
Русский язык – 1 год назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
![]()
Русский язык – 1 год назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
![]()
Физика – 1 год назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
Окислительно-восстановительные реакции могут проходить только при условии, что исходные компоненты содержат атомы, молекулы или ионы, обладающие противоположными способностями принимать или отдавать электроны.
5KCl+5O3+6P0 = 5KCl-1+3P2+5O5
В приведенной реакции хлор и фосфор изменяют свои степени окисления:
- P0-5e- → P+5, фосфор (P0) является восстановителем, окисляясь до P+5 (степень окисления фосфора повышается на 5 единиц от 0 до +5).
- Cl+5+6e- → Cl-1, хлор (Cl+5) является окислителем, восстанавливаясь до Cl-1 (степень окисления хлора понижается на 6 единиц – от +5 до -1).
В периодической таблице Менделеева четко прослеживается закономерность изменения окислительно-восстановительных свойств элементов:
- В периодах с увеличением порядкового номера элемента (слева-направо) нарастают окислительные свойства и убывают восстановительные – натрий самый сильный восстановитель в третьем периоде, а хлор – самый сильный окислитель.
- В главных подгруппах, в пределах одной главной подгруппы с повышением порядкового номера (по направлению сверху-вниз) нарастают восстановительные свойства элементов и убывают окислительные – в VIIа группе фтор является сильным окислителем, а астат в некоторых соединениях проявляет восстановительные свойства.
На рисунке ниже показана примерная принадлежность элементов к восстановителям (голубой цвет) и окислителям (красный цвет).

С окислительно-восстановительными свойствами элементов в периодической таблице в общем чертах понятно. Теперь скажем пару слов о ионах.
- Элементарные катионы металлов (Na+, Cu2+, Ca2+) являются окислителями и не проявляют восстановительных свойств, окислительные свойства снижаются по мере роста активности металла.
- Ионы металлов с промежуточными степенями окисления могут проявлять, как восстановительные, так и окислительные свойства (Fe2+ – восстановитель; Fe3+ – окислитель).
- Элементарные анионы (Cl-, Br-, I-) являются восстановителями.
- Сложные ионы являются окислителями, если содержат атомы элементов с высокой степенью окисления (Cr2O72-, ClO3-,NO3-), при этом окислительные свойства обусловлены всем анионом, но не конкретным атомом, имеющим высокую степень окисления.
А что же с окислительно-восстановительными свойствами сложных веществ?
При взаимодействии сложных веществ следует обращать внимание на те элементы, которые в ходе реакции меняют свою степень окисления (если таковых нет, то и реакция не является окислительно-восстановительной).
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в максимальной степени окисления – такое вещество может быть только окислителем, например перманганат калия, в котором марганец имеет максимальную степень окисления, т.е., может только принимать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в низшей степени окисления – такое вещество может быть только восстановителем, например, сульфат марганца (II), в котором марганец имеет низшую степень окисления, т.е., может только отдавать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в промежуточной степени окисления, – такое вещество может быть как окислителем, так и восстановителем – все зависит от других реагирующих веществ и условий протекания реакции.
Рассмотрим вкратце вещества, которые могут проявлять и восстановительные, и окислительные свойства, в зависимости от условий реакции и других взаимодействующих веществ.
Оксид серы (IV) в некоторых случаях играет роль восстановителя, например, окисляясь кислородом, но в металлургии оксид серы используют в реакции извлечения серы из отходящих газов, где оксид серы проявляет свойства окислителя:
2SO2+O2 = 2SO3
2CO+SO2 = S+2SO2
Пероксид водорода H2O2, как восстановитель применяется для дезинфекции, травления германиевых пластинок при изготовлении полупроводниковых приборов. Окислительные свойства пероксида водорода используют при отбеливании пуха, пера, мехов, тюли, волос.
Сернистая кислота в реакции с сероводородом играет роль окислителя, поскольку в молекуле H2S сера имеет степень окисления -2:
H2S+4O3+2H2S-2 = 3S0+3H2O
В реакции с кислородом сернистая кислота выступает восстановителем, поскольку кислород является более сильным окислителем:
2H2S+4O3+O20 = 2H2SO4
Не последнюю роль на окислительно-восстановительные свойства веществ оказывает среда, в которой протекает химическая реакция:
- I2+5H2O2 → 2HIO3+4H2O – при pH=1 пероксид водорода является окислителем;
- 2HIO3+5H2O2 → I2+6H2O+5O2 – при pH=2 пероксид водорода является восстановителем.
Оксид марганца (IV) является окислителем только в кислотной среде:
MnO2+4H++2e- → Mn2++2H2O
Перманганат калия KMnO4 является окислителем в любой среде:
- кислая среда: MnO4-+8H++5e- → Mn2++4H2O
- щелочная среда: MnO4-+1e- → MnO42-
- нейтральная среда: MnO4-+2H2O+3e- → MnO2+4OH-
См. далее:
- Типичные восстановители
- Типичные окислители
Окислители и восстановители любят “свою” среду – в кислотной среде сила окислителей увеличивается, а в щелочной – увеличивается сила восстановителей.
См. далее Элементы-восстановители
Источник
1. Вещества, являющиеся окислителями при высоких температурах:
Cl2, F2, KClO3, K2FeO4, KMnO4, KNO3, K2S2O8, MnO2,
NaBiO3, NaO2, O2, PbO2, (Pb2IIPbIV)O4
2. Вещества, являющиеся окислителями в кислотной среде (расположены по уменьшению их окислительной способности):
F2, Na2O2, NiO(OH), (Pb2IIPbIV)O4, O3, K2S2O8, K2FeO4,
NaBiO3, CoO(OH), H2O2, KMnO4, KBrO3, PbO2, Cl2,
K2Cr2O7, MnO2, O2, KNO2, KIO3, Br2, HNO3(конц), I2, H2SO4(конц), H+(разб)
3. Вещества, являющиеся окислителями в щелочной среде:
F2, K2S2O8, Cl2O3, Na2O2, Br2, H2O2, NaClO, NaBrO, KMnO4,
I2, O2, PbO2, (Pb2IIPbIV)O4, K2CrO4, H2O
4. Кислородсодержащие соединение галогенов (а также их соли) являются окислителями в кислотной среде:
- HCl+1O
- HCl+3O2
- HCl+5O3
- HBr+5O3
- HCl+7O4
- 2HI+5O3
5. Сильные кислоты-окислители:
- Азотная кислота HNO3
- Азотистая кислота HNO2 (нитриты, нитраты);
- Серная кислота H2SO4.
Наиболее важные вещества-окислители:
- Галогены, гипохлораты, хлораты, перхлораты
- Соединения марганца: Mn2O7(VII), MnO3(VI), MnO2(IV), K2MnO4
- CrO3(VI), K2CrO4, K2CrO7
- HNO3 и ее соли
- H2SO4(конц), H2SeO4
- O2, O3, H2O2 и его соли
- CuO(II), Ag2O(I), PbO2(IV)
- Катионы благородных металлов
- Ацетат свинца (II)
- Pb(CH3COO)2, FeCl3(III), (NH4)2S2O8, K3[Fe(CN)6]
- Царская водка
- Анод при электролизе
Рассмотрим вкратце наиболее типичные и важные окислители.
Окислительные свойства хлора нашли широкое применение в трикотажной и целлюлозно-бумажной промышленности (отбеливание тканей и бумаги), в качестве дезинфицирующего средства, для обеззараживания воды. Хлор является исходным сырьем для получения многих окислителей (гипохлоритов, хлоритов, хлорпроизводных органических веществ). Уникальность хлора заключается в том, что, восстанавливаясь, хлор принимает один электрон, и переходит в хлорид-ион, который, в зависимости от условий, может терять от 1 до 8 электронов, благодаря чему хлор может принимать степень окисления от -1 до +7. Из соединений хлора, в которых он имеет максимальную степень окисления, получают соединения с промежуточными степенями окисления (в зависимости от температуры и активности восстановителя):
- KCl+7O4 – проявляет только окислительные свойства
- KCl+5O3
- Ba(Cl+3)2)2
- NaCl+1O
- Cl20
- HCl-1 – проявляет только свойства восстановителя
Азотная кислота является сильным окислителем, в зависимости от ее концентрации и активности восстановителя, HNO3 может восстанавливаться до различных соединений (чем концентрирована кислота, тем сильнее она восстанавливается), в которых степень окисления азота колеблется от +4 до -3:
- HN+5O3
- N+4O2 – до оксида азота (IV) восстанавливается концентрированная азотная кислота в реакциях с медь, свинец, бромиды;
- HN+3O2
- N+2O – до оксида азота (II) восстанавливается концентрированная азотная кислота в реакциях с более сильными восстановителями (цинк, магний, йодид калия);
- N2+1O – до оксида азота (I) восстанавливается разбавленная азотная кислота;
- N20 – до аммиака восстанавливается сильно разбавленная азотная кислота;
- N-1H2OH
- N2-2H4
- N-3H3
Концентрированный водный раствор азотной кислоты пассивирует алюминий, железо, хром.
Платина, золото, цирконий, торий не растворяются в азотной кислоте, но растворяются в царской водке (смесь концентрированных HCl и HNO3 в соотношении 3:1).
Высокие окислительные способности царской водки обусловлены выделяющимся атомарным хлором:
HNO3+3HCl = NOCl+2Cl+2H2O
NOCl = NO+Cl
————
HNO3+3HCl = NO+3Cl+2H2O
Растворение золота происходит с образованием золотохлористоводородной кислоты:
Au+3Cl+HCl = H[AuCl4]
Суммарное уравнение окисления золота царской водкой:
Au+HNO3+4HCl = H[AuCl4]+NO+2H2O
Тантал, ниобий, вольфрам, молибден не растворяются даже в царской водке, для их растворения используют смесь азотной и фтороводородной кислоты.
Напоследок скажем о кислороде, который является, пожалуй, самым распространенным окислителем на Земле.
См. далее Классификация ОВР
Источник
Задача 619.
На основе электронного строения атомов указать, могут ли быть окислителями: атомы натрия, катионы натрия, кислород в степени окисленности -2, йод в степени окисленности 0, фторид-ионы, катионы водорода, нитрит-ионы и, гидрид-ионы.
Решение:
Вещества, содержащие атомы элементов, которые уменьшают свою степень окисленности, называются окислителями.
Атомы натрия Na содержат по одному электрону на внешней электронной оболочке, поэтому они могут только отдавать электроны, т.е. натрий – восстановитель.
В катионе натрия атом натрия имеет степень окисленности +1, т.е. он может уменьшать свою степень окисленности, проявляя свойства окислителя.
Кислород в степени окисленности -2 может увеличивать свою степень окисленности, проявляя свойства восстановителя.
Иод в степени окисленности 0 может, как понижать, так и повышать свою степень окисленности, т.е. может быть окислителем.
Атом фтора в фторид-ионе имеет степень окисленности -1, поэтому может увеличивать свою степень окисленности, проявляя свойства окислителя.
Атомы водорода в катионах водорода находятся в степени окисленности +1, т.е. могут уменьшать свою степень окисленности, проявляя свойства окислителя.
В нитрит-ионе атомы азота находятся в своей промежуточной степени окисленности +4, поэтому могут как уменьшать, так и увеличивать степень окисленности, проявляя свойства и восстановителя, и окислителя.
Атомы водорода в гидрид-ионе находятся в своей наименьшей степени окисленности, значит, они могут увеличивать свою степень окисленности, проявляя свойства окислителя.
Задача 620.
Какие из перечисленных ионов могут служить восстановителями, а какие не могут и почему: Cu2+, Sn2+, Cl-, VO3-, S2-, ,Fe2+ WO42-, IO4-, Al3+, Hg2+, Hg22+?
Решение:
Окислители – частицы, которые способны понижать степень окисленности элемента.
В ионе Cu2+ атом меди находится в высшей степени окисленности, поэтому может только понижать свою степень окисленности, т.е. проявлять свойства окислителя.
В ионе Sn2+ атомы олова находятся в промежуточной степени окисленности, поэтому олово в данном ионе может, как понижать, так и повышать свою степень окисленности, проявляя свойства или окислителя, или восстановителя.
Хлор в ионе Cl- имеет самую низшую степень окисленности, поэтому может только повышать свою степень окисленности, проявляя свойства восстановителя.
Атом ванадия в ионе VO3- находится в высшей степени окисленности, поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Сера в ионе S2+ находится в своей низшей степени окисленности, поэтому может только повышать свою степень окисленности, проявляя свойства восстановителя.
Атом железа в ионе Fe2+ находится в промежуточной степени окисленности, поэтому может, как повышать, так и понижать свою степень окисленности, т. е. проявлять свойства или окислителя, или восстановителя.
Атом вольфрама в ионе WO42- находится в своей высшей степени окисленности (+6), поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Иод в ионе IO3- находится в своей высшей степени окисленности (+7), поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Алюминий в ионе Al3+ находится в высшей степени окисленности, поэтому может только понижать свою степень окисленности, проявляя свойства окислителя.
Ртуть в ионе Hg2+ находится в своей высшей степени окисленности, поэтому может только понижать степень окисленности, проявляя свойства окислителя.
Ртуть в ионе Hg22+ находится в промежуточной степени окисленности (+1), поэтому может, как понижать, так и повышать свою степень окисленности, проявляя свойства или окислителя, или восстановителя.
Задача 621.
Какие из перечисленных веществ и за счет, каких элементов проявляют обычно окислительные свойства, и какие – восстановительные? Указать те из них, которые обладают окислительно-восстановительной двойственностью: H2S, SO2, CO, Zn, F2, NaNO2, KMnO4, HOCl, H3SbO3.
Решение:
а) В H2S сера находится в низшей степени окисления (-2), поэтому может только увеличивать свою степень окисления, проявляя свойства восстановителя.
б) В SO2 сера находится в промежуточной степени окисления (+4), поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
в) В СО атом углерода находится в промежуточной степени окисления (+2), поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
г) В Zn атом находится в своей низшей степени окисления (0), поэтому может только увеличивать свою степень окисления, проявляя свойства восстановителя.
д) В молекуле F2 атом фтора имеет степень окисления равную 0, а также, обладая самой высокой степенью окисления среди всех элементов, может только присоединять недостающий до полного завершения внешнего электронного слоя один электрон, проявляя свойства окислителя.
е) В NaNO2 атом азота находится в промежуточной степени окисления равной +4, поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
ж) В KMnO4 находится в высшей степени окисления (+7), поэтому может только уменьшать свою степень окисления, проявляя свойства окислителя.
з) В НOCl атом хлора находится в степени окисления равной +1, поэтому может как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
к) В H3SbO3 атом сурьмы находится в промежуточной степени окисления (+3), поэтому может, как уменьшать, так и увеличивать свою степень окисления, проявляя свойства или окислителя, или восстановителя.
Источник
Глава 4. Обобщение знаний по химии за курс основной школы. Подготовка к ГИА
Окислительно-восстановительными реакциями (ОВР) называют реакции, в ходе которых происходит изменение степеней окисления элементов, образующих реагирующие вещества.
Окислитель — вещество (элемент в составе этого вещества), принимающее электроны. Само оно при этом восстанавливается.
Восстановитель — вещество (элемент в составе этого вещества), отдающее электроны. Само оно при этом окисляется.
Примеры тестовых заданий и рекомендации к их выполнению
1. Веществом, которое за счёт аниона проявляет только восстановительные свойства, является
1)H2SO4 2) SO2 3) Na2SO3 4) H2S
Восстановителем является та частица, в которой элемент имеет наименьшее значение степени окисления. Так как все анионы веществ, данных в вариантах ответов, образованы серой, то наименьшее значение степени окисления равно -2 (сера — элемент VI группы, и её атому недостаёт до завершения внешнего слоя именно двух электронов). Это значение степени окисления имеет сера в сероводороде. Ответ: 4.
2. Хлор проявляет только восстановительные свойства в соединении, формула которого
1)КСlO 2) КСlO4 3)Сl2O7 4) НСl
Данное задание выполняется по аналогии с предыдущим. Ответ: 4.
3. Процессу восстановления соответствует схема

Достаточно сложное задание, однако эту сложность легко преодолеть, используя логику. Так как процесс восстановления — это понижение степени окисления, то сразу следует исключить ответ 3 и обратить внимание на ответ 4, поскольку сера изменила степень окисления. Определив значение этого изменения с 0 до -2, можно сделать вывод, что именно ответ 4 является верным. В этом случае не нужно будет испытывать затруднений и тратить время для определения степеней окисления в катионе аммония и в сульфит-анионе. Ответ: 4.
4. Элемент бром является восстановителем в реакции, уравнение которой
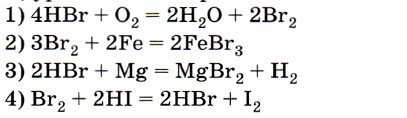
Ответы 2 и 3 из претендентов на верный ответ следует сразу исключить, так как металлы (простые вещества) проявляют только восстановительные свойства. Анализ изменения степени окисления брома для первого уравнения (от -1 до 0) позволяет сделать вывод, что этот ответ является верным. Ответ: 1.
5. Азот в аммиаке проявляет восстановительные свойства в реакции, уравнение которой
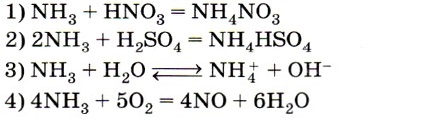
Следует знать, что в аммиаке и ионе аммония азот имеет одинаковую степень окисления -3, поэтому из числа возможных верных ответов исключаются ответы 1,2 и 3. В ответе 4 азот повышает свою степень окисления с -3 в аммиаке до +2 в оксиде азота (II). Ответ: 4.
6. Схеме превращения  соответствует схема
соответствует схема
реакции
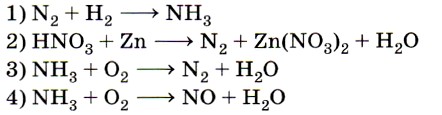
Отправной точкой для нахождения верного ответа служит 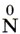 в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
7. Изменению степени окисления
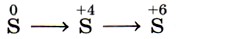
соответствует схема превращений

Так как во всех четырёх вариантах первое звено представлено простым веществом — серой, все они соответствуют первому звену искомой схемы. Следовательно, анализируются вторые звенья на предмет нахождения соединений серы в степени окисления +4. Это варианты 1 и 4. Третье звено (сера в степени окисления +6) содержится в варианте 4. Это и есть верный ответ. Ответ: 4.
Возможный равноценный вариант поиска верного ответа мог быть основан на определении последних звеньев, в которых записаны соединения серы в степени окисления +6. Это варианты ответов 2 и 4. Анализ вторых звеньев данных вариантов на предмет нахождения соединений серы в степени окисления +4 также позволяет определить верный ответ. Ответ: 4.
8. Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).
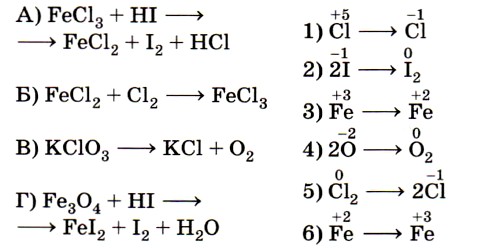
Ключевыми словами для выполнения этого задания являются «изменение степени окисления окислителя», т. е. элемента, понижающего значение степени окисления. Это позволит исключить из правого столбика процессы с участием восстановителей (отдачи электронов) — 2, 4 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степени окисления окислителей. Схеме А, в которой степень окисления железа +3, соответствует процесс 3; схеме Б, в которой хлор имеет степень окисления 0, соответствует процесс 5; схеме В, в которой хлор имеет степень окисления +5, соответствует процесс 1.
Некоторые сложности вызовет схема Г, так как железо в железной окалине (Fe3O4) имеет два значения степени окисления: +2 и +3 (FeO • Fe2O3) и именно железо в степени окисления +3 является окислителем (соответствие Г — 3). Ответ: 3513.
9. Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).

Ключевыми словами для выполнения этого задания являются «изменение степени окисления восстановителя», т. е. элемента, отдающего электроны и соответственно повышающего свою степень окисления. Это позволит исключить из правого столбика процессы с участием окислителей (принятия электронов)— 1, 5 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степеней окисления восстановителей. Схеме А, в которой степень окисления иода 0, соответствует процесс 2; схеме Б, в которой азот катиона аммония имеет степень окисления -3, соответствует процесс 3.
Некоторые сложности вызовут схемы В и Г, так как это реакции диспропорционирования, в которых один и тот же элемент выступает как в роли окислителя, так и в роли восстановителя. Однако выполнение этого задания ограничено рамками его условия. Для схемы В из двух вариантов происходящих изменений степени окисления иода выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие В— 2). Аналогично для схемы Г из двух вариантов происходящих изменений степени окисления азота выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие Г —4). Ответ: 2324.
10. Установите соответствие между схемой превращения элемента (левый столбец) и уравнением ОВР (правый столбец).
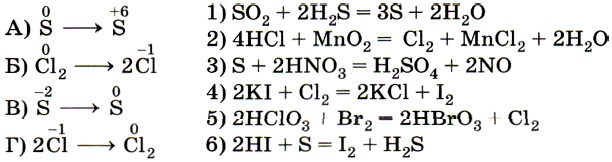
Превращению А в качестве продуктов реакции соответствуют соединения серы в форме сульфат-иона 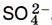 . Следовательно, этому превращению соответствует уравнение 3.
. Следовательно, этому превращению соответствует уравнение 3.
Превращению Б в качестве продуктов реакции соответствуют соединения хлора в форме хлорид-иона — Сl-. Следовательно, этому превращению соответствует уравнение 4.
Легко установить соответствие В — 1, так как свободная сера указана только в одном из приведённых уравнений.
Аналогично устанавливается соответствие Г — 2, так как хлор в степени окисления -1 указан в левой части только одного из приведённых уравнений. Ответ: 3412.

1. Не является окислительно-восстановительной реакция, схема которой
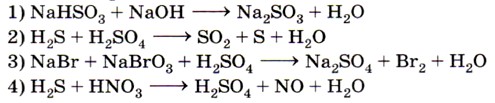
2. Только восстановительные свойства проявляет вещество, формула которого
1)SO2 2) НСl 3)Н2 4) Na2S
3. Только окислительные свойства проявляет вещество, формула которого
1)I2 2) F2 3)Н2 4)N2
4. Соляная кислота выполняет роль восстановителя в реакции, уравнение которой
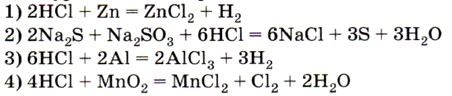
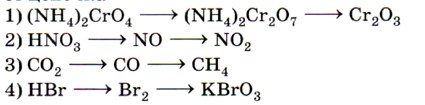
5. Процессу последовательного восстановления соответствует цепочка
6. Пероксид водорода проявляет окислительные свойства в реакции, схема которой
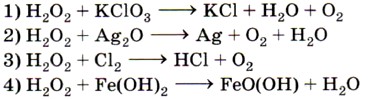
7. Установите соответствие между формулой вещества (левый столбец) и степенью окисления фосфора в нём (правый столбец).
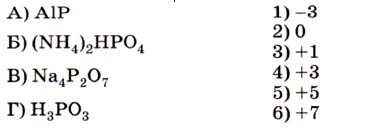
8. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).
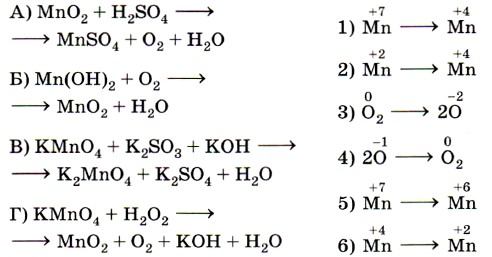
9. Установите соответствие между изменением степени окисления хлора (левый столбец) и схемой реакции (правый столбец).
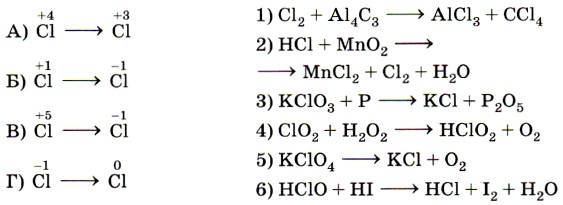
10. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).
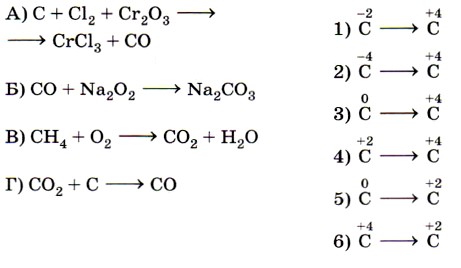
Окислительно-восстановительные реакции. Ответы
Источник

Ответ
Ответ дан
Аккаунт удален
Сl2 проявляет только окислительные свойства