Какие элементы содержатся в космосе
Космохи́мия или Хими́ческая космоло́гия — область химии, наука о химическом составе космических тел, законах распространённости и распределения химических элементов во Вселенной, процессах сочетания и миграции атомов при образовании космического вещества. Космохимия исследует преимущественно «холодные» процессы на уровне атомно-молекулярных взаимодействий веществ, в то время как «горячими» ядерными процессами в космосе — плазменным состоянием вещества, нуклеосинтезом (процессом образования химических элементов) внутри звёзд занимается физика. Развитие космонавтики открыло перед космохимией новые возможности. Это непосредственное исследование пород Луны в результате забора образцов грунта. Автоматические спускаемые аппараты сделали возможным изучение вещества и условий его существования в атмосфере и на поверхности других планет Солнечной системы и астероидов, в кометах. В межзвёздном пространстве обнаруживаются в крайне малых концентрациях атомы и молекулы многих элементов, а также минералы (кварц, силикаты, графит и другие) и, наконец, идёт синтез различных сложных органических соединений из первичных солнечных газов Н2, CO, NH3, O2, N2, S и других простых соединений в равновесных условиях при участии излучений.
История космохимии[править | править код]
Становление и развитие космохимии прежде всего связаны с трудами В. М. Гольдшмидта, Г. Юри, А. П. Виноградова. Гольдшмидт впервые сформулировал (1924—1932) закономерности распределения элементов в метеоритном веществе и нашёл основные принципы распределения элементов в фазах метеоритов (силикатной, сульфидной, металлической). Юри (1952) показал возможность интерпретации данных по химическому составу планет на основе представлений об их «холодном» происхождении из пылевой компоненты протопланетного облака. Виноградов (1959) обосновал концепцию выплавления и дегазации вещества планет земной группы как основного механизма дифференциации вещества планет и формирования их наружных оболочек — коры, атмосферы и гидросферы. До второй половины XX века исследования химических процессов в космическом пространстве и состава космических тел осуществлялись в основном путём спектрального анализа вещества Солнца, звёзд, отчасти внешних слоёв атмосферы планет. Единственным прямым методом изучения космических тел был анализ химического и фазового состава метеоритов. Развитие космонавтики открыло новые возможности непосредственного изучения внеземного вещества. Это привело к фундаментальным открытиям: установлению широкого распространения пород базальтового состава на поверхности Луны, Венеры, Марса; определению состава атмосфер Венеры и Марса; выяснению определяющей роли ударных процессов в формировании структурных и химических особенностей поверхности планет и образовании реголита и др.
Задачи космохимии[править | править код]
Одна из важнейших задач космохимии — изучение на основе состава и распространённости химических элементов эволюции космических тел, стремление объяснить на химической основе их происхождение и историю. Наибольшее внимание в космохимии уделяется проблемам распространённости и распределения химических элементов. Распространённость химических элементов в космосе определяется нуклеосинтезом внутри звёзд. Химический состав Солнца, планет земного типа Солнечной системы и метеоритов, по-видимому, практически тождествен. Образование ядер химических элементов связано с различными ядерными процессами в звёздах. Поэтому на разных этапах своей эволюции различные звёзды и звёздные системы имеют неодинаковый химический состав. Известны звёзды с особенно сильными спектральными линиями Ва или Mg или Li и др.
С развитием астрофизики и некоторых других наук расширились возможности получения информации, относящейся к космохимии. Так, поиски молекул в межзвёздной среде ведутся посредством методов радиоастрономии. К концу 1972 в межзвёздном пространстве обнаружено более 20 видов молекул, в том числе несколько довольно сложных органических молекул, содержащих до 7 атомов. Установлено, что наблюдаемые концентрации их в 10—100 млн раз меньше, чем концентрация водорода. Эти методы позволяют также посредством сравнения радиолиний изотопных разновидностей одной молекулы (например, H212CO и H213CO) исследовать изотопный состав межзвёздного газа и проверять правильность существующих теорий происхождения химических элементов.
Исключительное значение для познания химии космоса имеет изучение сложного многостадийного процесса конденсации вещества низкотемпературной плазмы, например перехода солнечного вещества в твёрдое вещество планет Солнечной системы, астероидов, метеоритов, сопровождающегося конденсационным ростом, аккрецией (увеличением массы, «нарастанием» любого вещества путём добавления частиц извне, например из газопылевого облака) и агломерацией первичных агрегатов (фаз) при одновременной потере летучих веществ в вакууме космического пространства. В космическом вакууме, при относительно низких температурах (5000—10000 °С), из остывающей плазмы последовательно выпадают твёрдые фазы разного химического состава (в зависимости от температуры), характеризующиеся различными энергиями связи, окислительными потенциалами и т. п. Например, в хондритах различают силикатную, металлическую, сульфидную, хромитную, фосфидную, карбидную и другие фазы, которые агломерируются в какой-то момент их истории в каменный метеорит и, вероятно, подобным же образом и в вещество планет земного типа.
См. также[править | править код]
- Межзвёздные молекулы
Литература[править | править код]
- [www.xumuk.ru/encyklopedia/2140.html Космохимия — Химическая энциклопедия]
- Космохимия — Большая Советская Энциклопедия
- А. П. Виноградов (ред.), Космохимия Луны и планет. — М.: Наука, 1975. — 764 с.
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
Источник
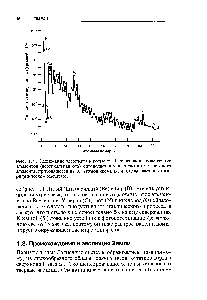
| Рис. 1.1. Содержание элементов в космосе. Относительное содержание элементов (вертикальная ось) определяется как число атомов каждого элемента, приходящееся на 10 атомов кремния, и откладывается в логарифмическом масштабе. |  |
Из данных, которыми мы сейчас располагаем, видно, что самый распространенный элемент в космосе — водород, который составляет основную массу вещества звезд, космических лучей и некоторых планет. Второе место занимает гелий, которого в среднем в десять раз меньше, чем водорода. После гелия на кривой наблюдается резкий спад, соответствующий распространенности изотопов лития, бериллия и бора. Среднее суммарное содержание этих элементов в солнечной системе в 10 раз меньше, чем водорода, и в 300 раз меньше, чем кальция. После этого провала кривая средней распространенности поднимается вверх распространенность изотопов углерода, азота, кислорода и других элементов только в 10 —Ю раз меньше распространенности водорода. Наибольшей распространенностью обладают изотопы С , и О , затем распространенность изотопов медленно уменьшается по мере увеличения их массовых чисел вплоть до скандия, содержание которого очень мало и приближается к содержанию бериллия. После скандия кривая еще раз очень круто поднимается вверх и достигает максимума для железа и соседних с ним элементов. [c.88]
Водород является одним из наиболее распространенных в природе элементов. Содержание его в литосфере, атмосфере и гидросфере составляет 17% (ат.). В свободном состоянии он встречается очень редко (вулканические и природные газы). Водород входит в состав воды, угля, нефти, природного газа и многих других минеральных и органических веществ, а также практически во все животные организмы и растения. Он самый распространенный элемент космоса. Половину массы Солнца и большинства звезд составляет водород. Юпитер и Сатурн в основном состоят из водорода. [c.18]
Распространение в природе. Водород — наиболее распространенный элемент в космосе (звезды, межзвездная среда, туманности, большие планеты — Юпитер, Сатурн), в состав космической материи входит 63 % Н, 36 % Не и 1 % остальных элементов. На Земле водород встречает(у1 главным образом в химически связанном виде (вода, живые организмы, нефть, уголь, минералы) в составе стратосферы имеется частично ионизированный свободный водород. В земной коре до глубины 17 км содержание водорода составляет [c.263]
Данные о содержании химических элементов в земной коре и в космосе приведены в табл. 5 и 6. [c.28]
Водород широко распространен в природе. Содержание его в земной коре (атмосфера, литосфера и гидросфера) составляет 17 ат. о. Он входит в состав воды, глин, каменного и бурого угля, нефти и т. д., а также во все животные и растительные организмы. В свободном состоянии водород встречается крайне редко (в вулканических и других природных газах). Водород — самый распространенный элемент космоса он составляет до половины массы Солнца и большинства звезд. Гигантские планеты солнечной системы Юпитер и Сатурн в основном состоят из водорода. Он присутствует в атмосфере ряда планет, в кометах, газовых туманностях и межзвездном газе. [c.288]
Содержание химических элементов на Земле и в космосе [c.200]
Распространенность элементов зависит как от устойчивости ядер их атомов, так и от возможности протекания процессов их образования. Учитывая преобладающее содержание в космосе водорода, естественно предположить, что основной термоядерной реакцией, с которой начинается синтез ядер других элементов, является слияние ядер в ядра Не + при 10—20 млн градусов. Процесс этот многостадийный, он протекает с образованием промежуточных продуктов ядер D+, Не+ — и с испусканием позитронов и фотонов. Его суммарный результат может быть представлен уравнением [c.266]
В первый раздел входят статьи, содержащие общую оценку открытия Менделеева в статьях второго раздела освещается история открытия периодического закона и системы Менделеева статьи, вошедшие в третий раздел, посвящены выяснению физического содержания периодического закона 1 ак с точки зрения физических взглядов на строение материи, так и в смысле характеристики его как общего закона природы (земли и космоса) в четвёртом разделе помещены статьи, в которых анализируются химические понятия, связанные с периодическим законом, в частности понятие химического элемента статьи последнего, пятого раздела освещают общие вопросы мировоззрения Менделеева в связи с сто учением о периодическом законе. [c.5]
Сильным сродством к сере обладают халькофильные, а сильным сродством к кислороду — литофильные элементы. Сидерофильные элементы, судя по структуре, стабильны в металлической фазе (гл. 3, разд. 5), и сродство к сере у них больше, чем к кислороду (табл. 5.11 и 5.12). Предполагается, что относительный элементный состав первичной атмосферы был близок к составу космоса. Основным фактором, определяющим относительное распространение элементов в космосе, является скорость ядерных реакций тот факт, что содержание серы составляет около 1/200 от содержания кислорода, связан с невыгодностью образования атомных ядер серы (16 протонов). Если бы в первичной атмосфере было много серы, то сидерофильные элементы с большой вероятностью превратились бы в сульфиды, и поэтому имеется глубокая связь между си-дерофильными и халькофильными элементами. [c.302]
Определение относительного содержания элементов и исиользо-вание полученных данных для нахождения относительного содержания элементов в космосе. [c.119]
Содержание гелня на Земле невелико, однако он очень распространен в космосе (занимает второе место после водорода). Впервые этот элемент был обнаружен на Солнце методом спектрального анализа, что обусловило его название гелий (от греч. helios — Солнце). [c.106]
Г.-один из наиб, распространенных элементов космоса-занимает второе место после водорода. Содержание Г. в атмосфере (образуется в результате а-распада Ас, ТЪ, U) 5,27-10″ % по объему. Запасы Г. в атмосфере, литосфере и гидросфере оцениваются в 5-10 м Гелионос-ные прир. газы содержат, как правило, до 2% по объему Г. главные пром. месторождения этих газов находятся в США (2,1-10 м Г.), СССР, Канаде (10 ЮАР. Гелий содержится также в минералах клевеите, монаците, юрианите (до 10,5 л/кг). [c.513]
КЛАРКИ ХИМИЧЕСКИХ ЭЛЕМЁНТОВ, числа, выражающие среднее содержание элементов в литосфере, земном ядре, Земле в целом, атмосфере, гидросфере, живых организмах, породах Луны, атмосфере Солнца, звезд и т.д. Различают К. х. э. массовые (в %, г/т и др.) и атомные (в % от числа атомов). Для литосферы и океана К. х. э. установлены на основе вычисления среднего из анализов мн. тысяч образцов горных пород вод. По А.А. Беусу (1981), 12 главных кларков (в % по массе) в литосфере (без осадочной оболочки) О 46,1, Si 26,7, А1 8,1, Ре 6,0, М 3,0, Мп 0,09, Са 5,0, Ка 2,3, К 1,6, Ti 0,6, Р 0,09, Н 0,11, прочие 0,3. В земном ядре преобладают Ре (ок. 80%) и N1 (ок. 8%) в Земле в целом (на осиове разл. допущений) – Ре (35%), О (30%), Si (15%), М (13%) в космосе-Н и Не. Элементы с кларками менее 0,01-0,001% наз. редкими, если при этом они обладают слабой способностью к концентрации – редкими рассеянш.1ми, налр. кларки и и Вг в литосфере соотв. равны 2,5-10 и 2,1 10″ %, но и-редкий элемент (известно 104 минерала, содержащих Ц), а Вг-редкий рассеянный (известен лишь один его собственный минерал). При анализе величин атомных К. х. э. выявляется еще большее преобладание кислорода и др. легких элементов. По закону Кларка-Вернадского (о всеобщем рассеянии хим. элементов), в любом объекте прир. системы находятся все известные на Земле элементы. [c.399]
Согласно основному геохим. закону (В. Гольдшмидт), К. X. э. зависят от строения атомного ядра, а распределение элементов, связанное с их миграцией, – от строения электронных оболочек, определяющих хим. св-ва атомов. Однако это верно только для космоса в целом. Миградая элементов также зависит от кларков, к-рые во многом определяют содержание элементов в р-рах, расплавах, их способность к минералообразованию, осаждению. [c.399]
Все Э. X. образовались в результате многообразных сложных процессов ядерного синтеза в звездах и космич. пространстве. Эти процессы описываются разл. теориями происхождения Э. X., к-рые объясняют особенности распространенности Э. X. в космосе. Наиб, распространены в космосе водород и гелий, а в целом распространенность элементов уменьшается по мере роста 2. Такая жЬ тенденция сохраняется и для распространенности Э. х. на Земле, однако на Земле наиб, распространен кислород (47% от массы земной коры), далее следуют кремний (27,6%), алюминий (8,8%), железо (4,65%). Эти элементы вместе с кальцием, натрием, калием и магнием составляют более 99% массы земной коры, так что на долю остальных Э. х. приходится менее 1% (см. Кларки химических элементов). Практич. доступность Э. х.. определяется не только величинои их распространенности, но и способностью концентрироваться в ходе геохим. процессов. Нек-рые Э.х. не образзтот собств. минералов, а присугствуют в виде примесей в минералах других. Они наз. рассеянными (рубидий, галлий, гафний и др.). Э. х., содержание к-рых в земной коре менее 10 -10 %, объединяются понятием редких (см. Редкие элементы). [c.472]
Количественные соотношения между отдельными элементами различны в зависимости от возраста космического объекта. Например, по современным оценкам в космосе илн горячих звездах содержание ге- ия в 3000 раз больше, чем кремния. В то же время в земных условиях содержание кремния в 60000 раз больше, чем гелия. В будущем не- 1.1бежны изменения элементного состава земной коры, особенно ее глубинных слоев. [c.25]
Если не принимать во внимание незначительный по объему массообмен с космосом и радиоактивный распад, то можно сказать, что общее количество на Земле атомов каждого элемента постоянно, а следовательно, и конечно . В то же время совершенствуюпщеся вот уже несколько миллиардов лет на земной поверхности процессы вовлекают в различные преобразования вещества земной коры огромные массы всех элементов, причем именно циркуляция элементов, замкнутость их глобальных циклов позволяют природе превращать их конечное содержание в бесконечное. [c.29]
Лантан и лантаноиды встречаются в различных космических телах. Они обнаружены на Солнце, в атмосфере некоторых звезд, в метеоритах. Интересно оценить их космическую распространенность, разумеется, в условных единицах. Если принять распространенность атомов кремния равной 10 , то распространенности отдельных редкоземельных элементов будут колебаться в интервале от 10 до 0,1 иными словами, в первом приближении кремния в космосе в среднем в 1 млн. раз больше, чем всех лантаноидов, вместе взятых. Известны отдельные звезды, где содержание редкоземельных элементов особенно велико это характерно для многих звезд спектрального класса 8 и так называемых магнитонеременных звезд. С другой стороны, редкоземельные элементы составляют единственную большую группу, которая не подвергалась сколЬ либо значительному фракционированию в процессе эволюции Земли. Можно поэтому думать, что их относительная распространенность с известным приближением отражает характер их первоначальной распространенности. Говоря иначе, ход кривых земного и космического содержания лантаноидов должен быть примерно однотипен. Поэтому, изучая относительное содержание изотопов в земной коре, с одной стороны, и исследуя в лабораторных усло- [c.205]
В. широко распространен в природе, он входит в состав воды, глин, каменного и бурого угля, нефти, природных газов, а такн е всех растительных и животных организмов. Содержание В. в земной коре (литосфера и гидросфера) составляет 1 вес.%, или 16 ат. %, в морской воде 10,72 вес.%. В свободном состоянии В. встречается крайне редко, в небольших количествах содержится в вулкапич. и других природных газах. Благодаря этим газам свободный В. присутствует в количестве менее 10 ат.% в атмосфере. В космосе В. является самым распространенным элементом. Он составляет до половины массы Солнца и большинства звезд, присутствует в атмосфере ряда планет, в кометах, газовых туманностях и межзве.зд-ном газе (в виде Нз, СН , NHg, СН, NH, ОН, SiH, РН, MgH, NaH и т. д., а в звездах в виде плазмы). [c.310]
В случае подобия ранних эпох Марса и Земли гипотетическая марсианская микрофлора должна состоять из таких химических радикалов, как — С — С—, —С — N—, —О — Р = ит. д. Возможно, что сложность таких радикалов для Марса и Земли различается. Обнаружение углерода и его соединений в космосе позволяет надеяться хга то, что па Марсе содержание органических веществ достаточно высокое и что именно углероду принадлежит ведущая роль в возмоншой биологии Марса. Данные об отсутствии углерода на Марсе или его крайне низких количествах достоверно будут указывать на отсутствие на этой планете живых систем, подобных земным, т. е. даст неопровержимые доказательства того, что Марс находится иля на первых этапах химической эволющш, или что основой его организмов является какой-либо другой элемент. [c.102]
Наиболее распространенными на поверхности Земли элементами являются кислород, кремний, алюминий и железо (соответственно 46,5, 28, 8 и 5%)- На долю кальция, натрия, калия, магния, титана и водорода приходится лишь несколько процентов (на долю водорода — 0,2%) (Pauling, 1947). Теоретически в состав живой материи могли бы входить 88 элементов (если исключить весьма редкие и искусственные). Однако в живых организмах найдено всего 68 из них. Основными элементами живой природы являются водород, углерод, азот и кислород они составляют 96—99% веса мягких тканей. Обычно в живых организмах содержатся элементы с низким атомным весом исключение составляет йод (атомный вес 127). По относительному содержанию (распространенности) элементов биологические ткани более сходны с космосом, чем с литосферой. Связано это с высоким содержанием воды в живых организмах. Водород входит в состав почти всех биохимических соединений, а углерод уникален в том отношении, что он образует большее число таких соединений, чем все прочие элементы вместе взятые (Asimov, 1962 Needham, 1965). [c.91]
Спектральный анализ излучения Солнца и звезд, а также другие наблюдения показали, что распределение элементов во Вселенной и на Земле (включая океаны, атмосферу) резко различно во Вселенной преобладают легчайшие газы — водород и гелий (—99%), а все остальные элементы составляют небольшую долю (—1%) общей массы в звездах, планетарных туманностях, межзвездном газе [14]. Относительная распространенность атомов инертных газов в космосе характеризуется следующими данными [15] 51—1 Не —3,08-10 Ме — 8,6 Аг — 0,15 Кг — 5,13-10″ Хе — 4-10 . На Земле (включая океаны, атмосферу) это соотношение, по данным Андерсона [16], выглядит так 5i —1 Не —2,16-10- Ме — 2,68-10″ Аг — 3,78 10″ Кг — 2,45 10 1° Хе — 2,39 10″ Если сопоставить приведенные данные о распространении атомов инертных газов в космосе и на Земле, то можно убедиться, что не только в отношении гелия, но и в отношении неона и аргона Земля по сравнению с космосом бедна их содержанием. [c.9]
Введение в химию окружающей среды (1999) — [
c.16
]
Источник
