Какие общие физические свойства металлов
Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.

Положение в таблице Менделеева
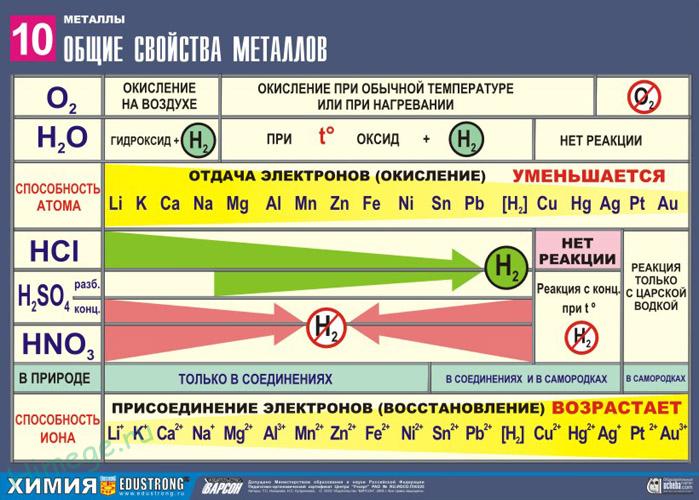
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
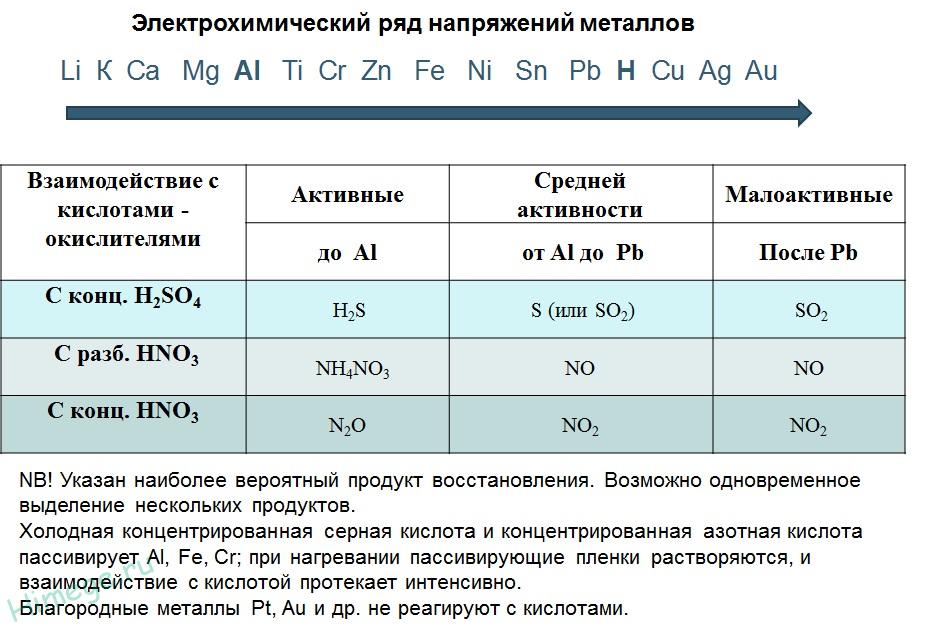
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.

Рис. 1. Электрохимический ряд напряжений металлов.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
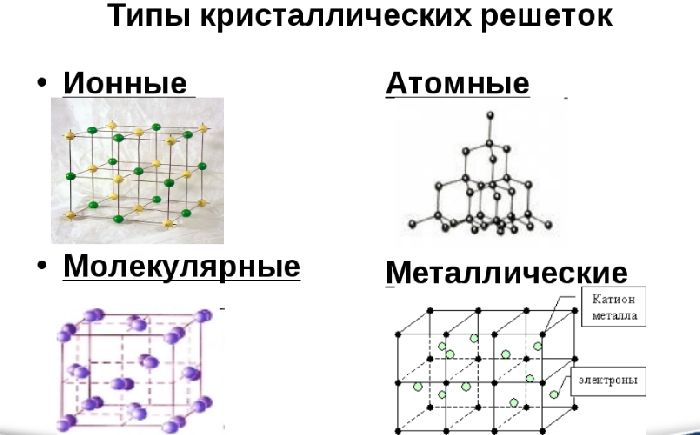
Рис. 2. Виды кристаллических решёток.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства | Особенности | Примеры | Применение |
Металлический блеск | Способность отражать солнечный свет | Наиболее блестящими металлами являются Hg, Ag, Pd | Изготовление зеркал |
Плотность | Лёгкие – имеют плотность меньше 5 г/см3 | Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см3 | Изготовление облицовки, деталей самолётов |
Тяжёлые – имеют плотность больше 5 г/см3 | Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см3 | Использование в сплавах | |
Пластичность | Способность изменять форму без разрушений (можно раскатать в тонкую фольгу) | Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn | Формовка, сгибание труб, изготовление проволоки |
Твёрдость | Мягкие – режутся ножом | Na, K, In | Изготовление мыла, стекла, удобрений |
Твёрдые – сравнимы по твёрдости с алмазом | Самый твёрдый – хром, режет стекло | Изготовление несущих конструкций | |
Температура плавления | Легкоплавкие – температура плавления ниже 1000°С | Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C) | Производство радиотехники, жести |
Тугоплавкие – температура плавления выше 1000°С | Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С) | Изготовление ламп накаливания | |
Теплопроводность | Способность передавать тепло другим телам | Лучше всего проводят ток и тепло Ag, Cu, Au, Al | Приготовление пищи в металлической посуде |
Электропроводность | Способность проводить электрический ток за счёт свободных электронов | Передача электричества по проводам |
Рис. 3. Примеры применения металлов.
Что мы узнали?
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Тест по теме
Оценка доклада
Средняя оценка: 4.2. Всего получено оценок: 129.
Источник
Общие физические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
2. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4

В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Источник
Общие физические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. РЕАКЦИИ МЕТАЛЛОВ С НЕМЕТАЛЛАМИ
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
2. РЕАКЦИИ МЕТАЛЛОВ С КИСЛОТАМИ
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. ВЫТЕСНЕНИЕ БОЛЕЕ АКТИВНЫМИ МЕТАЛЛАМИ МЕНЕЕ АКТИВНЫХ МЕТАЛЛОВ ИЗ РАСТВОРОВ ИХ СОЛЕЙ:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
ОПРЕДЕЛЕНИЕ
Неметаллы – химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают как неметаллы.
Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Большее число электронов на внешнем энергетическом уровне по сравнению с металлами определяет их большую способность к присоединению электронов и проявлению высокой окислительной активности.
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Неметаллы обладают высокими значениями сродства к электрону , электроотрицательность и окислительно-восстановительный потенциал.
Химические свойства неметаллов
Основные химические свойства неметаллов (общие для всех) – это:
— взаимодействие с металлами
2Na + Cl2 = 2NaCl
Fe + S = FeS
6Li + N2 = 2Li3N
2Ca + O2 = 2CaO
— взаимодействие с другими неметаллами
3H2+ N2 = 2NH3
H2+ Br2 = 2HBr
S + O2 = SO2
4P + 5O2 = 2P2O5
2F2+ O2 = 2OF2
S + 3F2 = SF6,
C + 2Cl2 = CCl4
Каждый неметалл обладает специфическими химическими свойствами, характерными только для него, которые подробно рассматривают при изучении каждого неметалла в отдельности.
Физические свойства неметаллов
Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость.
Неметаллы находятся в земной коре (в большинстве своем кислород и кремний — 76 % от массы земной коры а также As, Se, I, Te, но в очень езначительных количествах), в воздухе (азот и кислород), в составе растительной массы (98,5 % — углерод, водород, кислород, сера, фосфор и азот), а также в основе массы человека (97,6 % — — углерод, водород, кислород, сера, фосфор и азот). Водород и гелий – входят в состав космических объектов, включая Солнце. Чаще всего в природе неметаллы встречаются в виде соединений.
Источник
