Какие общие физические свойства металлов поясните эти свойства
Анонимный вопрос
3 апреля 2018 · 16,9 K
Свойства металлов делятся на несколько групп: физические, химические, механические и технологические.
1) Физические свойства: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность.
2) Химические свойства: окисляемость, растворимость и коррозионная стойкость.
3) Механические свойства: прочность, твердость, упругость, пластичность.
4) Технологические свойства: прокаливаемость, жидкотекучесть, ковкость, обрабатываемость резанием.
Слишком примитивно, кое-что неверно, что-то устарело (терминология). Не советую использовать.
Какие металлы относятся к драгоценным?
Engineer – programmer ⚡⚡ Разбираюсь в компьютерах, технике, электронике, интернете и… · zen.yandex.ru/gruber
Драгоценные металлы — это металлы, чья стоимость существенно выше стоимости других металлов из-за сложности их добычи или малого количества.
К драгоценным металлам относятся следующие:
- Золото;
- Серебро;
- Платина;
- Палладий.
- Иридий
- Родий;
- Осмий;
- Рутений.
Прочитать ещё 3 ответа
Как на практике используют пластичность металлов?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Пластичность металов – это одно из самых важных свойств, благодаря которому металлы, стли и сплавы получили такой широкое распространение в мире. Благодаря этому свойству из металлов и сталей возможно изготовление очень широкого спектра изделий: металлы и стали хорошо куются и штампуются (некоторые как в горячем, так и в холодном виде), металлы отлично загибаются и им можно придать практически любую форму прокаткой (как горячей так и холодной).
Какие нужны условия, чтобы металл заржавел?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Чтобы железо или сталь окислились (заржавели) необходимы условия, которые способствуют возникновению коррозии, а также увеличивали скорость ее протекания. Для коррозии железа достатчно просто находится на открытом воздухе, если добавить к этому повышенную температуру, реагенты (воду, соленую воду и т.д.) скорость коррозии (ржавления) будет увеличена.
Прочитать ещё 1 ответ
Какова твердость стали?
Дорога под названием «потом» ведет в страну под названием «никуда»…
Твердость стали зависит от многих факторов – это и содержание углерода, и наличие других элементов в сплаве (например, хрома, молибдена, никеля, азота), а еще твердость стали зависит от технологии ее создания.
Главный фактор твердости стали – это содержание в ней углерода. Низкоуглеродистые стали, которые содержать от 0,05 до 0,25% углерода, обычно мягкие, тогда как высокоуглеродистые стали, содержащие до 2% углерода, могут быть очень твердыми. Но конечная твердость зависит от режима термической обработки – например, закалка может увеличить твердость углеродистой стали в четыре раза.
Твердость стали можно определять разными методами – Бринелля, Виккерса, Шора, Роквелла. Каждый метод имеет свои особенности: например, по методу Шора твердость определяется по высоте отскока бойка, падающего на твердую поверхность с определнной высоты; а по методам Бринелля, Виккерса и Роквелла в поверхность под нагрузкой вдавливаются стальные или алмазные тела – инденторы (шарики, наконечники. пирамиды – для разных методов свое тело), и по отпечаткам на поверхности определяют твердость.
По методу Ровелла, для измерения твердости стали применяют три шкалы:
A – обозначается HRA, индентор – алмазный конус, диапазон измерений: 60-80 HRA. Применима к высокоуглеродистым легированным инструментальным сталям, а также твердым сплавам.
B – обозначается HRB, индентор – закаленный шарик, диапазон измерений: 35-100 HRB. Это уже стали средней твердости и сплавы цветных металлов.
C – обозначается HRC, индентор – алмазный конус, диапазон измерений: 20-90 HRC. Для сталей средней твердости.
Много теории и общих слов, а теперь приведу пример попроще для понимания, какова бывает твердость стали. Например, ножевых сталей с твердостью свыше 70HRC не существует. А на практике не встречается ножей из стали твердостью свыше 65HRC. Самыми распространенными и прекрасно используемыми являются ножи из дамасской стали с твердостью 56-62HRC.
Прочитать ещё 1 ответ
Сколько неметаллов в периодической системе менделеева?
Водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, германий, мышьяк, селен, бром, криптон, йод, ксенон, астат, радон – всего 22 элемента.
Источник
Общие физические свойства мекталлов:
1) Пластичность – способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду – Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду – Ag, Cu, Al, Fe уменьшается. При нагревании электропроводность уменьшается, т. к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло) ; самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий – литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).
Металлы, имеющие r < 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т. пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
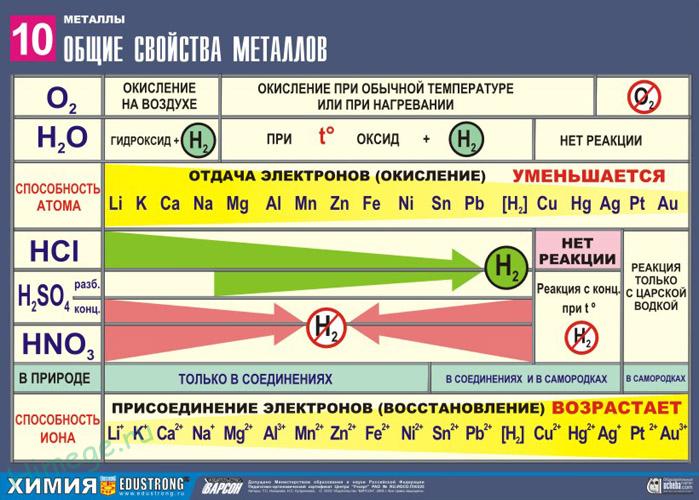
Все металлы являются восстановителями. Для металлов главных подгрупп восстановительная активность (способность отдавать электроны) возрастает сверху вниз и справа налево. Например, Натрий и кальций вытесняют водород из воды уже при обычных условиях:
Ca + 2H2O Ca(OH)2 + H2¬ ; 2Na + 2H2O 2NaOH + H20
А магний при повышении температуры:
Mg + H2O –t MgO + H2
Восстановительная способность и химическая активность элементов побочных подгрупп увеличивается снизу вверх по группе (например, серебро на воздухе окисляется, а золото нет; медь вытесняет серебро из его соли) :
Cu + 2AgNO3 → 2Ag ↓ + Cu(NO3)2
Cu0 -2 ē → Cu+2 1 О. О. В.
Ag+ + ē → Ag0 2 В. В. О.
Высшая положительная степень окисления для металлов главных подгрупп в их соединениях равна номеру группы (например, NaCl, MgCl2, AlCl3, SnCl4), а для металлов побочных подгрупп в их кислородосодержащих соединениях также часто совпадает с номером группы (например, ZnO, TiO2, V2O5, CrO3, KMnO4).
Свойства оксидов металлов слева направо по периоду и снизу вверх по группе изменяются от основных к амфотерным для металлов главных подгрупп (Na2O и MgO – основные оксиды, Al2O3 и BeO – амфотерные) . Для металлов побочных подгрупп свойства оксидов, в которых металлы проявляют свою высшую степень окисления, изменяются от основных через амфотерные к кислотным ( CuO – основной, ZnO – амфотерный, CrO3 – кислотный) .
Сила оснований, образуемых металлами главных подгрупп увеличивается справа налево по периоду и сверху вниз по группе ( Be(OH)2 и Al(OH)3– амфотерные гидроксиды, Mg(OH)2 – слабое основание, NaOHи – Ca(OH)2 сильные основания) . Гидраты оксидов металлов побочных подгрупп с высшими степенями окисления металла вдоль периода слева направо меняют свои свойства от оснований через амфотерные гидроксиды к кислотам ( Cu(OH)2 – основание, Zn(OH)2 – амфотерный гидроксид, H2CrO4 – кислота) .
В природе металлы встречаются в основном в виде соединений – оксидов или солей. Исключение составляют такие малоактивные металлы, как серебро, золото, платина, которые встречаются в самородном состоянии.
Все способы получения металлов основаны на процессах их восстановления из природных соединений.
Источник
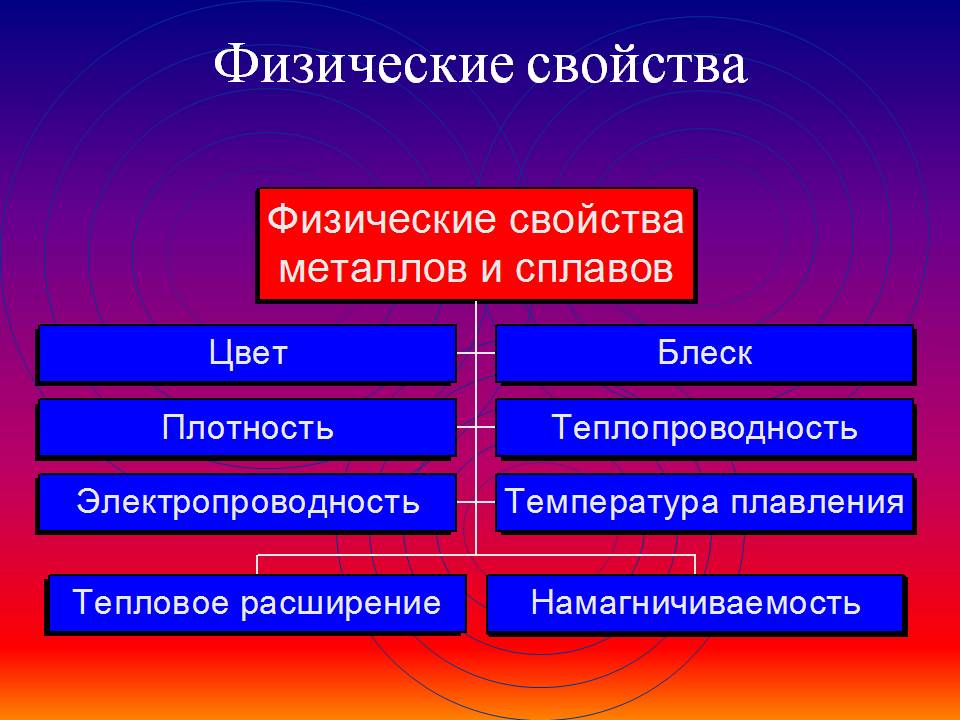
Общие физические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. РЕАКЦИИ МЕТАЛЛОВ С НЕМЕТАЛЛАМИ
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
2. РЕАКЦИИ МЕТАЛЛОВ С КИСЛОТАМИ
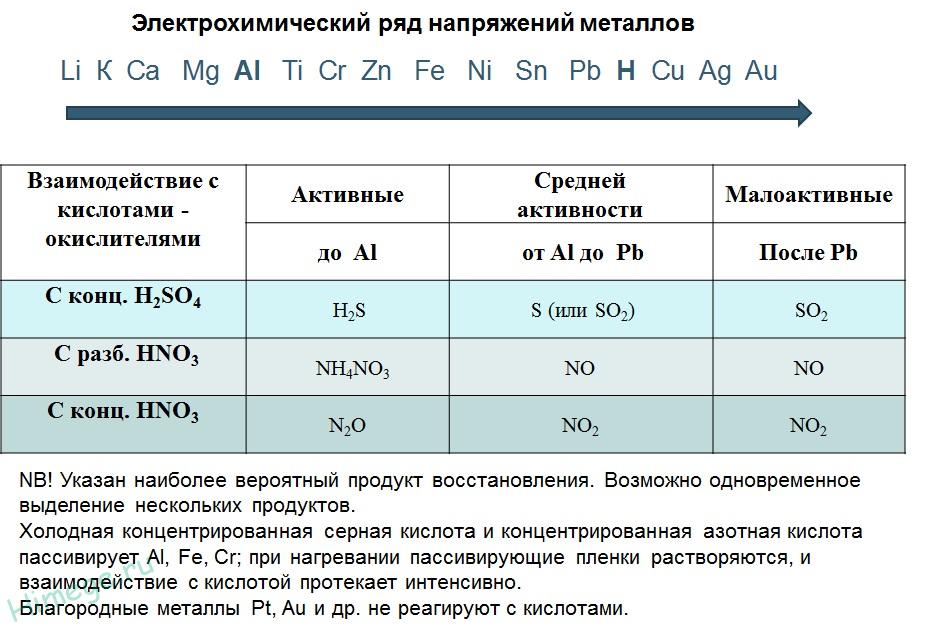
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. ВЫТЕСНЕНИЕ БОЛЕЕ АКТИВНЫМИ МЕТАЛЛАМИ МЕНЕЕ АКТИВНЫХ МЕТАЛЛОВ ИЗ РАСТВОРОВ ИХ СОЛЕЙ:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
ОПРЕДЕЛЕНИЕ
Неметаллы – химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают как неметаллы.
Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Большее число электронов на внешнем энергетическом уровне по сравнению с металлами определяет их большую способность к присоединению электронов и проявлению высокой окислительной активности.
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Неметаллы обладают высокими значениями сродства к электрону , электроотрицательность и окислительно-восстановительный потенциал.
Химические свойства неметаллов
Основные химические свойства неметаллов (общие для всех) – это:
— взаимодействие с металлами
2Na + Cl2 = 2NaCl
Fe + S = FeS
6Li + N2 = 2Li3N
2Ca + O2 = 2CaO
— взаимодействие с другими неметаллами
3H2+ N2 = 2NH3
H2+ Br2 = 2HBr
S + O2 = SO2
4P + 5O2 = 2P2O5
2F2+ O2 = 2OF2
S + 3F2 = SF6,
C + 2Cl2 = CCl4
Каждый неметалл обладает специфическими химическими свойствами, характерными только для него, которые подробно рассматривают при изучении каждого неметалла в отдельности.
Физические свойства неметаллов
Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость.
Неметаллы находятся в земной коре (в большинстве своем кислород и кремний — 76 % от массы земной коры а также As, Se, I, Te, но в очень езначительных количествах), в воздухе (азот и кислород), в составе растительной массы (98,5 % — углерод, водород, кислород, сера, фосфор и азот), а также в основе массы человека (97,6 % — — углерод, водород, кислород, сера, фосфор и азот). Водород и гелий – входят в состав космических объектов, включая Солнце. Чаще всего в природе неметаллы встречаются в виде соединений.
Источник
Общие физические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
2. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4

В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Источник
