Какие общие свойства подгруппы

Общая характеристика подгруппы
В пределах пятой группы главной подгруппы сверху вниз постепенно от атома азота к висмуту усиливаются металлические свойства и ослабевают неметаллические, что связано с увеличением радиуса атома и в связи с этим уменьшением силы притяжения внешних валентных электронов. Азот и фосфор — типичные неметаллы, мышьяк и сурьма неметаллы, но проявляют некоторые металлические свойства, висмут — элемент, обладающий металлическими свойствами (табл. 17).
Элементы этой подгруппы образуют два ряда оксидов, имеющих общие формулы: Э203 и Э205. В этих рядах от азота к висмуту уменьшаются кислотные свойства оксидов и их устойчивость и, соответственно, уменьшаются кислотные свойства и устойчивость их гидроксидов (табл. 18).
Элементы V группы главной подгруппы образуют водородные соединения с общей формулой ЭН3: NH3, РН3, AsH3, SbH3, ВШ3. В этом ряду от азота к висмуту возрастает радиус атома и длина связи Э—Н и, следовательно, уменьшается её прочность. От азота к висмуту уменьшается электроотрицательность элементов и поэтому полярность связи
Э—Н уменьшается. Однако связи Э—Н более прочные, чем у элементов подгруппы кислорода и галогенов и поэтому в водных растворах они не диссоциируют с отщеплением протона, т. е. не проявляют кислотных свойств.
Символ элемента | N | Р | As | Sb | Bi |
Название | Азот | Фосфор | Мышьяк | Сурьма | Висмут |
Порядковый номер | 7 | 15 | 33 | 51 | 83 |
Относительная атомная масса, Аг | 14,00 | 30,97 | 74,92 | 121,75 | 208,98 |
Ковалентный радиус, нм | 0,075 | 0,110 | 0,121 | 0,143 | 0,152 |
Энергия ионизации, кДж/моль | 1402,3 | 1011,7 | 947,0 | 833,7 | 703,2 |
Электронная формула* | ls22s22p3 | [Ne] Ss2Sps | [Ar] 3d104s24p3 | [Кг] 4d105s25p3 | [Xe] 4/145d106s26p3 |
Электроотрицательность | 3,04 | 2,19 | 2,18 | 2,05 | 2,02 |
Возможные степени окисления | -3, -2, -1, 0, +1, +2, +3, +4, +5 | -3, -2, -1, 0, +1, +2, +3, +4, +5 | —3, 0, +3, +5 | —3, 0, +3, +5 | —3, 0, +3, +5 |
Свойства элементов | Неметалл | Неметалл | Неметалл | Металлоподобное вещество | Металл |
* [Ne], [Ar], [Кг], [Xe] — электронные конфигурации неона, аргона, криптона и ксенона.
Свойства оксидов и гидроксидов элементов V группы главной подгруппы
Степень окисления | Кислотные оксиды | Амфотерные оксиды | Основные оксиды | ||
Э+3 | N203 | f*2^3 (Р^б) | -A-SgOg | Sb2Og | Bi203 |
Э+5 | n2o5 | p2o5 | As205 | Sb205 | |
Кислотные свойства и устойчивость оксидов уменьшаются | |||||
с. о. | Кислоты | Амфотерные гидроксиды | Основания | ||
Э+3 | hno2 | H3PO3 | HgAsOg | Sb(OH)g | Ш(ОН)3 |
Э+5 | HNOg | Н3Р04 | H3As04 | В свободном состоянии не выделены | |
Кислотные свойства и устойчивость гидроксидов уменьшаются | |||||
W Азот и его соединения ^
Азот открыт английским химиком Даниелем Резерфордом в 1772 г. Имеет химический знак N (читается «эн»). Наибольшая часть азота находится в воздухе в свободном состоянии и составляет 78,1% по объёму. В связанном состоянии содержится в составе некоторых минералов: индийской (KN03), чилийской (NaN03) и норвежской (Ca(N03)2) селитр и аммиаке. Азот входит в состав всех живых организмов, его много в составе белков, аминокислот, аминов и нуклеиновых кислот. Он встречается и в космосе: входит в состав комет, газовых туманностей и атмосферы Солнца.
Атом азота имеет следующее строение внешнего энергетического уровня:
Степени окисления атома азота
Степень окисления | Соединения азота | Степень окисления | Соединения азота |
-3 | NH3, NH4C1 | +2 | NO |
-2 | n2h4 | +3 | n2o3, kno2,hno2 |
-1 | nh2oh | +4 | no2 |
+1 | n2o | +5 | n2o5, hno3 |
За счёт трёх неспаренных электронов атом азота может образовывать три ковалентные связи. Кроме этого, за счёт свободной электронной пары он может образовывать ещё одну связь по донорно-акцепторному механизму с атомом, имеющим свободную орбиталь. При образовании химических связей в различных молекулах атом азота может проявлять различные степени окисления (с. о.) (табл. 19).
Наиболее распространены степени окисления -3 (при этом атом азота притягивает при образовании связей три электрона от наименее электроотрицательных атомов, например, в NH3), +3 (в тех случаях, когда атом азота отдаёт 3 электрона более электроотрицательным атомам, например, в HN02) и +5 (азот отдаёт более электроотрицательным атомам все пять электронов, например в HN03).
ПРОСТОЕ ВЕЩЕСТВО (N2)
Строение
Как уже отмечалось, атом азота на внешнем энергетическом уровне имеет три неспаренных р-электрона, которые располагаются на jo-орбиталях. Они лежат перпендикулярно друг другу и имеют форму равноплечей восьмёрки (рис. 21, а).
При образовании молекулы азота (N2) р^-орбиталь одного атома перекрывается с рх-орбиталью другого атома. Область перекрывания орбиталей имеет повышенную электронную плотность, что приводит к образованию ковалентной связи. Химическая связь, в которой область перекрывания орбиталей лежит на линии, связывающей центры атомов, называется о (сигма)-связью. Две другие ру- и р2-орбитали одного атома перекрываются боковыми поверхностями с аналогичными орбиталями другого атома, при этом образуются две тг-связи. д-Связь это ковалентная связь, возникающая при перекрывании орбиталей по обе стороны от линии, связывающей центры атомов (рис. 21,6, в). Таким образом, в молекуле азота имеется одна о- и две тс-связи, т. е. возникает тройная связь (N=N). Вследствие этого молекула азота очень прочная, обладает низкой реакционной способностью, устойчива даже при температуре 3000 °С, энергия её диссоциации 940 кДж/моль.
Свойства
Молекулярный азот — газ без цвета и запаха, плохо растворим в воде, лучше растворим в органических растворителях.
Рис. 21. Строение молекулы азота: а — расположение электронных орбиталей в атоме азота; б — перекрывание электронных облаков в молекуле азота; в — образование л-связи
При нагревании, в присутствии катализаторов или под воздействием ионизирующего облучения азот вступает в реакции со многими металлами и неметаллами. Во всех реакциях азот выступает как окислитель, лишь с кислородом и фтором как восстановитель. При обычных условиях азот взаимодействует лишь с литием:
С остальными металлами в реакцию азот вступает при нагревании:
При нагревании до 500 °С, высоком давлении и в присутствии катализатора (Fe) азот вступает в реакцию с водородом:
При температуре электрической дуги реагирует с кислородом, а при 1000 °С с бором и кремнием:
Получение
Получают азот сжижением воздуха с последующим отделением путём испарения. Среди лабораторных способов необходимо отметить разложение нитрита аммония и восстановление азотной кислоты активными металлами:
Азот используется для получения аммиака, для создания инертной атмосферы в различных производствах, как наполнитель электрических ламп.
Источник
В предыдущих главах мы познакомились лишь с самыми основны* ми свойствами элементов и их соединений. Совершенно очевидно, что запомнить колоссальный объем фактического материала по свойствам всех веществ совершенно невозможно и, конечно, не нужно. Гораздо важнее представлять себе основные тенденции в изменении свойств и понимать причины, их определяющие.
Изучение химии, как и любой другой науки, не должно ограничиваться простым запоминанием фактов. Нужно научиться, используя минимальный фактический материал и периодический закон, получать общую картину химических свойств элементов и соединений.
Вспомните предсказания свойств экаалюминия и экакремния, сделанные Д И. Менделеевым. Понимание и использование периодического закона позволяет многое сказать о свойствах практически любых соединений на основании небольшого набора известных фактов.
При изложении фактического материала неорганической химии мы старались показать Вам, что причины изменения свойств элементов определяются изменениями в строении электронных оболочек их атомов, а тенденции изменений свойств определяются периодическим законом.
В гл. 3 мы говорили о том, почему монотонное увеличение заряда ядра приводит к периодичности в электронном строении атомов и таких их свойств, как энергия ионизации или электроотрицательность. Теперь имеет смысл еще раз вернуться к периодическому закону и с позиций изменения электронного строения атомов обсудить тенденции в изменении уже специфических химических свойств – устойчивости соединений, окислительной (восстановительной) способности, кислотных (основных) свойств и т. д.
Говоря об электронном строении атомов, мы по-прежнему будем основываться на одноэлектронном приближении, т. е. считать, что на любой данный электрон воздействует только центрально-симметричное поле, образуемое эффективным зарядом. Эффективный заряд есть некоторая усредненная по специальным правилам величина, слагающаяся из заряда ядра и заряда всех остальных электронов.
Величина 2Эф, действующего на данный конкретный электрон, зависит от пространственного распределения электронной плотности не только данного, но и всех остальных, прежде всего остовных, электронов. Одним из важных факторов, определяющих поведение внешних валентных электронов, является наличие внутренних максимумов в радиальном распределении их электронной плотности. Все эти вопросы подробно обсуждались в гл. 3, которую необходимо перечесть, прежде чем двигаться дальше.
Обсуждая тенденции изменений химических свойств элементов главных подрули в зависимости от электронного строения их атомов, мы будем считать, что, кроме, конечно, числа валентных электронов, химические свойства атомов определяются:
- 1) характером углового и радиального распределения электронной плотности валентных электронов, т. е. их квантовыми числами /иш; отсюда обозначения s-элементы, р-элементы ит.д.;
- 2) размерами электронного облака валентных электронов, т. е. их квантовым числом п и Z^p ;
- 3) энергией связи валентных электронов с ядром, т. е. опять-таки п и Z3ф [см. уравнение (3.2)]. Как уже было показано, Z^ определяется зарядом ядра и общим числом электронов. Задав /, например, рассматривая p-элементы, мы можем обсуждать либо влияние на химические свойства при постоянном л, но тогда число валентных электронов (в нейтральных атомах) будет меняться, либо влияние Z^ при постоянном числе электронов, но тогда п будет переменным.
Связывая обсуждение свойств с периодической системой, можно сказать, что, сохраняя постоянство л, мы обсуждаем свойства элементов одного периода, а сохраняя постоянным число электронов – свойства элементов одной группы. Обычно химики так и говорят: рассмотрим свойства s- и p-элементов третьего периода или рассмотрим свойства p-элементов пятой группы.
Источник

ЗНАЕТЕ ЛИ ВЫ?
Главная подгруппа четвертой группы периодической системы включает в себя типические элементы (углерод С, кремний Si) и элементы подгруппы германия (германий Ge, олово Sn, свинец Pb).
Элементы подгруппы углерода имеют четыре валентных электрона. Общая электронная формула ns2np2. Углерод и кремний имеют предвнешнюю электронную оболочку соответствующих благородных газов: 1s2 и 2s22p6. Элементы подгруппы германия на предвнешней оболочке содержат 18 электронов. Все основные характеристики атомов элементов подгруппы углерода приведены в таблице.
Общая характеристика углерода.
Это элемент IV группы второго периода. Электронное строение атома 1s22s22p2. На валентном уровне число электронов совпадает с числом орбиталей и это приводит к тому, что в соединениях с ковалентным характером связи атом углерода стремится быть четырехвалентным, образуя четыре ковалентных связи по обменному механизму. Это могут быть и s-, и p-связи, которые весьма прочны, как и у всех элементов II периода. У углерода нет предпочтения ни к тем, ни к другим.
У углерода не высокая и не низкая ЭО, поэтому для него весьма характерно образование прочных гомоатомных связей. Эти связи прочны еще и потому, что они короткие и не дестабилизируются межэлектронным расталкиванием, как, например, у кислорода или азота. Отсюда – огромное разнообразие органических соединений.
Согласно электронному строению атома углерода, степени окисления его лежат в интервале от –4 до +4, и в этом диапазоне для углерода возможны все степени окисления, причем в одном и том же соединении могут быть атомы углерода в разных степенях окисления. Соединения углерода весьма разнообразны, особенно если учесть органические соединения. У углерода, подобно азоту, невозможно выделить самую устойчивую степень окисления.
Простые вещества.
По содержанию в земной коре (0,14 ат.%) углерод уступает многим элементам. Тем не менее, углерод – главная составная часть животного и растительного мира. Он входит в состав каменного угля, нефти, природных газов, а также многих минералов: мел, мрамор, известняк CaCO3, доломит CaCO3 · MgCO3, магнезит MgCO3, сидерит FeCO3, малахит (CuOH)2CO3 и др. В виде углекислого газа присутствует в воздухе.
Аллотропия углерода. В свободном состоянии в природе углерод встречается в виде четырех простых веществ различного строения – графита, алмаза (структуры которых представлены на рис.1), карбина и фуллерена.
Рис.1 Кристаллические структуры алмаза (а) и графита (б)
Алмаз– бесцветное, прозрачное вещество с плотностью 3,5 г/см3. Он сильно преломляет лучи, не электропроводен, хрупок, плохо проводит тепло, является самым твердым из минералов. За счет sp3 – гибридизации каждый атом в алмазе образует четыре равноценные и прочные ковалентные σ- связи с соседними атомами углерода, что объясняет высочайшую твердость и отсутствие электропроводности в обычных условиях.
Графит – мягкое слоистое кристаллическое вещество с гексагональной структурой, серовато-черного цвета, мягкий, жирный на ощупь, с плотностью 2,2 г/см3. Легко царапается ногтем и при трении оставляет черные полосы на бумаге. Хорошо проводит тепло и электрический ток, не пропускает свет, подобно металлам, отражая его своей поверхностью. Атомы углерода в графите расположены в вершинах правильных шестиугольников, расположенных в параллельных слоях. Расстояние между соседними слоями (93,4 Аº) больше, чем расстояние между атомами углерода в плоскости (1,415 Аº), вследствие чего связь между атомами в слоях гораздо прочнее, чем связь между атомами в различных слоях. sp2 – гибридное состояние «слоевых» атомов стабилизируется делокализованной π-связью, образованной оставшимися валентными электронами.
Карбин – черный мелкокристаллический порошок с плотностью 1,9 – 2 г/см3, обладает полупроводниковыми свойствами (ΔЕ ≈ 1 эВ). Под действием света его полупроводниковые свойства значительно возрастают. Решетка карбина гексагональная, построена из прямолинейных цепочек Сn двух типов – различают α-карбин (−С ≡ С−С ≡ С−) и β-карбин (=С=С=С=С=).
Фуллерены – эта аллотропная модификация углерода обнаружена в конце ХХ в. Шарообразные С60 или дынеобразные С70 полые молекулы, поверхность которых состоит из пяти- и шестиугольников из атомов углерода
Кремний. По распространенности на Земле кремний (20 ат.%) уступает только кислороду, но содержится в основном в виде кислородных соединений. Земная кора более чем на половину состоит из кремнезема SiO2, силикатных и алюмосиликатных пород.
В связи с тем, что наиболее характерным типом гибридизации валентных орбиталей атома кремния является sp3-гибридизация, то наиболее устойчивой будет алмазоподобная (кубическая) модификация. Она тугоплавка, отличается высокой твердостью, но уступает по этим свойствам алмазу. Из-за частичной делокализации связи эта модификация имеет темно-серый цвет и металлический вид. При комнатной температуре кремний – полупроводник (ΔЕ ≈ 1,12 эВ).
Гексагональная (графитоподобная) модификация кремния неустойчива.
В парах углерод и кремний содержат двухатомные молекулы, которые при охлаждении разрушаются и переходят в твердую фазу с алмазоподобной структурой.
Германий – тугоплавкое твердое вещество серебристо-белого цвета, по внешнему виду очень похож на металл, но имеет алмазоподобную решетку, поэтому очень хрупкий. Германий обладает высоким удельным сопротивлением, которое уменьшается при увеличении температуры.
Олово проявляет полиморфизм. Выше температуры 13,2ºС устойчивой является β- модификация, так называемое «белое» олово (плотность 7,3 г/см3) – серебристо-белый блестящий легкоплавкий металл тетрагональной структуры с октаэдрической координацией атомов. При охлаждении ниже 13,2ºС белое олово переходит в α-модификацию (серое олово) со структурой типа алмаза (ρ = 5,8 г/см3). Этот переход сопровождается увеличением удельного объема на 25,6 %, поэтому олово рассыпается в порошок. При нагревании белого олова выше 161ºС образуется третья модификация олова – γ-форма.
Свинец– темно-серый металл с синеватым оттенком, блести на свежем срезе, легкоплавкий, очень мягкий, ковкий и пластичный. Имеет типичную для металлов структуру гранецентрированного куба.
Некоторые свойства простых веществ приведены в таблице.
Таким образом, закономерное изменение в строении простых веществ, проявляется в изменении их физических свойств – в ряду Ge – Sn – Pb усиливаются металлические свойства простых веществ.
| С, алмаз | Si | Ge | Β-Sn, (к.ч. = 6) | Pb, (к.ч. = 12) | |
| Плотность, г/см3 | 3,51 | 2,3 | 5,3 | 7,2 | 11,34 |
| Т.пл., ºС | 3500 (р) | ||||
| Т.кип., ºС | – | ||||
| ΔЕ, эВ | 5,6 | 1,12 | 0,78 | металлы | |
| dЭЭ, Аº | 1,54 | 2,34 | 2,44 | 3,16 | 3,50 |
| ΔНº 298 (возг.), кДж/моль | |||||
| Твердость (по алмазу) | – | – |
Источник
Главная подгруппа VII группы
Элементы, входящие в VII группу периодической системы, делятся на 2 подгруппы: главную – подгруппу галогенов – и побочную – подгруппу марганца. В эту же группу помещают и водород, хотя его атом имеет на внешнем валентном, уровне единственный электрон и его следовало бы поместить в I группу.
9F 1s22s22p5
17Cl [Ne] 3s23p5
35Br [Ar] 3d104s24p5
53I [Kr] 4d105s25p5
85At [Xe] 4f145d106s26p5
5 элементов главной подгруппы VII группы имеют общее групповое название «галогены» (Hal), что означает «солерождающие».
В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат – радиоактивный элемент, изучен мало). Это р-элементы группы периодической системы Д.И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5. Этим объясняется общность их свойств.
Свойства | F | Cl | Br | I | At |
1. Порядковый номер | 9 | 17 | 35 | 53 | 85 |
2. Валентные электроны | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 | 6s26p5 |
3. Энергия ионизации атома, эВ | 17,42 | 12,97 | 11,84 | 10,45 | 9,2 |
4. Относительная электроотрицательность | 4,1 | 2,83 | 2,74 | 2,21 | 1,90 |
5. Степень окисления в соединениях | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
6. Радиус атома, нм | 0.064 | 0,099 | 0,114 | 0,133 | – |
Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами.
Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления : +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением, которое у атомов фтора можно представить схемой
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-подуровень. У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а степень окисления всегда -1.
Электронное строение атома хлора выражается схемой:
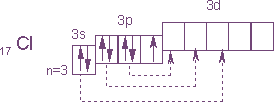
У атома хлора один неспаренный электрон на 3р-подуровне и обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеется еще пять орбиталей 3 -подуровня, в которых могут разместиться 10 электронов.
В возбужденном состоянии атома хлора электроны переходят с 3p – и 3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся в одной орбитали, увеличивает валентность на две единицы. Очевидно, хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1, 3, 5, 7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора и соединений.
Водные растворы водородных соединений галогенов являются кислотами: НF – фтороводородная (плавиковая), НСl – хлороводородная (соляная), НВr – бромводородная, НI – йодоводородная.
Простые вещества – неметаллы F2(газ), Cl2(газ), Вг2(ж), l2(тв.).
При образовании ковалентных связей галогены чаще всего используют один неспаренный р-электрон, имеющийся в невозбужденном атоме, проявляя при этом В = I.
Образуя связи с атомами более электроотрицательных элементов, атомы хлора, брома и йода могут переходить из основного валентного состояния в возбужденные, что сопровождается переходом электронов на вакантные орбитали d-подуровня. При этом число неспаренных электронов увеличивается, вследствие чего атомы CI, Br, I могут образовывать большее число ковалентных связей:
Возбужденные состояния | Число неспаренных e- | Валентность | |
1-е | ns2np4nd1 | 3 | III |
2-е | ns2np3nd2 | 5 | V |
3-е | ns1np3nd3 | 7 | VII |
В атоме F валентные электроны находятся на 2-м энергетическом уровне, имеющем только s- и р- подуровни. Это исключает возможность перехода атомов F в возбужденные состояния, поэтому фтор во всех соединениях проявляет постоянную В, равную I. Кроме того, фтор – самый электроотрицательный элемент, вследствие чего имеет и постоянную с. о. -1.
I. Галогеноводороды HHal.
II Галогениды металлов (соли галогеноводородных кислот) – самые многочисленные и устойчивые соединения галогенов
III. Галогенорганические соединения
IV. Кислородсодержащие вещества:
– неустойчивые оксиды, из которых достоверным можно считать существование 6 оксидов (Cl2O, ClO2, Cl2O7, Вr2O, ВrO2, I2O5);
– неустойчивые оксокислоты, из которых только 3 кислоты выделены как индивидуальные вещества (НСlO4, НlO3, НlO4);
– соли оксокислот, главным образом хлориты, хлораты и перхлораты.
Источник
