Какие орбитали содержатся в атоме углерода
Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода.

Атом углерода
Положение углерода в периодической таблице Менделеева:
- шестой порядковый номер;
- четвёртая группа;
- второй период.
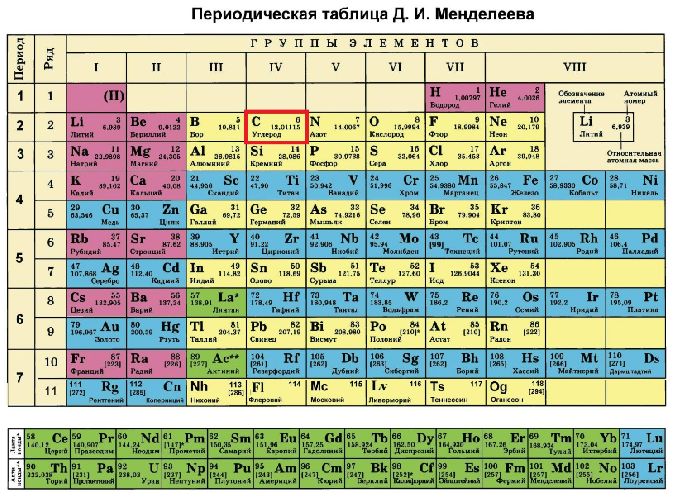
Рис. 1. Положение углерода в таблице Менделеева.
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s22s22p2.
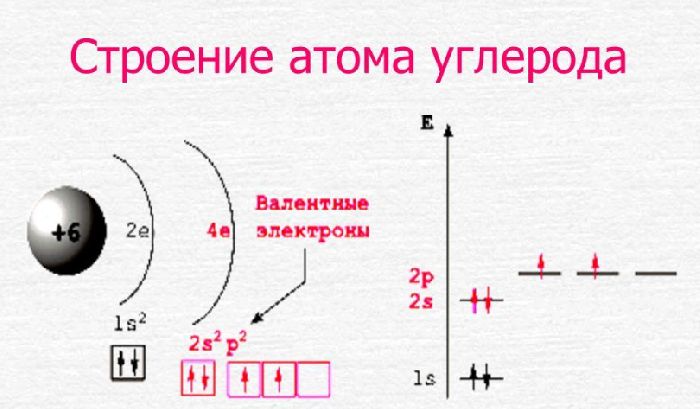
Рис. 2. Строение атома углерода.
Физические свойства
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карбин;
- уголь;
- сажа.
Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
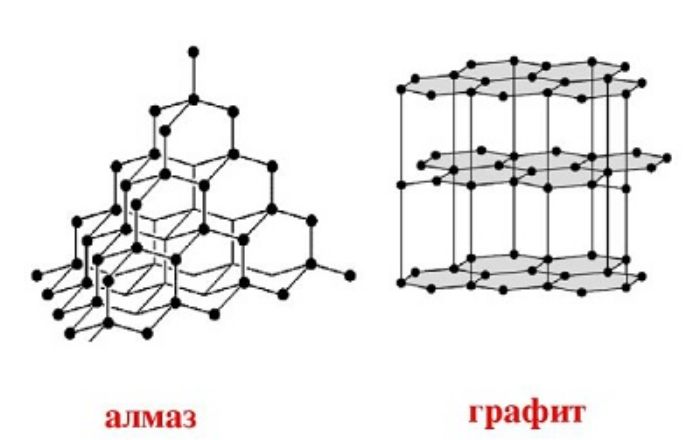
Рис. 3. Кристаллические решётки графита и алмаза.
Химические свойства
Атомное строение углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами, образуя карбиды:
- Са + 2С → СаС2;
- Cr + C → CrC;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С + 2Н2 → СН4.
С кислородом углерод образует углекислый газ и угарный газ:
- С + О2 → СО2;
- 2С + О2 → 2СО.
Угарный газ также образуется при взаимодействии с водой:
C + H2O → CO + H2.
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
- 2H2SO4 + C → CO2 + 2SO2 + 2H2O;
- 4HNO3 + C → CO2 + 4NO2 + 2H2O.
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод – типичный неметалл с шестью электронами на s- и р-орбиталях. В активном состоянии приобретает валентность IV и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.
Тест по теме
Оценка доклада
Средняя оценка: 4.1. Всего получено оценок: 270.
Источник
Характеристика атома углерода по положению в периодической системе
Рассмотрение особенностей строения атома углерода и его электронного состояния является основополагающим для правильного понимания теории химического строения. Рассмотрим сначала положение углерода в периодической системе (ПС). Для удобства характеристики элемента по ПС можно использовать следующий алгоритм:
Порядковый номер элемента (№) определяет его заряд ядра (зарядное число Z), а следовательно, количество протонов N$p^+$ (обозначение протона — $p_1^+$) и общее количество электронов N$bar{e}$ (обозначение электрона — $bar{e}$) в ядре. Для углерода порядковый номер равен 6, следовательно, ядро атома углерода состоит из 6 протонов и 6 электронов. Схематически это рассуждение можно записать следующим образом: №$ (C)=6 Rightarrow Z = 6; hspace{2pt}Nbar{e} = 6$.
Атомная масса элемента, или массовое число изотопа (A) равно сумме масс протонов и нейтронов (обозначение нейтрона — $n_1^0$) в ядре, следовательно, по разности можно вычислить количество нейтронов N. Для углерода атомная масса равна 12 а.е.м., следовательно, количество нейтронов в атоме углерода равно 6. Схематическая запись: $A(C) =12 textrm{а.е.м.} Rightarrow N =A-Z=12-6=6$.
Номер периода, в котором находится элемент в ПС, численно равен главному (радиальному)квантовому числу n и определяет число энергетических уровней в атоме. Иногда встречается другое обозначение главного квантового числа — $n_r$ (по Зоммерфельду). Углерод находится во втором периоде ПС, следовательно, имеет два энергетических уровня, главное квантовое число равно 2. Схематическая запись: № пер. = 2 => n = 2.
Номер группы, в которой расположен элемент в ПС, соответствует числу электронов на внешнем энергетическом уровне. Углерод расположен в IV группе главной подгруппы, следовательно, на внешнем энергетическом уровне у него 4 электрона. Схематическая запись: № гр. = IV => N$bar{e}_textrm{валентных}$ = 4.

Подводя итог, можно сказать, что в основном (невозбужденном) состоянии на внешнем энергетическом уровне атома углерода находятся 4 валентных электрона, при этом s-электроны образуют электронную пару, и 2 р-электрона не спарены.
Для валентного электронного слоя атома углерода главное квантовое число n равно 2, орбитальное квантовое число l равно 0, что соответствует s-орбитали и равно 1 для р-орбиталей; магнитное квантовое число m = –l, 0, +l; то есть m = 0 (при l = 0) и m = –1, 0, 1 (при l = 1).
Определение
Атомной орбиталью (АО) называется графическое трехмерное изображение электронной плотности, то есть область пространства, в которой вероятность нахождения электрона максимальна.
В органических соединениях атом углерода всегда четырехвалентен, это значит, что в образовании химической связи участвуют все 4 валентных электрона. Но в образовании связи участвуют только неспаренные электроны! Чтобы объяснить несоответствие между понятием валентности и электронным строением атома углерода, следует применить модель возбужденного состояния атома углерода $C^*$, допускающая переход электрона с 2s- на 2р-подуровень:

В этом случае энергия, затрачиваемая на переход электрона, компенсируется энергией, высвобождаемой при образовании двух дополнительных связей. Однако такая модель предполагает нахождение электрона на четырех «чистых» орбиталях — одной s и трех р.
Тогда в возбужденной состоянии атома энергия s-орбитали должна быть меньше энергии образования р-орбиталей. На самом деле это не совсем так. Как показывают исследования, энергия всех четырех образующихся в результате «перескока» электрона орбиталей примерно одинаковая, соответственно, и энергии образования связей в молекуле с одинаковыми гетероатомами (например, атомами водорода в метане) тоже примерно равны, причем энергия каждой из вновь образующихся орбиталей больше, чем энергия «чистой» s-орбитали, но меньше, чем энергия «чистой» р-орбитали.

Источник
РАБОЧИЕ ТЕТРАДИ

Продолжение. Начало см. в № 15, 16/2004
Ковалентная химическая связь образуется при
помощи общих связывающих электронных пар по
типу:
Образовывать химическую связь, т.е. создавать
общую электронную пару с «чужим» электроном от
другого атома, могут только неспаренные
электроны. Неспаренные электроны при записи
электронных формул находятся по одному в
клетке-орбитали.
Атомная орбиталь – это функция, которая
описывает плотность электронного облака в
каждой точке пространства вокруг ядра атома.
Электронное облако – это область пространства, в
которой с высокой вероятностью может быть
обнаружен электрон.
Для согласования электронного строения атома
углерода и валентности этого элемента
пользуются представлениями о возбуждении атома
углерода. В нормальном (невозбужденном)
состоянии атом углерода имеет два неспаренных 2р2-электрона.
В возбужденном состоянии (при поглощении
энергии) один из 2s2-электронов может
переходить на свободную р-орбиталь. Тогда в
атоме углерода появляется четыре неспаренных
электрона:
Напомним, что в электронной формуле атома
(например, для углерода 6С – 1s22s22p2)
большие цифры перед буквами – 1, 2 – обозначают
номер энергетического уровня. Буквы s и р
указывают форму электронного облака (орбитали), а
цифры справа над буквами говорят о числе
электронов на данной орбитали. Все s-орбитали
сферические:

На втором энергетическом уровне кроме 2s-орбитали
имеются три 2р-орбитали. Эти 2р-орбитали
имеют эллипсоидную форму, похожую на гантели, и
ориентированы в пространстве под углом 90° друг к
другу. 2р-Орбитали обозначают 2рх, 2рy
и 2рz в соответствии с осями, вдоль
которых эти орбитали расположены.
|
Форма и ориентация |
При образовании химических связей
электронные орбитали приобретают одинаковую
форму. Так, в предельных углеводородах
смешиваются одна s-орбиталь и три р-орбитали
атома углерода с образованием четырех
одинаковых (гибридных) sр3-орбиталей:
![]()
Это – sр3-гибридизация.
Гибридизация – выравнивание
(смешивание) атомных орбиталей (s и р) с
образованием новых атомных орбиталей,
называемых гибридными орбиталями.
 |
Четыре sp3-гибридные орбитали |
Гибридные орбитали имеют
асимметричную форму, вытянутую в сторону
присоединяемого атома. Электронные облака
взаимно отталкиваются и располагаются в
пространстве максимально далеко друг от друга.
При этом оси четырех sр3-гибридных орбиталей
оказываются направленными к вершинам тетраэдра
(правильной треугольной пирамиды).
Соответственно углы между этими орбиталями –
тетраэдрические, равные 109°28′.
Вершины электронных орбиталей могут
перекрываться с орбиталями других атомов. Если
электронные облака перекрываются по линии,
соединяющий центры атомов, то такую ковалентную
связь называют сигма()-связью. Например, в молекуле этана
С2Н6 химическая связь образуется
между двумя атомами углерода перекрыванием двух
гибридных орбиталей. Это -связь. Кроме того, каждый из
атомов углерода своими тремя sр3-орбиталями
перекрывается с s-орбиталями трех атомов
водорода, образуя три -связи.
|
Схема перекрывания электронных |
Всего для атома углерода возможны три
валентных состояния с различным типом
гибридизации. Кроме sр3-гибридизации
существует sр2- и sр-гибридизация.
sр2-Гибридизация – смешивание одной
s– и двух р-орбиталей. В результате
образуются три гибридные sр2-орбитали.
Эти sр2-орбитали расположены в одной
плоскости (с осями х, у) и направлены к
вершинам треугольника с углом между орбиталями
120°. Негибридизованная
р-орбиталь перпендикулярна к плоскости трех
гибридных sр2-орбиталей (ориентирована
вдоль оси z). Верхняя половина р-орбитали
находится над плоскостью, нижняя половина – под
плоскостью.
Тип sр2-гибридизации углерода бывает у
соединений с двойной связью: С=С, С=О, С=N. Причем
только одна из связей между двумя атомами
(например, С=С) может быть -связью. (Другие связывающие
орбитали атома направлены в противоположные
стороны.) Вторая связь образуется в результате
перекрывания негибридных р-орбиталей по обе
стороны от линии, соединяющей ядра атомов.
 |
Орбитали (три sp2 и одна р) |
Ковалентная связь, образующаяся путем
бокового перекрывания р-орбиталей соседних
углеродных атомов, называется пи()-связью.
|
Образование |
Из-за меньшего перекрывании орбиталей -связь менее
прочная, чем -связь.
sр–Гибридизация – это смешивание
(выравнивание по форме и энергии) одной s- и
одной
р-орбиталей с образованием двух гибридных sр-орбиталей.
sр-Орбитали расположены на одной линии (под
углом 180°) и направлены в противоположные стороны
от ядра атома углерода. Две
р-орбитали остаются негибридизованными. Они
размещены взаимно перпендикулярно
направлениям -связей. На рисунке sр-орбитали
показаны вдоль оси y, а негибридизованные две
р-орбитали– вдоль осей х и z.
 |
Атомные орбитали (две sp и две р) |
Тройная углерод-углеродная связь СС состоит из -связи, возникающей
при перекрывании
sp-гибридных орбиталей, и двух -связей.
Взаимосвязь таких параметров атома углерода, как
число присоединенных групп, тип гибридизации и
типы образуемых химических связей, показана в
таблице 4.
Таблица 4
| Число групп, связанных с углеродом | Тип гибридизации | Типы участвующих химических связей | Примеры формул соединений |
|---|---|---|---|
| 4 | sp3 | Четыре – связи |
|
| 3 | sp2 | Три – связи и одна – связь |
|
| 2 | sp | Две – связи и две -связи | H–CC–H |
Упражнения.
1. Какие электроны атомов (например,
углерода или азота) называют неспаренными?
2. Что означает понятие «общие
электронные пары» в соединениях с ковалентной
связью (например, СН4или Н2S)?
3. Какие электронные состояния атомов
(например, С или N) называют основными, а
какие возбужденными?
4. Что означают цифры и буквы в
электронной формуле атома (например, С или N)?
5. Что такое атомная орбиталь? Сколько
орбиталей на втором энергетическом уровне атома С
и чем они различаются?
6. В чем отличие гибридных орбиталей от
исходных орбиталей, из которых они образовались?
7. Какие типы гибридизации известны
для атома углерода и в чем они заключаются?
8. Нарисуйте картинку
пространственного расположения орбиталей для
одного из электронных состояний атома углерода.
9. Какие химические связи
называют
и какие ?
Укажите –
и –связи в
соединениях:

10. Для атомов углерода приведенных
ниже соединений укажите: а) тип гибридизации; б)
типы его химических связей; в) валентные углы.

1. Электроны, которые находятся по
одному на орбитали, называют неспаренными
электронами. Например, в электронографической
формуле возбужденного атома углерода – четыре
неспаренных электрона, а у атома азота – три:

2. Два электрона, участвующие в
образовании одной химической связи, называют общей
электронной парой. Обычно до образования
химической связи один из электронов этой пары
принадлежал одному атому, а другой электрон –
другому атому:

3. Электронное состояние атома, в
котором соблюдается порядок заполнения
электронных орбиталей: 1s2, 2s2, 2p2,
3s2, 3p2, 4s2, 3d2,
4p2 и т.д., называют основным состоянием.
В возбужденном состоянии один из валентных
электронов атома занимает свободную орбиталь с
более высокой энергией, такой переход
сопровождается разъединением спаренных
электронов. Схематически это записывают так:

Тогда как в основном состоянии было только два
валентных неспаренных электрона, то в
возбужденном состоянии таких электронов
становится четыре.
5. Атомная орбиталь – это функция,
которая описывает плотность электронного облака
в каждой точке пространства вокруг ядра данного
атома. На втором энергетическом уровне атома
углерода четыре орбитали – 2s, 2рx, 2рy,
2рz. Эти орбитали различаются:
а) формой электронного облака (s – шар, р –
гантель);
б) р-орбитали имеют разную ориентацию в
пространстве – вдоль взаимно перпендикулярных
осей x, y и z, их обозначают рx, рy,
рz.
6. Гибридные орбитали отличаются от
исходных (негибридных) орбиталей формой и
энергией. Например, s-орбиталь – форма сферы, р
– симметричная восьмерка, sp-гибридная
орбиталь – асимметричная восьмерка.
Различия по энергии: E(s) < E(sр) < E(р).
Таким образом, sp-орбиталь – усредненная по
форме и энергии орбиталь, полученная смешиванием
исходных s-и p-орбиталей.
7. Для атома углерода известны три типа
гибридизации: sp3, sp2 и sp (см.
текст урока 5).
9. -связь
– ковалентная связь, образующаяся путем
лобового перекрывания орбиталей по линии,
соединяющей центры атомов.
-связь –
ковалентная связь, образующаяся путем бокового
перекрывания р-орбиталей по обе стороны от
линии, соединяющей центры атомов.
-Связи
показывают второй и третьей черточкой между
соединенными атомами.

10.

Источник
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
Виды σ-связей
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.

π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь С–С, С–Н, С–О | Двойная связь С=С, С=О | Тройная связь С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Электронная формула атома углерода в основном состоянии:
+6С 1s22s22p2
+6С 1s ![]() 2s
2s ![]() 2p
2p ![]()
В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С* 1s22s12p3
+6С* 1s2 ![]() 2s1
2s1![]() 2p3
2p3
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы.
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp3, sp2 и sp-гибридизация.
sp3-Гибридизация
В sp3-гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp3-гибридные орбитали:


Изображение с портала orgchem.ru
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в состоянии sp3-гибридизации направлены в пространстве под углом 109о 28’ друг к другу, что соответствует тетраэдрическому строению.

Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109о 28’

Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Например, пространственное строение н-бутана

sp2-Гибридизация
В sp2-гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:

Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три sp2-гибридные орбитали атома углерода направлены в пространстве под углом 120одруг к другу, что соответствует плоскому строению (треугольник).

При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp2— орбитали.

Изображение с портала orgchem.ru
Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp2-гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей.

Модель молекулы этилена:

sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:

Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180одруг к другу, что соответствует линейному строению.

Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
Например, молекула ацетилена имеет линейное строение.

Источник





