Какие прилагательные отражают свойства неметаллов
Неметаллы. Физические и химические свойства
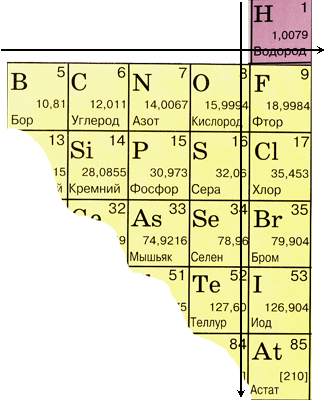
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
- Реакции с кислородом.
Неметаллы образуют кислотные или несолеобразующие оксиды.
S + O2 = SO2
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
В настоящее время открыто 22 неметаллических элемента.
Источник статьи: https://rosuchebnik.ru/material/nemetally/
Физические свойства неметаллов. Характеристика по положению в периодической системе
Все известные на сегодняшний день химические элементы имеют общий “дом” – периодическую систему. Однако располагаются они там не как придется, а в строгом порядке, определенной последовательности. Одним из главных критериев, по которым классифицируются все атомы, являются характеристики.
Физические свойства неметаллов и представителей металлических элементов – это основа, на которой базируется не только их разделение в пределах таблицы, но и области применения человеком. Познакомимся ближе с неметаллами и их характеристикой.
Положение в периодической системе
Если рассмотреть систему химических элементов в целом, то можно определить место положения неметаллов так:
- Верхний правый угол.
- Выше условной граничной диагонали от бора до астата.
- Главные подгруппы с IV-VIII группу.
Очевидно, что количество их явно уступает таковому у металлов. По численному соотношению это будет примерно 25/85. Однако данный факт нисколько не уменьшает их значимости и важности. При этом физические свойства неметаллов гораздо более разнообразные, чем таковые у их “оппонентов”.
Разновидности простых соединений неметаллов
Определяют несколько основных категорий, к которым относятся все известные рассматриваемые элементы. Физические свойства простых веществ – неметаллов – позволяют разделить их на:
При этом есть и особая группа элементов – благородные газы. По своим характеристикам они не относятся ни к одной из обозначенных категорий.
Газообразные неметаллы
Таковых достаточно много. К ним относятся такие простые вещества, как:
- кислород;
- азот;
- галогены хлор и фтор;
- водород;
- белый фосфор;
- озон.
Однако такое возможно при условии стандартных параметров окружающей среды. Кристаллическая решетка этих представителей – молекулярная, тип химической связи в молекулах – ковалентная неполярная. Физические свойства неметаллов этой группы схожи. Они обладают:
- сжимаемостью;
- способностью безграничного смешения между собой;
- расширяемостью;
- заполняют весь объем сосуда.
Среди приведенных веществ ядовитыми являются два – хлор и белый фосфор. Очень опасные, удушающие соединения. При этом хлор – желто-зеленый газ, фосфор – белый, легко воспламеняющийся на воздухе.
Кислород и озон – хорошие окислители. Первый – постоянный компонент воздуха, необходимый для жизни большинства организмов. Второй образуется после грозы при действии электрических разрядов молнии на кислород воздуха. Имеет приятный запах свежести.
Жидкие неметаллы
Физические свойства неметаллов этой группы можно описать, дав характеристику всего лишь одному веществу – брому. Поскольку только он является жидкостью при обычных условиях среди всех представителей рассматриваемой группы элементов.
Это темно-бурая жидкость, достаточно тяжелая, которая является сильнейшим ядом. Даже пары брома способны вызывать сложные, не заживающие долгое время язвы на руках. Запах его очень неприятный, за что элемент и получил свое название (в переводе bromos – зловонный).
По своим химическим характеристикам бром является окислителем для металлов и восстановителем для более сильных неметаллов, чем он сам.
Несмотря на такие особенности, ионы брома обязательно должны присутствовать в организме человека. Без него возникают заболевания, связанные с гормональными нарушениями.
Твердые представители
К простым веществам этой категории относится большинство неметаллов. Это:
- бор;
- все аллотропные модификации углерода;
- красный и черный фосфор;
- сера;
- кремний;
- мышьяк;
- одна из модификаций олова.
Все они имеют атомную кристаллическую решетку, достаточно твердые, но хрупкие вещества. Черный фосфор – жирное на ощупь сухое соединение. Красный же – пастообразная масса.
Самым твердым из всех обозначенных веществ является алмаз – разновидность углерода. Физические и химические свойства неметаллов данной группы очень разные, так как в таблице располагаются некоторые из них далеко друг от друга. Значит, степени окисления, проявляемая химическая активность, характер соединений – все эти показатели будут варьироваться.
Интересным неметаллом в твердом состоянии является йод. Его кристаллы блестят на срезе, проявляя тем самым схожесть с металлами. Это не удивительно, ведь он располагается практически на границе с ними. Также есть у этого вещества особое свойство – сублимация. При нагревании йод переходит в газообразное состояние, минуя жидкое. Пары его имеют ярко-фиолетовую насыщенную окраску.
Физические свойства неметаллов: таблица
Чтобы проще обозначить, что собой представляют неметаллы, лучше выстроить обобщающую таблицу. Она покажет, в чем заключаются общие физические свойства неметаллов, а в чем проявляются их различия.
| Физическое свойство | Пример неметалла |
| Агрегатное состояние при обычных условиях | Характерны все три: твердое (сера, углерод, кремний и прочие), газообразное (например, галогены), жидкое (бром) |
| Электро- и теплопроводность | Не характерна ни для чего, кроме углерода и черного фосфора |
| Окраска простого вещества | Очень разнообразная. Пример: бром – красный, сера – желтая, кристаллы йода – темно-фиолетовые, углерод в виде графита – темно-серый, хлор – желто-зеленый и так далее |
| Металлический блеск | Характерен только для кристаллического йода |
| Ковкость и пластичность | Полностью отсутствует. Все твердые вещества – хрупкие, кроме алмаза и некоторых форм кремния |
Очевидно, что в физических свойствах неметаллов больше преобладают различия, нежели сходства. Если для металлов можно выделить несколько характеристик, под которые будет подпадать каждый из них, то для рассмотренных нами элементов такое невозможно.
Источник статьи: https://fb.ru/article/190591/fizicheskie-svoystva-nemetallov-harakteristika-po-polojeniyu-v-periodicheskoy-sisteme
Источник
Из (118) известных на данный момент химических элементов (22) элемента образуют простые вещества, обладающие неметаллическими свойствами. Неметаллических простых веществ намного больше, чем самих неметаллических химических элементов. Причиной тому служит существование явления, называемого аллотропией.
Аллотропия — это способность атомов данного химического элемента образовывать несколько простых веществ, называемых аллотропными видоизменениями, или аллотропными модификациями.
Например, химический элемент кислород (O) образует простое вещество кислород O2, молекула которого состоит из двух атомов, и простое вещество озон O3, молекула которого состоит из трёх атомов данного элемента.
Химический элемент фосфор (P) образует множество аллотропных видоизменений, важнейшими из которых являются красный фосфор и белый фосфор.
Химический элемент углерод (C) образует встречающиеся в природе модификации — алмаз и графит.
Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Аллотропия присуща не всем неметаллических химическим элементам.
Например, водород, азот, элементы (VII)A и (VIII)A групп не имеют аллотропных модификаций, т. е. каждый из упомянутых элементов образует только одно простое вещество.
Кристаллическая решетка неметаллов
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
Модели кристаллических решёток алмаза (слева) и графита. Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги — в книге
Другая часть неметаллов имеет молекулярную кристаллическую решетку. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому вещества молекулярного строения при обычных условиях могут быть газами, жидкостями или легкоплавкими твёрдыми веществами.
Кислород O2, озон O3, азот N2, водород H2, фтор F2, хлор Cl2, бром Br2, иод I2, белый фосфор P4, кристаллическая сера S8 и инертные газы — это всё вещества, кристаллы которых состоят из отдельных молекул (а в случае инертных газов — из отдельных атомов, как бы выполняющих роль молекул).
Модель молекулы серы (слева) и кристалл серы. Кристалл серы состоит из отдельных молекул (S_8)
Физические свойства неметаллов
Свойства неметаллических простых веществ отличаются большим разнообразием. Собственно говоря, их объединяет только то, что они, как правило, не обладают теми физическими свойствами, которые типичны для металлов, т. е. не обладают характерным металлическим блеском, ковкостью, пластичностью, высокой тепло- и электропроводностью.
Агрегатное состояние
Неметаллы при обычных условиях могут быть газообразными, жидкими и твёрдыми веществами.
Газообразными неметаллами являются гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Такие химические элементы, как водород (H), кислород (O), азот (N), хлор (Cl), фтор (F) образуют газообразные вещества, состоящие из двухатомных молекул, соответственно — H2, O2, N2, Cl2, F2.
Из неметаллических простых веществ при обычных условиях жидкостью является только бром, молекулы которого двухатомны — Br2.
Остальные неметаллические химические элементы при обычных условиях находятся в твёрдом агрегатном состоянии. Например, химический элемент углерод образует такие твёрдые вещества, как алмаз и графит. Твёрдыми являются кристаллическая сера S8, фосфор красный и фосфор белый P4, кристаллический иод I2.
Цвет и блеск
Только некоторые неметаллы в отличие от металлов имеют блеск. Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
Если для подавляющего большинства металлов характерны серебристо-серый или серебристо-белый цвета, то окраска неметаллов очень разнообразна. Белый цвет имеет белый фосфор, красный — красный фосфор, жёлтый — сера и фтор, красно-бурый — жидкий бром, жёлто-зелёный — хлор, фиолетовый цвет имеют пары иода, синий — жидкий кислород, серый — графит и кремний. Бесцветным является алмаз, окраски не имеют также инертные газы, азот, кислород и водород.
Красный фосфор | Белый фосфор |
Бром | Хлор |
Иод | Алмаз |
Неметаллы могут находиться в твёрдом, жидком и газообразном агрегатных состояниях.
Запах
Некоторые неметаллы имеют запах. Например, резкий удушливый запах имеют озон O3, фтор F2 (при попадании в органы дыхания практически моментально разрушает ткани), хлор Cl2, бром Br2 и иод I2.
Пластичность
Неметаллы в твёрдом агрегатном состоянии не обладают пластичностью. Они являются хрупкими.
Электро- и теплопроводность
Неметаллы, за исключением графита, плохо проводят тепло и практически не проводят электрический ток (являются диэлектриками).
Источник
>> Химия: Простые вещества – неметаллы
Неметаллы
– это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов. Из 109 химических элементов 87 относятся к металлам, 22 являются неметаллами.
6. Относительность деления простых веществ на металлы и неметаллы.
Рассмотрите этимологию названий отдельных благородных металлов.
Почему химически неверно поэтическое выражена: «В воздухе пахло грозой»?
Запишите схемы образования молекул: Nа2, Вr2, О2, N2. Каков тип связи в этих молекулах?
Содержание урока
конспект урока
опорный каркас
презентация урока
акселеративные методы
интерактивные технологии
Практика
задачи и упражнения
самопроверка
практикумы, тренинги, кейсы, квесты
домашние задания
дискуссионные вопросы
риторические вопросы от учеников
Иллюстрации
аудио-, видеоклипы и мультимедиа
фотографии, картинки
графики, таблицы, схемы
юмор, анекдоты, приколы, комиксы
притчи, поговорки, кроссворды, цитаты
Дополнения
рефераты
статьи
фишки для любознательных
шпаргалки
учебники основные и дополнительные
словарь терминов
прочие
Совершенствование учебников и уроков
исправление ошибок в учебнике
обновление фрагмента в учебнике
элементы новаторства на уроке
замена устаревших знаний новыми
Только для учителей
идеальные уроки
календарный план на год
методические рекомендации
программы
обсуждения
Интегрированные уроки
― это способность
поляризовать химическую связь, оттягивать к себе общие электронные пары.
К неметаллам относят 22 элемента.
Положение неметаллических
элементов в периодической системе химических элементов
| Группа | I | III | IV | V | VI | VII | VIII |
| 1-й период | Н | He | |||||
| 2-й период | В | С | N | O | F | Ne | |
| 3-й период | Si | P | S | CL | Ar | ||
| 4-й период | As | Se | Br | Kr | |||
| 5-й период | Te | I | Xe | ||||
| 6-й период | At | Rn |
Как видно из таблицы,
неметаллические элементы в основном расположены в правой верхней части
периодической системы.
Строение
атомов неметаллов
Характерной особенностью
неметаллов является большее (по сравнению с металлами) число электронов на
внешнем энергетическом уровне их атомов. Это определяет их большую способность
к присоединению дополнительных электронов и проявлению более высокой
окислительной активности, чем у металлов. Особенно сильные окислительные
свойства, т. е. способность присоединять электроны, проявляют неметаллы,
находящиеся во 2-ом и 3-м периодах VI-VII групп. Если сравнить расположение
электронов по орбиталям в атомах фтора, хлора и других галогенов, то можно
судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет.
Поэтому атомы фтора могут проявить только валентность I и степень окисления ―
1. Самым сильным окислителем является фтор
.
В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне
имеются свободные d-орбитали. Благодаря этому распаривание электронов может
произойти тремя разными путями. В первом случае хлор может проявить степень
окисления +3 и образовать хлористую кислоту HClO 2 , которой
соответствуют соли ― хлориты, например хлорит калия KClO 2 . Во втором
случае хлор может образовать соединения, в которых степень окисления хлора +5.
К таким соединениям относятся хлорноватая кислота HClO 3 и ее соли ―
хлораты, например хлорат калия КClO 3 (бертолетова соль). В третьем
случае хлор проявляет степень окисления +7, например в хлорной кислоте HClO 4
и в ее солях, ― перхлоратах (в перхлорате калия КClO 4).
Строения
молекул неметаллов. Физические свойства неметаллов
В
газообразном состоянии при комнатной температуре находятся:
·
водород
― H 2 ;
·
азот
― N 2 ;
·
кислород
― O 2 ;
·
фтор
― F 2 ;
·
хлор
― CI 2 .
И
инертные газы:
·
гелий
― He;
·
неон
― Ne;
·
аргон
― Ar;
·
криптон
― Kr;
·
ксенон
― Xe;
·
радон
― Rn).
В жидком
― бром ― Br.
В твердом
:
·
теллур
― Te;
·
йод ―
I;
·
астат
― At.
Гораздо богаче у неметаллов и
спектр цветов: красный ― у фосфора, бурый ― у брома, желтый ― у серы,
желто-зеленый ― у хлора, фиолетовый ― у паров йода и т. д.
Самые типичные неметаллы имеют
молекулярное строение, а менее типичные ― немолекулярное. Этим и объясняется
отличие их свойств.
Состав и свойства простых
веществ – неметаллов
Неметаллы образуют как
одноатомные, так и двухатомные молекулы. К одноатомным
неметаллам относятся инертные газы, практически не реагирующие даже с самыми
активными веществами. Инертные газы расположены в VIII группе периодической
системы, а химические формулы соответствующих простых веществ следующие: He,
Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные
молекулы. Это H 2 , F 2 ,
Cl 2 , Br 2 , Cl 2 (элементы VII группы
периодической системы), а также кислород O 2 и азот N 2 . Из
трехатомных
молекул состоит газ озон (O 3).
Для веществ неметаллов, находящихся в твердом состоянии, составить химическую
формулу довольно сложно. Атомы углерода в графите соединены друг с другом
различным образом. Выделить отдельную молекулу в приведенных структурах
затруднительно. При написании химических формул таких веществ, как и в случае с
металлами, вводится допущение, что такие вещества состоят только из атомов.
Химические формулы, при этом, записываются без индексов: C, Si, S и т. д.
Такие простые вещества, как озон и кислород, имеющие одинаковый качественный состав
(оба состоят из одного и того же элемента ― кислорода), но различающиеся по
числу атомов в молекуле, имеют различные свойства. Так, кислород запаха не
имеет, в то время как озон обладает резким запахом, который мы ощущаем во время
грозы. Свойства твердых неметаллов, графита и алмаза, имеющих также одинаковый
качественный состав, но разное строение, резко отличаются (графит хрупкий,
алмаз твердый). Таким образом, свойства вещества определяются не только его
качественным составом, но и тем, сколько атомов содержится в молекуле вещества
и как они связаны между собой. Неметаллы в виде простых тел находятся в твердом
или газообразном состоянии (исключая бром ― жидкость). Они не имеют физических
свойств, присущих металлам. Твердые неметаллы не обладают характерным для
металлов блеском, они обычно хрупки, плохо проводят электрический ток и тепло
(за исключением графита). Кристаллический бор В (как и кристаллический кремний)
обладает очень высокой температурой плавления (2075°С) и большой твердостью.
Электрическая проводимость бора с повышением температуры сильно увеличивается,
что дает возможность широко применять его в полупроводниковой технике. Добавка
бора к стали и к сплавам алюминия, меди, никеля и др. улучшает их механические
свойства. Бориды (соединения бора с некоторыми металлами, например с титаном:
TiB, TiB 2) необходимы при изготовлении деталей реактивных
двигателей, лопаток газовых турбин. Как видно из схемы 1, углерод ― С, кремний
― Si, бор ― В имеют сходное строение и обладают некоторыми общими свойствами.
Как простые вещества они встречаются в двух видоизменениях ― в кристаллическом
и аморфном. Кристаллические видоизменения этих элементов очень твердые, с
высокими температурами плавления. Кристаллический кремний обладает
полупроводниковыми свойствами. Все эти элементы образуют соединения с металлами
― карбиды, силициды и бориды (CaC 2 , Al 4 C 3 , Fe 3 C,
Mg 2 Si, TiB, TiB 2). Некоторые из них обладают большей
твердостью, например Fe 3 C, TiB. Карбид кальция используется для
получения ацетилена.
Неметаллы – это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов
. Из 114 химических элементов 92 относятся к металлам, 22 являются неметаллами.
Неметаллы – простые вещества, при обычных условиях могут быть газами, жидкостями и твёрдыми веществами (рис. 46).
Рис. 46.
Простые вещества – неметаллы
Лабораторный опыт № 6
Ознакомление с коллекцией неметаллов
Ознакомьтесь с коллекцией неметаллов. Запишите химические формулы выданных вам неметаллов, расположите их в порядке возрастания:
- плотности;
- твёрдости;
- блеска;
- интенсивности изменения цвета.
Для выполнения задания используйте приложения 1 и 2, дополнительные источники информации.
Газами являются гелий Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе, радон Rn. Их называют инертными газами. Молекулы инертного газа состоят из одного атома. На внешнем электронном слое у атомов инертных газов (за исключением гелия) восемь электронов. У гелия – два. Своей химической устойчивостью инертные газы напоминают благородные металлы – золото и платину, и у них есть второе название – благородные газы. Это название более подходит к инертным газам, которые всё-таки вступают иногда в химические реакции и образуют соединения. В 1962 г. появилось сообщение о том, что получено соединение ксенона с фтором. Сейчас известно уже более 150 соединений ксенона, криптона, радона с фтором, кислородом, хлором и азотом.
Представление о химической исключительности благородных газов оказалось не очень состоятельным, и потому вместо предполагаемой нулевой группы инертные газы были помещены в VIII группу (VIIIA группу) таблицы Д. И. Менделеева.
Гелием, по легкости уступающим только водороду, но, в отличие от последнего, негорючим, т. е. не представляющим пожарной опасности, заполняют аэростаты и дирижабли (рис. 47).

Рис. 47.
Воздушные шары и дирижабли заполняют гелием
Неон используют для изготовления световой рекламы (рис. 48). Вспомните образное выражение «улицы города были залиты неоном».

Газы водород, кислород, азот, хлор, фтор образуют двухатомные молекулы, соответственно – Н 2 , O 2 , N 2 , Cl 2 , F 2 .
Состав вещества изображают на письме, используя химические знаки и цифры – индексы, с помощью химической формулы. По химической формуле, как вы уже знаете, вычисляют относительную молекулярную массу вещества (Мr). Относительная молекулярная масса простого вещества равна произведению относительной атомной массы на число атомов в молекуле, например кислорода O 2:
Мr(02) = Аr(0) × 2 = 16 × 2 = 32.
Однако элемент кислород образует ещё одно газообразное простое вещество – озон, в состав молекул которого входят уже три атома кислорода. Химическая формула озона 0 3 , а его относительная молекулярная масса: Мr(03) = 16 × 3 = 48.
Свойства аллотропных модификаций химического элемента кислорода – простых веществ кислорода O 2 и озона O 3 – различны. Кислород не имеет запаха, а озон пахнет (отсюда и его название – в переводе с греческого озон означает «пахнущий»). Этот запах, аромат свежести, можно почувствовать во время грозы, так как озон образуется в малых количествах в воздухе в результате электрических разрядов.
Кислород – газ без цвета, а озон имеет бледно-фиолетовый цвет. Озон более бактерициден (лат. цидао – убивать), чем кислород. Поэтому озон применяют для обеззараживания питьевой воды. Озон способен удерживать ультрафиолетовые лучи солнечного спектра, губительные для всего живого на Земле, и потому озоновый слой, располагающийся в атмосфере на высоте 20-35 км, защищает жизнь на нашей планете (на рисунке 49 вы видите фотографию, сделанную из космоса с помощью искусственного спутника Земли, где области пониженного содержания озона в атмосфере («озоновые дыры») обозначены белым цветом).
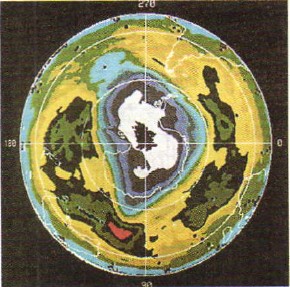
Рис. 49.
«Озоновые дыры» в атмосфере Земли
Из простых веществ – неметаллов при обычных условиях жидкостью является только бром, молекулы которого двухатомны. Формула брома Вr 2 . Это тяжёлая бурая, с неприятным запахом жидкость (отсюда и название, так как бромос с древнегреческого переводится как «зловонный»).
Некоторые твёрдые вещества – неметаллы известны с древнейших времён – это сера и углерод (в форме древесного угля, алмаза и графита).
У твёрдых веществ – неметаллов также наблюдается явление аллотропии. Так, элемент углерод образует такие различные по внешнему виду простые вещества, как алмаз, графит (рис. 50). Причина отличия свойств алмаза и графита состоит в строении кристаллических решёток этих веществ, которые вы рассмотрите несколько позднее.
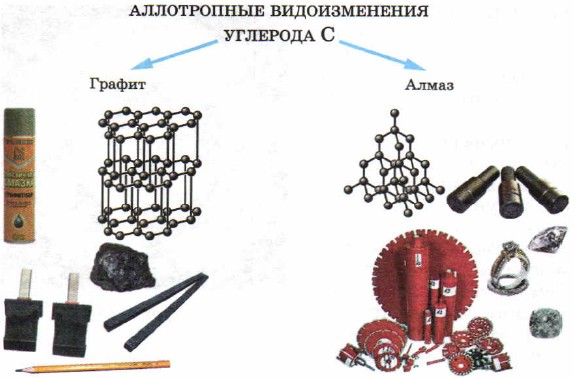
Рис. 50.
Аллотропные видоизменения углерода и области их применения
Элемент фосфор имеет две аллотропные модификации: фосфор красный (им покрывают боковую сторону спичечного коробка) и фосфор белый. Последний имеет четырёхатомную молекулу, состав его отражается формулой Р 4 .
Твёрдым веществом – неметаллом является кристаллический иод с двухатомной молекулой I 2 . Не путайте его со спиртовым раствором иода – йодной настойкой, которая имеется в каждой домашней аптечке.
Кристаллический иод и графит не похожи на остальные простые вещества – неметаллы, они имеют металлический блеск.
Чтобы показать относительность деления простых веществ на основании их физических свойств на металлы и неметаллы, рассмотрим аллотропию химического элемента олова Sn. При комнатной температуре обычно существует бета-олово (β-Sn). Это всем известное белое олово – металл, из которого раньше отливали оловянных солдатиков (рис. 51, а) (вспомните сказку X. К. Андерсена «Стойкий оловянный солдатик»). Оловом покрывают изнутри консервные банки (рис. 51, б). Оно входит в состав такого известного сплава, как бронза, а также припоя (рис. 51, в).

Рис. 51.
Области применения олова:
а – игрушки; б – производство консервных банок; в – припой
При температуре ниже +13,2 °С более устойчиво альфа-олово (α-Sn) – серый мелкокристаллический порошок, имеющий скорее свойства неметалла. Процесс превращения белого олова в серое быстрее всего идёт при температуре, равной -33 °С. Это превращение получило образное название «оловянная чума».
Сравним теперь простые вещества – металлы и неметаллы с помощью таблицы 3.
Таблица 3
Простые вещества

Ключевые слова и словосочетания
- Благородные газы.
- Аллотропия и аллотропные видоизменения, или модификации.
- Кислород и озон.
- Алмаз и графит.
- Фосфор красный и белый.
- Белое и серое олово.
- Относительность деления простых веществ на металлы и неметаллы.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока – сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Рассмотрите этимологию названий отдельных благородных газов.
- Почему химически неверно поэтическое выражение «В воздухе пахло грозой»?
- Запишите схемы образования молекул: Na 2 , Br 2 , O 2 , N 2 . Каков тип химической связи в этих молекулах?
- Какой тип химической связи должен быть в металлическом водороде?
- Экспедиция полярного исследователя Р. Скотта к Южному полюсу в 1912 г. погибла из-за того, что потеряла весь запас горючего: оно находилось в запаянных оловом баках. Какой химический процесс лежал в основе этого?
Лекция
3. Неметаллы
Химических
элементов-неметаллов всего 16, но два из
них, кислород и кремний составляют 76%
от массы земной коры. Неметаллы составляют
98,5 % от массы растений и 97,6 % от массы
человека. Из углерода, водорода, кислорода,
серы, фосфора и азота состоят все
важнейшие органические вещества, они
являются элементами жизни. Водород и
гелий – основные элементы Вселенной
из них состоят все космические объекты,
включая наше Солнце. Без соединений
неметаллов невозможно представить нашу
жизнь, особенно если вспомнить, что
жизненно важное химическое соединение
– вода – состоит из водорода и кислорода.
Неметаллы
– это химические элементы, атомы которых
принимают электроны для завершения
внешнего энергетического уровня, образуя
при этом отрицательно заряженные ионы.
Практически
все неметаллы имеют сравнительно малые
радиусы и большое число электронов на
внешнем энергетическом уровне от 4 до
7, для них характерны высокие значения
электроотрицательности и окислительные
свойства.
1.1. Положение элементов-неметаллов в Периодической системе химических элементов Менделеева
Если
в Периодической системе провести
диагональ от бора к астату, то справа
вверх по диагонали будут находиться
элементы-неметаллы, а слева снизу –
металлы, к ним же относятся элементы
всех побочных подгрупп, лантаноиды и
актиноиды. Элементы, расположенные
вблизи диагонали, например, бериллий,
алюминий, титан, германий, сурьма,
обладают двойственным характером и
относятся к металлоидам. Элементы-неметаллы:
s-элемент – водород; р-элементы 13 группы
– бор; 14 группы – углерод и кремний; 15
группы – азот, фосфор и мышьяк, 16 группы
– кислород, сера, селен и теллур и все
элементы 17 группы – фтор, хлор, бром,
йод и астат. Элементы 18 группы – инертные
газы, занимают особое положение, они
имеют полностью завершенный внешний
электронный слой и занимают промежуточное
положение между металлами и неметаллами.
Их иногда относят к неметаллам, но
формально, по физическим признакам.
1.2. Электронное строение элементов-неметаллов
Практически
все элементы-неметаллы на внешнем
энергетическом уровне имеют большое
число электронов – от 4 до 7. Элемент бор
– аналог алюминия, у него всего 3 электрона
на внешнем энергетическом уровне, но
он имеет малый радиус, прочно удерживает
свои электроны и имеет свойства ?
