Какие признаки характеризуют физические свойства этилена
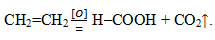
Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp2-гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование
(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
Гидрогалогенирование
— взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
Гидратация
— взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
Окисление
этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот
(катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150 C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров
(полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 февраля 2020; проверки требуют 15 правок.
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином). При нормальных условиях — бесцветный горючий газ легче воздуха со слабым сладковатым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0 °C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.
Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен — самое производимое органическое соединение в мире[1]; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год[2].
Этилен обладает наркотическим действием. Класс опасности — четвёртый[3].
Получение[править | править код]
Этилен стали широко применять в качестве мономера перед Второй мировой войной в связи с необходимостью получения высококачественного изоляционного материала, способного заменить поливинилхлорид. После разработки метода полимеризации этилена под высоким давлением и изучения диэлектрических свойств получаемого полиэтилена началось его производство в мире.
Основным промышленным методом получения этилена является пиролиз жидких дистиллятов нефти или низших насыщенных углеводородов. Реакция проводится в трубчатых печах при +800-950 °С и давлении 0,3 МПа. При использовании в качестве сырья прямогонного бензина выход этилена составляет примерно 30 %. Одновременно с этиленом образуется также значительное количество жидких углеводородов, в том числе и ароматических. При пиролизе газойля выход этилена составляет примерно 15-25 %. Наибольший выход этилена — до 50 % — достигается при использовании в качестве сырья насыщенных углеводородов: этана, пропана и бутана. Их пиролиз проводят в присутствии водяного пара.
При выпуске с производства, при товарно-учётных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб этилена по процедуре, описанной в ГОСТ 24975.0-89 «Этилен и пропилен. Методы отбора проб». Отбор пробы этилена может производиться и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921.
Промышленно получаемый в России этилен должен соответствовать требованиям, изложенным в ГОСТ 25070-2013 «Этилен. Технические условия».
Структура производства[править | править код]
В настоящее время в структуре производства этилена 66
% приходится на крупнотоннажные установки пиролиза, ~17 % — на малотоннажные установки газового пиролиза, ~11 % составляет пиролиз бензина и 8 % падает на пиролиз этана.
Применение[править | править код]
Этилен является ведущим продуктом основного органического синтеза и применяется для получения следующих соединений (перечислены в алфавитном порядке):
- Винилацетат;
- Дихлорэтан / винилхлорид (3-е место, 12 % всего объёма);
- Окись этилена (2-е место, 14—15 % всего объёма);
- Полиэтилен (1-е место, до 60 % всего объёма);
- Стирол;
- Уксусная кислота;
- Дибромметан
- Этилбензол;
- Этиленгликоль;
- Этиловый спирт.
Этилен в смеси с кислородом использовался в медицине для наркоза вплоть до середины 1980-х годов в СССР и на ближнем Востоке. Этилен является фитогормоном практически у всех растений[4], среди прочего[5] отвечает за опадание иголок у хвойных.
Электронное и пространственное строение молекулы[править | править код]
Атомы углерода находятся во втором валентном состоянии (sp2-гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Основные химические свойства[править | править код]
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
- Галогенирование:
Происходит обесцвечивание бромной воды. Это качественная реакция на непредельные соединения.
- Гидрирование:
- Гидрогалогенирование:
- Гидратация:
Эту реакцию открыл A.M. Бутлеров, и она используется для промышленного получения этилового спирта.
- Окисление:
Этилен легко окисляется. Если этилен пропускать через раствор перманганата калия, то он обесцветится. Эта реакция используется для отличия предельных и непредельных соединений. В результате образуется этиленгликоль. Уравнение реакции[6]:
- Горение:
- Полимеризация (получение полиэтилена):
- Димеризация[7]
Биологическая роль[править | править код]
Сигнальный каскад этилена у растений. Этилен легко проникает сквозь клеточную мембрану и связывается с рецепторами, расположенными на эндоплазматическом ретикулуме. Рецепторы после активации высвобождают связанный EIN2. Это активирует каскад передачи сигнала, который приводит к активации экспрессии определённых генов и в конечном итоге к включению специфического ответа на этилен у данного растения в данной фазе созревания. Активированные участки ДНК считываются в мРНК, которая, в свою очередь, в рибосомах считывается в функционирующий белок фермента, который катализирует биосинтез этилена, тем самым продукция этилена в ответ на изначальный этиленовый же сигнал повышается до определённого уровня, запуская каскад реакций созревания растения.
Этилен — первый из обнаруженных газообразных растительных гормонов, обладающий очень широким спектром биологических эффектов[8]. Этилен выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов)[9], распускание бутонов (процесс цветения), старение и опадание листьев и цветков. Этилен называют также гормоном стресса, так как он участвует в реакции растений на биотический и абиотический стресс, и синтез его в органах растений усиливается в ответ на разного рода повреждения. Кроме того, являясь летучим газообразным веществом, этилен осуществляет быструю коммуникацию между разными органами растений и между растениями в популяции, что важно, в частности, при развитии стресс-устойчивости[10].
К числу наиболее известных функций этилена относится развитие так называемого тройного ответа у этиолированных (выращенных в темноте) проростков при обработке этим гормоном. Тройной ответ включает в себя три реакции: укорочение и утолщение гипокотиля, укорочение корня и усиление апикального крючка (резкий изгиб верхней части гипокотиля). Ответ проростков на этилен крайне важен на первых этапах их развития, так как способствует пробивание ростков к свету[10].
В коммерческом сборе плодов и фруктов используют специальные комнаты или камеры для дозревания плодов, в атмосферу которых этилен впрыскивается из специальных каталитических генераторов, производящих газообразный этилен из жидкого этанола. Обычно для стимулирования дозревания плодов используется концентрация газообразного этилена в атмосфере камеры от 500 до 2000 ppm в течение 24-48 часов. При более высокой температуре воздуха и более высокой концентрации этилена в воздухе дозревание плодов идёт быстрее. Важно, однако, при этом обеспечивать контроль содержания углекислого газа в атмосфере камеры, поскольку высокотемпературное созревание (при температуре выше 20 градусов Цельсия) или созревание при высокой концентрации этилена в воздухе камеры приводит к резкому повышению выделения углекислого газа быстро созревающими плодами, порой до 10 % углекислоты в воздухе спустя 24 часа от начала дозревания, что может привести к углекислотному отравлению как работников, убирающих уже дозревшие плоды, так и самих фруктов[11].
Этилен использовался для стимулирования созревания плодов ещё в Древнем Египте. Древние египтяне намеренно царапали или слегка мяли, отбивали финики, фиги и другие плоды с целью стимулировать их созревание (повреждение тканей стимулирует образование этилена тканями растений). Древние китайцы сжигали деревянные ароматические палочки или ароматические свечи в закрытых помещениях с целью стимулировать созревание персиков (при сгорании свеч или дерева выделяется не только углекислый газ, но и недоокисленные промежуточные продукты горения, в том числе и этилен). В 1864 году было обнаружено, что утечка природного газа из уличных фонарей вызывает торможение роста близлежащих растений в длину, их скручивание, аномальное утолщение стеблей и корней и ускоренное созревание плодов.[8] В 1901 году русский учёный Дмитрий Нелюбов показал, что активным компонентом природного газа, вызывающим эти изменения, является не основной его компонент, метан, а присутствующий в нём в малых количествах этилен[12]. Позднее в 1917 году Сара Дубт доказала, что этилен стимулирует преждевременное опадание листьев[13]. Однако только в 1934 году Гейн обнаружил, что сами растения синтезируют эндогенный этилен.[14]. В 1935 году Крокер предположил, что этилен является растительным гормоном, ответственным за физиологическое регулирование созревания плодов, а также за старение вегетативных тканей растения, опадание листьев и торможение роста[15].
Этилен образуется практически во всех частях высших растений, включая листья, стебли, корни, цветки, мякоть и кожуру плодов и семена.
Образование этилена регулируется множеством факторов, включая как внутренние факторы (например фазы развития растения), так и факторы внешней среды. В течение жизненного цикла растения, образование этилена стимулируется в ходе таких процессов, как оплодотворение (опыление), созревание плодов, опадание листьев и лепестков, старение и гибель растения. Образование этилена стимулируется также такими внешними факторами, как механическое повреждение или ранение, нападение паразитов (микроорганизмов, грибков, насекомых и др.), внешние стрессы и неблагоприятные условия развития, а также некоторыми эндогенными и экзогенными стимуляторами, такими, как ауксины и другие[16].
Цикл биосинтеза этилена начинается с превращения аминокислоты метионина в S-аденозил-метионин (SAMe) при помощи фермента метионин-аденозилтрансферазы. Затем S-аденозил-метионин превращается в 1-аминоциклопропан-1-карбоксиловую кислоту (АЦК, ACC) при помощи фермента 1-аминоциклопропан-1-карбоксилат-синтетазы (АЦК-синтетазы). Активность АЦК-синтетазы лимитирует скорость всего цикла, поэтому регуляция активности этого фермента является ключевой в регуляции биосинтеза этилена у растений. Последняя стадия биосинтеза этилена требует наличия кислорода и происходит при действии фермента аминоциклопропанкарбоксилат-оксидазы (АЦК-оксидазы), ранее известной как этиленобразующий фермент. Биосинтез этилена у растений индуцируется как экзогенным, так и эндогенным этиленом (положительная обратная связь). Активность АЦК-синтетазы и, соответственно, образование этилена повышается также при высоких уровнях ауксинов, в особенности индолуксусной кислоты, и цитокининов.
Этиленовый сигнал у растений воспринимается минимум пятью различными семействами трансмембранных рецепторов, представляющих собой димеры белков. Известен, в частности, рецептор этилена ETR1 у арабидопсиса (Arabidopsis). Гены, кодирующие рецепторы для этилена, были клонированы у арабидопсиса и затем у томата. Этиленовые рецепторы кодируются множеством генов как в геноме арабидопсиса, так и в геноме томатов. Мутации в любом из семейства генов, которое состоит из пяти типов этиленовых рецепторов у арабидопсиса и минимум из шести типов рецепторов у томата, могут привести к нечувствительности растений к этилену и нарушениям процессов созревания, роста и увядания[17]. Последовательности ДНК, характерные для генов этиленовых рецепторов, были обнаружены также у многих других видов растений. Более того, этиленсвязывающий белок был найден даже у цианобактерий[8].
Неблагоприятные внешние факторы, такие, как недостаточное содержание кислорода в атмосфере, наводнение, засуха, заморозки, механическое повреждение (ранение) растения, нападение патогенных микроорганизмов, грибков или насекомых, могут вызывать повышенное образование этилена в тканях растений. Так, например, при наводнении корни растения страдают от избытка воды и недостатка кислорода (гипоксии), что приводит к биосинтезу в них 1-аминоциклопропан-1-карбоксиловой кислоты. АЦК затем транспортируется по проводящим путям в стеблях вверх, до листьев, и в листьях окисляется до этилена. Образовавшийся этилен способствует эпинастическим движениям, приводящим к механическому стряхиванию воды с листьев, а также увяданию и опаданию листьев, лепестков цветков и плодов, что позволяет растению одновременно и избавиться от избытка воды в организме, и сократить потребность в кислороде за счёт сокращения общей массы тканей[18].
Небольшие количества эндогенного этилена также образуются в клетках животных, включая человека, в процессе перекисного окисления липидов. Некоторое количество эндогенного этилена затем окисляется до этиленоксида, который обладает способностью алкилировать ДНК и белки, в том числе гемоглобин (формируя специфический аддукт с N-терминальным валином гемоглобина — N-гидроксиэтил-валин)[19]. Эндогенный этиленоксид также может алкилировать гуаниновые основания ДНК, что приводит к образованию аддукта 7-(2-гидроксиэтил)-гуанина, и является одной из причин присущего всем живым существам риска эндогенного канцерогенеза[20]. Эндогенный этиленоксид также является мутагеном[21][22]. С другой стороны, существует гипотеза, что если бы не образование в организме небольших количеств эндогенного этилена и этиленоксида, то скорость возникновения спонтанных мутаций и соответственно скорость эволюции была бы ниже.
Примечания[править | править код]
- ↑ Devanney Michael T. Ethylene (англ.) (недоступная ссылка). SRI Consulting (September 2009). Архивировано 18 июля 2010 года.
- ↑ Ethylene (англ.) (недоступная ссылка). WP Report. SRI Consulting (January 2010). Архивировано 31 августа 2010 года.
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (Утв. главным государственным санитарным врачом РФ 30.03.2003) (недоступная ссылка)
- ↑ «Рост и развитие растений» В. В. Чуб (недоступная ссылка). Дата обращения: 21 января 2007. Архивировано 20 января 2007 года.
- ↑ «Delaying Christmas tree needle loss»
- ↑ Хомченко Г.П. §16.6. Этилен и его гомологи // Химия для поступающих в вузы. — 2-е изд. — М.: Высшая школа, 1993. — С. 345. — 447 с. — ISBN 5-06-002965-4.
- ↑ В. Ш. Фельдблюм. Димеризация и диспропорционирование олефинов. М.: Химия, 1978
- ↑ 1 2 3 Lin, Z.; Zhong, S.; Grierson, D. Recent advances in ethylene research (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2009. — Vol. 60, no. 12. — P. 3311—3336. — doi:10.1093/jxb/erp204. — PMID 19567479.
- ↑ Ethylene and Fruit Ripening / J Plant Growth Regul (2007) 26:143-159 doi:10.1007/s00344-007-9002-y (англ.)
- ↑ 1 2 Лутова Л.А. Генетика развития растений / ред. С.Г. Инге-Вечтомов. — 2-е изд.. — Санкт-Петербург: Н-Л, 2010. — С. 432.
- ↑ External Link to More on Ethylene Gassing and Carbon Dioxide Control. ne-postharvest.com Архивная копия от 14 сентября 2010 на Wayback Machine
- ↑ Нелюбов Д. Н. О горизонтальной нутации у Pisum sativum и некоторых других растений (рус.) // Труды Санкт-Петербургского Общества Естествознания : журнал. — 1901. — Т. 31, № 1., также Beihefte zum «Bot. Centralblatt», т. Х, 1901
- ↑ Doubt, Sarah L. The Response of Plants to Illuminating Gas (англ.) // Botanical Gazette : journal. — 1917. — Vol. 63, no. 3. — P. 209—224. — doi:10.1086/332006.
- ↑ Gane R. Production of ethylene by some fruits (англ.) // Nature. — 1934. — Vol. 134, no. 3400. — P. 1008. — doi:10.1038/1341008a0. — Bibcode: 1934Natur.134.1008G.
- ↑ Crocker W, Hitchcock AE, Zimmerman PW. (1935) «Similarities in the effects of ethlyene and the plant auxins». Contrib. Boyce Thompson Inst. 7. 231-48. Auxins Cytokinins IAA Growth substances, Ethylene
- ↑ Yang, S. F., and Hoffman N. E. Ethylene biosynthesis and its regulation in higher plants (англ.) // Ann. Rev. Plant Physiol. : journal. — 1984. — Vol. 35. — P. 155—189. — doi:10.1146/annurev.pp.35.060184.001103.
- ↑ Bleecker A. B., Esch J. J., Hall A. E., Rodríguez F. I., Binder B. M. The ethylene-receptor family from Arabidopsis: structure and function. (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. — 1998. — Vol. 353, no. 1374. — P. 1405—1412. — doi:10.1098/rstb.1998.0295. — PMID 9800203. [исправить]
- ↑ Explaining Epinasty. planthormones.inf
- ↑ Filser J. G., Denk B., Törnqvist M., Kessler W., Ehrenberg L. Pharmacokinetics of ethylene in man; body burden with ethylene oxide and hydroxyethylation of hemoglobin due to endogenous and environmental ethylene. (англ.) // Arch Toxicol. : journal. — 1992. — Vol. 66, no. 3. — P. 157—163. — PMID 1303633.
- ↑ Bolt H. M., Leutbecher M., Golka K. A note on the physiological background of the ethylene oxide adduct 7-(2-hydroxyethyl)guanine in DNA from human blood. (англ.) // Arch Toxicol. : journal. — 1997. — Vol. 71, no. 11. — P. 719—721. — PMID 9363847.
- ↑ Csanády G. A., Denk B., Pütz C., Kreuzer P. E., Kessler W., Baur C., Gargas M. L., Filser JG. A physiological toxicokinetic model for exogenous and endogenous ethylene and ethylene oxide in rat, mouse, and human: formation of 2-hydroxyethyl adducts with hemoglobin and DNA. (англ.) // Toxicol Appl Pharmacol. : journal. — 2000. — 15 May (vol. 165, no. 1). — P. 1—26. — PMID 10814549.
- ↑ Thier R., Bolt HM. Carcinogenicity and genotoxicity of ethylene oxide: new aspects and recent advances. (англ.) // Crit Rev Toxicol. : journal. — 2000. — September (vol. 30, no. 5). — P. 595—608. — PMID 11055837.
Литература[править | править код]
- Горбов А. И.,. Этилен // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ГОСТ 24975.0-89 Этилен и пропилен. Методы отбора проб
- ГОСТ 25070-87 Этилен. Технические условия
Ссылки[править | править код]
- Безуглова О. С. Этилен. Удобрения и стимуляторы роста. Дата обращения: 22 февраля 2015.
Источник
