Какие продукты образуется при гликолизе
Гликолиз – процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты, не является мембранозависимым процессом. Он происходит в цитоплазме. Однако ферменты гликолиза связаны со структурами цитоскелета. Суть гликолиза состоит в том, что молекула глюкозы (C6H12O6) без участия кислорода распадается на две молекулы пировиноградной кислоты (СН3СОСООН). При этом окисление идет за счет отщепления от молекулы глюкозы четырех атомов водорода, связывающихся со сложным органическим веществом НАД с получением двух молекул НАД•Н. Выделяющаяся при этом энергия запасается (40% от общего количества) в виде макроэргических связей двух молекул АТФ. 60% энергии выделяется в виде тепла. При последующем окислении НАД•Н получается еще 6 молекул АТФ. Таким образом, полный энергетический выход гликолиза в анаэробных условиях составляет 8 молекул АТФ.
На схеме в рамках обозначены исходные субстраты и конечные продукты гликолиза, цифрами в скобках – число молекул.
Для распада и частичного окисления молекулы глюкозы требуется протекание 11 сложных последовательных реакций.
Реакции гликолиза
Ход реакций
Ферменты, Активаторы, ингибиторы
Подготовительная стадия гликолиза
Стадия активации глюкозы проходит в 5 реакций, в ходе которых 1 молекула гексозы (глюкозы) расщепляется на 2 молекулы триоз-глицеральдегидфосфата
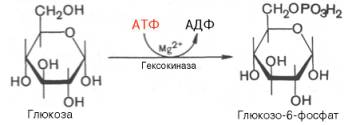
1. Необратимая реакция фосфорилирования глюкозы
Процесс гликолиза начинается с фосфорилирования глюкозы за счет АТФ – первая реакция. Это первая пусковая реакция гликолиза. Ее результатом является глюкозо-6-фосфат, имеющий отрицательный заряд. В гликолизе может участвовать не только глюкоза, но и другие гексозы (фруктоза), но в результате фосфорилирования и активации все равно образуется глюкозо-6-фосфат.

фермент: гексокиназа
Активаторы: АДФ, Н3РO4.
Ингибиторы: глюкозо-6-Ф, фосфоенолпируват.
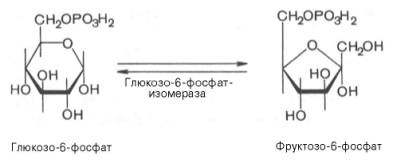
2. Обратимая реакция изомеризации глюкозо-6-фосфата
Во второй реакции происходит изомеризация (внутримолекулярные перестройки) глюкозо-6-фосфата во фруктозо-6-фосфат.

фермент: глюкозо-6-фосфатизомераза
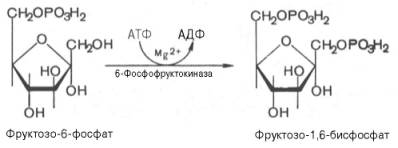
3. Необратимая реакция фосфорилирования фруктозо-6-фосфата (ключевая стадия гликолиза)
В третьей реакции происходит фосфорилирование (присоединение остатка ортофосфорной кислоты) фруктозо-6-фосфата с образованием фруктозо-1,6-дифосфата. При этом затрачивается еще одна молекула АТФ (уже вторая) – это вторая пусковая реакция гликолиза. Она идет в присутствии Mg2+ и является необратимой, так как сопровождается масштабным уменьшением свободной энергии.

фермент: фосфофруктокиназа
Активаторы: АДФ, АМФ, Н3РO4, К+.
Ингибиторы: АТФ, цитрат, НАДН.
4. Обратимая реакция дихотомического расщепления фруктозо-1,6-дифосфата
В четвертой реакции гликолиза происходит расщепление фруктозо-1,6-дифосфата на две молекулы глицеральдегид-3-фосфата.

фермент: алъдолаза
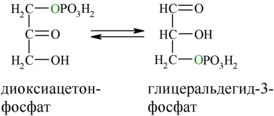
5. Обратимая реакция изомеризации дигидроксиацетона-3-фосфат в глицеральдегид-3-фосфат
В пятой реакции происходит изомеризация полученных триозофосфатов. На этом заканчивается первая стадия гликолиза.

фермент: триозофосфатизомераза
Стадия генерации АТФ
Проходит в 6 реакций (или 5), в ходе которых энергия окислительных реакций трансформируется в химическую энергию АТФ (субстратное фосфорилирование).
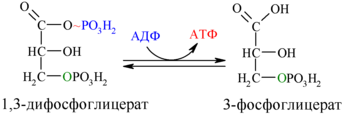
6. Окисление глицеральдегид-3-фосфата до 1,3-дифосфоглицерата (реакция гликолитической оксиредукции)
В шестой реакции происходит окисление альдегидной группы до карбоксильной. Выделившийся Н+ акцептируется NAD, который восстанавливается до NADH. Освобождающаяся энергия затрачивается для образования высокоэнергетической связи 1,3-бифосфоглицерата (1,3-бифосфоглицериновая кислота).

фермент: глицералъдегид-3-фосфат-дегидрогеназа
7. Субстратное фосфорилирование АДФ (7)
В седьмой реакции фосфорильная группа 1,3-бифосфоглицерата переносится на ADP, в результате чего образуется АТР (напоминаем, что следует иметь в виду две параллельные цепи реакций, с участием двух молекул триоз, образовавшихся из одной молекулы гексозы, следовательно, синтезируется не одна, а две молекулы АТР).

фермент: фосфоглицераткиназа
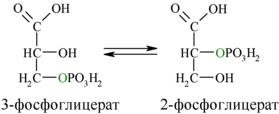
8. Реакция изомеризации 3-фосфоглицерата в 2-фосфоглицерат
В восьмой реакции гликолиза происходит перенос фосфатной группы с третьего атома углерода на второй. В результате образуется 2-фосфоглицерат (2-фосфоглицериновая кислота).

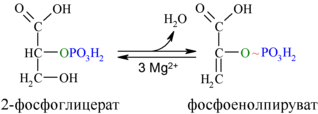
9. Реакция енолизации
Девятая реакция сопровождается внутримолекулярными окислительно-восстановительными процессами, в результате которых образуется фосфоенолпируват (фосфоенолпировиноградная кислота) с высокоэнергетической связью во втором атоме углерода и отщепляется молекула воды

фермент: енолаза
10. Реакция субстратного фосфорилирования
В ходе десятой реакции фосфорильная группа переносится на ADP. При этом синтезируется АТР и пируват (пировиноградная кислота). Эта реакция также необратима, поскольку высокоэкзергонична.

фермент: пируваткиназа
11. Реакция обратимого восстановления пировиноградной кислоты до молочной кислоты (в анаэробных условиях)
Если после гликолиза следует аэробное расщепление, пируват мигрирует в матрикс митохондрий, где, взаимодействуя с коэнзимом-А, участвует в образовании ацетил-СоА. В анаэробных условиях пируват при участии NADH восстанавливается до лактата (молочной кислоты), который при этом является конечным продуктом гликолиза. Затем в аэробных условиях лактат может обратно превратиться в пируват и окислиться в митохондриях.

фермент: лактатдегидрогеназа
1. Биология для поступающих в вузы / Г.Л. Билич, В.А. Крыжановский. — 2008.
2. Биология в таблицах и схемах / Спб. — 2004.
3. Биохимия в схемах и таблицах / И. В. Семак – Минск — 2011.
Источник
Гликолиз (от
греч. glycys – сладкий и lysis –
растворение, распад) – это последовательность ферментативных реакций,
приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
При аэробных
условиях пируват проникает в митохондрии, где полностью окисляется до СО2
и Н2О. Если содержание кислорода недостаточно, как это может иметь
место в активно сокращающейся мышце, пируват превращается в лактат.
Итак,
гликолиз – не только главный путь утилизации глюкозы в клетках, но и уникальный
путь, поскольку он может использовать кислород, если
последний
доступен (аэробные условия), но может протекать и в отсутствие кислорода
(анаэробные условия).
Анаэробный гликолиз – сложный ферментативный процесс распада глюкозы,
протекающий в тканях человека и животных без потребления кислорода. Конечным
продуктом гликолиза является молочная кислота. В процессе гликолиза образуется
АТФ. Суммарное уравнение гликолиза можно представить следующим образом:

В анаэробных
условиях гликолиз – единственный процесс в животном организме, поставляющий
энергию. Именно благодаря гликолизу организм человека и животных определенный
период может осуществлять ряд физиологических функций в условиях
недостаточности кислорода. В тех случаях, когда гликолиз протекает в
присутствии кислорода, говорят об аэробном гликолизе .
Последовательность
реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо
изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство
из которых выделено в гомогенном, клисталлическом или высокоочищенном виде и
свойства которых достаточно известны. Заметим, что гликолиз протекает в
гиало-плазме (цитозоле) клетки.
Первой
ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос
остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом
гексокиназой:
Образование
глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением
значительного количества свободной энергии системы и может считаться
практически необратимым процессом.
Наиболее
важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е.
последний служит одновременно и продуктом реакции, и аллостерическим
ингибитором.
Фермент
гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и
других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме
гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование
только D-глюкозы. В мышечной ткани этот фермент отсутствует (подробнее см.
главу 16).
Второй
реакцией гликолиза является превращение глюкозо-6-фос-фата под действием
фермента глюкозо-6-фосфатизомеразы во фруктозо-6-фосфат:
Эта реакция
протекает легко в обоих направлениях, и для нее не требуется каких-либо
кофакторов.
Третья
реакция катализируется ферментом фосфофруктокиназой; образовавшийся
фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:

Данная
реакция аналогично гексокиназной практически необратима, протекает в
присутствии ионов магния и является наиболее медленно текущей реакцией
гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Фосфофруктокиназа
относится к числу аллостерических ферментов. Она ингибируется АТФ и
стимулируется АМФ . При значительных величинах отношения АТФ/АМФ активность
фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении
этого коэффициента интенсивность гликолиза повышается. Так, в неработающей
мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно
высокая. Во время работы мышцы происходит интенсивное потребление АТФ и
активность фосфофруктокиназы повышается, что приводит к усилению процесса
гликолиза.
Четвертую
реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента
фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
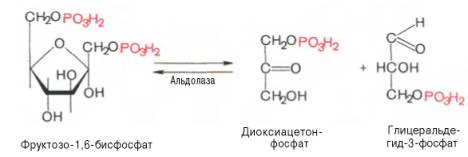
Эта реакция
обратима. В зависимости от температуры равновесие устанавливается на различном
уровне. При повышении температуры реакция сдвигается в сторону большего
образования триозофосфатов (дигидро-ксиацетонфосфата и
глицеральдегид-3-фосфата).
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом
триозофосфатизомеразой:

Равновесие
данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95%
дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие
реакции гликолиза может непосредственно включаться только один из двух
образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого
по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы
ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием
глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая
стадия – наиболее сложная и важная. Она включает окислительно-восстановительную
реакцию (реакция гликолитической оксидоредукции), сопряженную с субстратным
фосфорилированием, в процессе которого образуется АТФ.
В результате
шестой реакции глицеральдегид-3-фосфат в присутствии фермента
глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата
подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой
кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или
бромацетатом, протекает в несколько этапов:
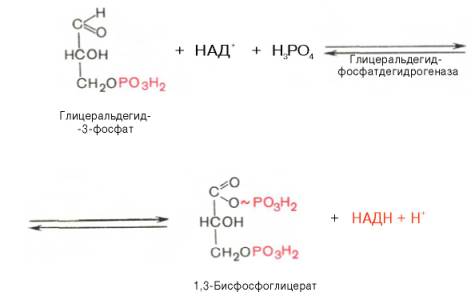
1,3-Бисфосфоглицерат
представляет собой высокоэнергетическое соединение (макроэргическая связь
условно обозначена знаком «тильда» ~). Механизм действия
глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии
неорганического фосфата НАД+ выступает как акцептор водорода,
отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН
глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп
последнего. Образовавшаяся связь богата энергией, но она непрочная и
расщепляется под влиянием неорганического фосфата, при этом образуется
1,3-бисфосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача
богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с
образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):
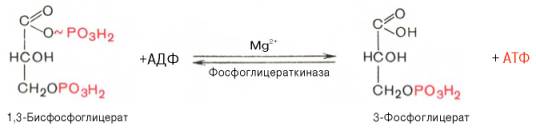
Таким
образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы
и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной
группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме
энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из
высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция
сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и
3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту
(2-фосфоглицерат).
Реакция
легкообратима, протекает в присутствии ионов Mg2+. Кофактором
фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в
фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат:

Девятая
реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота
в результате отщепления молекулы воды переходит в фосфоенолпировиноградную
кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится
высокоэргической:
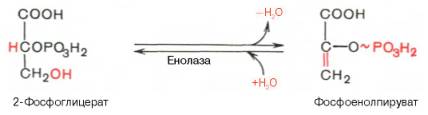
Енолаза
активируется двухвалентными катионами Mg2+или
Мn2+ и ингибируется фторидом.
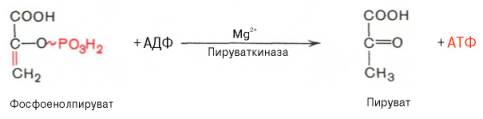
Десятая
реакция характеризуется разрывом высокоэргической связи и переносом фосфатного
остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование).
Катализируется ферментом пируваткиназой:
Для действия
пируваткиназы необходимы ионы Mg2+, а также
одновалентные катионы щелочных металлов (К+ или др.). Внутри клетки
реакция является практически необратимой.
В результате
одиннадцатой реакции происходит восстановление пировиноградной кислоты и
образуется молочная кислота. Реакция протекает при участии фермента
лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:

Последовательность
протекающих при гликолизе реакций представлена на рис. 10.3.
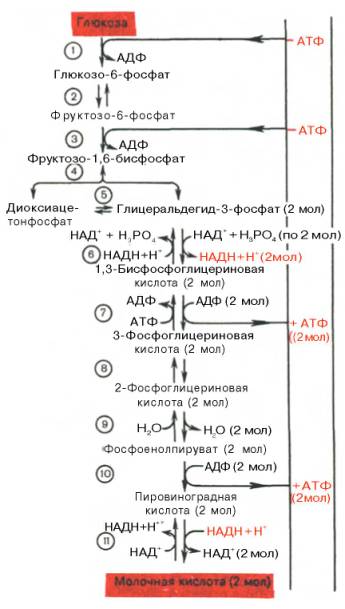
Рис. 10.3. Последовательность реакций гликолиза.
1 –
гексокиназа; 2 – фосфоглюкоизоме-раза; 3 – фосфофруктокиназа; 4 – альдо-лаза; 5
– триозофосфатизомераза; 6 – гли-церальдегидфосфатдегидрогеназа; 7
-фосфоглицераткиназа; 8 – фосфоглицеромутаза; 9 – енолаза; 10 –
пируватки-наза; 11 –
лактатдегидрогеназа.
Реакция
восстановления пирувата завершает внутренний окислительно-восстановительный
цикл гликолиза. НАД+ при этом играет роль промежуточного переносчика
водорода от глицеральдегид-3-фосфата (6-я реакция) на пировиноградную кислоту
(11-я реакция), при этом сам он регенерируется и вновь может участвовать в
циклическом процессе, получившем название гликолитический оксидоредукции.
Биологическое
значение процесса гликолиза заключается прежде всего в образовании богатых
энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2
молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих
образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции).
Таким образом, энергетическая эффективность гликолиза в анаэробных условиях
составляет 2 молекулы АТФ на одну молекулу глюкозы.
Как
отмечалось, основной реакцией, лимитирующей скорость гликолиза, является
фосфофруктокиназная. Вторая реакция, лимитирующая скорость и регулирующая
гликолиз – гексокиназная реакция. Кроме того, контроль гликолиза
осуществляется также ЛДГ
и ее изоферментами.
В тканях с
аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ1
и ЛДГ2 (см. главу 4). Эти изоферменты инги-бируются даже небольшими
концентрациями пирувата, что препятствует образованию молочной кислоты и
способствует более полному окислению пирувата (точнее, ацетил-КоА) в цикле
трикарбоновых кислот.
В тканях
человека, в значительной степени использующих энергию гликолиза (например,
скелетные мышцы), главными изоферментами являются ЛДГ5 и ЛДГ4.
Активность ЛДГ5 максимальна при тех концентрациях пирувата, которые
ингибируют ЛДГ1. Преобладание изоферментов ЛДГ4 и ЛДГ5
обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в
молочную кислоту.
Как
отмечалось, процесс анаэробного распада гликогена получил название
гликогенолиза. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза
происходит при участии 2 ферментов – фосфорилазы а и фосфо-глюкомутазы. Образовавшийся в результате
фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс
гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и
гликогенолиза полностью совпадают:
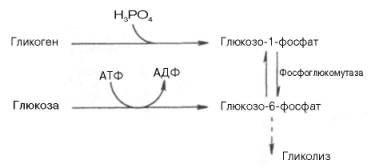
В процессе
гликогенолиза в виде макроэргических соединений накапливаются не две, а три
молекулы АТФ (АТФ не тратится на образование глюкозо-6-фосфата). Кажется, что
энергетическая эффективность глико-генолиза выглядит несколько более высокой по
сравнению с процессом гликолиза, но эта эффективность реализуется только при
наличии активной фосфорилазы а.
Следует иметь в виду, что в процессе активации фосфо-рилазы b расходуется АТФ (см. рис. 10.2).
Еще по теме:
- ГЛИКОЛИЗ – химическая энциклопедия
- Гликолиз – биохимический справочник
- Гликолиз – Наглядная биохимия
Источник
Общий обзор
Гликолитический путь представляет собой 10 последовательных реакций, каждая из которых катализируется отдельным ферментом.
Процесс гликолиза условно можно разделить на два этапа. Первый этап, протекающий с расходом энергии 2-х молекул АТФ, заключается в расщеплении молекулы глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое окисление глицеральдегид-3-фосфата, сопровождающееся синтезом АТФ. Сам по себе гликолиз является полностью анаэробным процессом, то есть не требует для протекания реакций присутствия кислорода.
Гликолиз — один из древнейших метаболических процессов, известный почти у всех живых организмов. Предположительно гликолиз появился более 3,5 млрд лет назад у первичных прокариотов.
Локализация
В клетках эукариотических организмов десять ферментов, катализирующих распад глюкозы до ПВК, находятся в цитозоле, все остальные ферменты, имеющие отношение к энергетическому обмену, — в митохондриях и хлоропластах. Поступление глюкозы в клетку осуществляется двумя путями: натрий-зависимый симпорт (преимущественно для энтероцитов и эпителия почечных канальцев) и облегчённая диффузия глюкозы с помощью белков-переносчиков. Работа этих белков-транспортёров контролируется гормонами и, в первую очередь, инсулином. Сильнее всего инсулин стимулирует транспорт глюкозы в мышцах и жировой ткани.
Результат
Результатом гликолиза является превращение одной молекулы глюкозы в две молекулы пировиноградной кислоты (ПВК) и образование двух восстановительных эквивалентов в виде кофермента НАД∙H.
Полное уравнение гликолиза имеет вид:
Глюкоза + 2НАД+ + 2АДФ + 2Фн = 2НАД∙Н + 2ПВК + 2АТФ + 2H2O + 2Н+.
При отсутствии или недостатке в клетке кислорода пировиноградная кислота подвергается восстановлению до молочной кислоты, тогда общее уравнение гликолиза будет таким:
Глюкоза + 2АДФ + 2Фн = 2лактат + 2АТФ + 2H2O.
Таким образом, при анаэробном расщеплении одной молекулы глюкозы суммарный чистый выход АТФ составляет две молекулы, полученные в реакциях субстратного фосфорилирования АДФ.
У аэробных организмов конечные продукты гликолиза подвергаются дальнейшим превращениям в биохимических циклах, относящихся к клеточному дыханию. В итоге после полного окисления всех метаболитов одной молекулы глюкозы на последнем этапе клеточного дыхания — окислительном фосфорилировании, происходящем на митохондриальной дыхательной цепи в присутствии кислорода, — дополнительно синтезируются ещё 34 или 36 молекулы АТФ на каждую молекулу глюкозы.
Путь
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецифичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы — глюкозо-6-фосфат (Г-6-Ф):
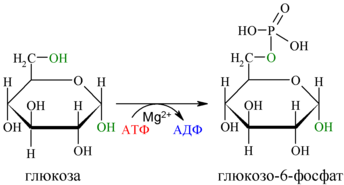
Для протекания реакции необходимо наличие в среде ионов Mg2+, с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза.
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы.
Печёночный изофермент гексокиназы — глюкокиназа — имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат (Ф-6-Ф):
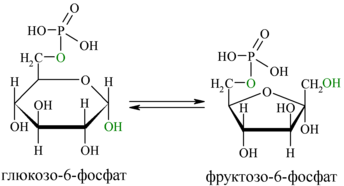
Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ) на две триозы (4).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
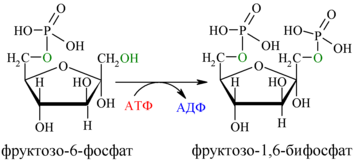
Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:
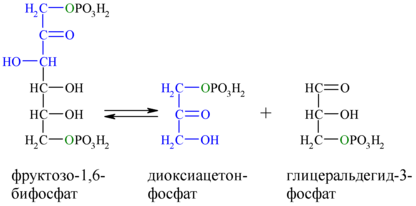
В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат, причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5), который и участвует в дальнейших превращениях:
Каждая молекула глицеральдегидфосфата окисляется НАД+ в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглицерата (6):
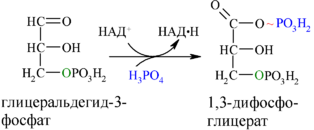
Далее с 1,3-дифосфоглицерата, содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция 7) — образуется молекула АТФ:
Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3. Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
Затем последовательно: фосфоглицеролмутаза образует 2-фосфоглицерат (8):
Енолаза образует фосфоенолпируват (9):
И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10):
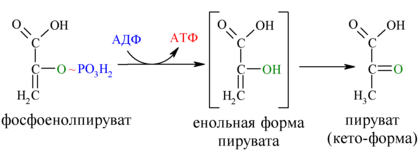
Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции 7 и 10, в которых и происходит к субстратное фосфорилирование АДФ.
Дальнейшее развитие
Окончательная судьба пирувата и НАД∙H, образованных в процессе гликолиза зависит от организма и условий внутри клетки, в особенности от наличия или отсутствия кислорода или других акцепторов электронов.
У анаэробных организмов пируват и НАД∙H далее подвергаются брожению. При молочнокислом брожении, например, у бактерий пируват под действием фермента лактатдегидрогеназы восстанавливается в молочную кислоту. У дрожжей сходным процессом является спиртовое брожение, где конечными продуктами будут этанол и углекислый газ. Известно также маслянокислое и лимоннокислое брожение.
Маслянокислое брожение:
глюкоза → масляная кислота + 2 CO2 + 2 H2O.
Спиртовое брожение:
глюкоза → 2 этанол + 2 CO2.
Лимоннокислое брожение:
глюкоза → лимонная кислота + 2 H2O.
Брожение имеет важное значение в пищевой промышленности.
У аэробов пируват как правило попадает в цикл трикарбоновых кислот (цикл Кребса), а НАД∙H в итоге окисляется кислородом на дыхательной цепи в митохондриях в процессе окислительного фосфорилирования.
Несмотря на то, что метаболизм человека преимущественно аэробный, в интенсивно работающих скелетных мышцах наблюдается анаэробное окисление. В условиях ограниченного доступа кислорода пируват превращается в молочную кислоту, как происходит при молочнокислом брожении у многих микроорганизмов:
ПВК + НАД∙Н + H+ → лактат + НАД+.
Боли в мышцах, возникающие через некоторое время после непривычной интенсивной физической нагрузки, связаны с накоплением в них молочной кислоты.
Образование молочной кислоты является тупиковой ветвью метаболизма, но не является конечным продуктом обмена веществ. Под действием лактатдегидрогеназы молочная кислота окисляется снова, образуя пируват, который и участвует в дальнейших превращениях.
Регуляция гликолиза
Различают местную и общую регуляцию.
Местная регуляция осуществляется путём изменения активности ферментов под действием различных метаболитов внутри клетки.
Регуляция гликолиза в целом, сразу для всего организма, происходит под действием гормонов, которые, влияя через молекулы вторичных посредников, изменяют внутриклеточный метаболизм.
Важное значение в стимуляции гликолиза принадлежит инсулину. Глюкагон и адреналин являются наиболее значимыми гормональными ингибиторами гликолиза.
Инсулин стимулирует гликолиз через:
- активацию гексокиназной реакции;
- стимуляцию фосфофруктокиназы;
- стимуляцию пируваткиназы.
Также на гликолиз влияют и другие гормоны. Например, соматотропин ингибирует ферменты гликолиза, а тиреоидные гормоны являются стимуляторами.
Регуляция гликолиза осуществляется через несколько ключевых этапов. Реакции, катализируемые гексокиназой (1), фосфофруктокиназой (3) и пируваткиназой (10) отличаются существенным уменьшением свободной энергии и являются практически необратимыми, что позволяет им быть эффективными точками регуляции гликолиза.
Регуляция гексокиназы
Гексокиназа ингибируется продуктом реакции — глюкозо-6-фосфатом, который аллостерически связывается с ферментом, изменяя его активность.
По причине того, что основная масса Г-6-Ф в клетке производится путём расщепления гликогена, гексокиназная реакция, по сути, для протекания гликолиза не является необходимой, и фосфорилирования глюкозы в регуляции гликолиза исключительной важности не имеет. Гексокиназная реакция является важным этапом регуляции концентрации глюкозы в крови и в клетке.
При фосфорилировании глюкоза теряет способность транспортироваться через мембрану молекулами-переносчиками, что создаёт условия для накопления её в клетке. Ингибирование гексокиназы Г-6-Ф ограничивает поступление глюкозы в клетку, предотвращая её чрезмерное накопление.
Глюкокиназа (IV изотип гексокиназы) печени не ингибируется глюкозо-6-фосфатом, и клетки печени продолжают накапливать глюкозу даже при высоком содержании Г-6-Ф, из которого в дальнейшем синтезируется гликоген. По сравнению с другими изотипами глюкокиназа отличается высоким значением константы Михаэлиса, то есть на полную мощность фермент работает только в условиях высокой концентрации глюкозы, которая бывает почти всегда после приёма пищи.
Глюкозо-6-фосфат может превращаться обратно в глюкозу при действии глюкозо-6-фосфатазы. Ферменты глюкокиназа и глюкозо-6-фосфатаза участвуют в поддержании нормальной концентрации глюкозы в крови.
Регуляция фосфофруктокиназы
Интенсивность протекания фосфофруктокиназной реакции решающим образом сказывается на всей пропускной способности гликолиза, а стимуляция фосфофруктокиназы считается наиболее важным этапом регуляции.
Фосфофруктокиназа (ФФК) — это тетрамерный фермент, существующий поочерёдно в двух конформационных состояниях (R и T), которые находятся в равновесии и попеременно переходят из одного в другое. АТФ является одновременно и субстратом, и аллостерическим ингибитором ФФК.
В каждой из субъединиц ФФК имеется по два центра связывания АТФ: субстратный сайт и сайт ингибирования. Субстратный сайт одинаково способен присоединять АТФ при любой конформации тетрамера. В то время как сайт ингибирования связывает АТФ исключительно, когда фермент находится в конформационном состоянии T. Другим субстратом ФФК является фруктозо-6-фосфат, который присоединяется к ферменту предпочтительно в R-состоянии. При высокой концентрации АТФ сайт ингибирования занимается, переходы между конформациями фермента становятся невозможными, и большинство молекул фермента оказываются стабилизированными в T-состоянии, неспособном присоединить Ф-6-Ф. Однако ингибирование фосфофруктокиназ