Какие продукты образуются при хлорировании метана
Что такое метан
Метан в переводе с латинского обозначает «болотный газ». В обычных условиях это бесцветный газ без запаха, в два раза легче воздуха, малорастворим в воде, для человека не ядовит, хотя обладает небольшим наркотическим действием. Относится к простейшим предельным углеводородам.
Является третьим по значимости парниковым газом, его вклад в парниковый эффект оценивается специалистами в 4–9 %. Химическая формула — (CH_{4}).
Применение метана: используется в качестве топлива как в промышленности, так и в быту. В случае использования в быту его специально одорируют, т. е. добавляют запах, с помощью тиолов, чтобы можно было почувствовать утечку. В промышленности для отслеживания утечек используют датчики.
Для человека является опасным не избыток метана в помещении, а недостаток кислорода. При 20–30 % содержания метана в воздухе человек испытывает одышку, а более высокая концентрация метана вызывает симптомы, характерные для горной болезни.
При накоплении в закрытом помещении в концентрации от 4,4 до 17 % взрывоопасен. Класс опасности метана — четвертый.
Формула и молекула метана:

Источник: химия.ру
Химические свойства метана
Метан довольно устойчив к химическим реакциям, как первый член гомологического ряда алканов (насыщенных углеводородов).
Доступные ему химические реакции разнообразны.
Горение — метан горит голубоватым пламенем с образованием углекислого газа и воды, реакция имеет необратимый характер:
(CH_{4} + 2O_{2} → СO_{2}↑ + 2Н_{2}O)
Замещение — реакция с галогенами, такими как хлор или бром:
(CH_{4} + Cl_{2} → CH_{3}Cl + НСl)
(CH_{4} + Br_{2} → CH_{3}Br + НBr)
Разложение бывает двух типов:
- Полное: (СН_{4} → С + 2H_{2}.)
- Неполное: (2СН_{4} → С_{2}Н_{2} + 3Н_{2}.)
Реакция с кислотами:
(2CH_{4} + Н_{2}SО_{4} → СН_{3}SО_{3}Н + Н_{2}О)
Окисление:
- Полное: (2СН_{4} + 3O_{2} → 2CO + 4Н_{2}O.)
- Неполное: (СН_{4} + О_{2} → С + 2Н_{2}O.)
Также у метана присутствует каталитическое окисление, т. е. происходящее в присутствии катализатора. При этом можно получить разный конечный результат, зависящий от количества молей веществ:
- Спирты: (2СН_{4} + O_{2} → 2СO_{3}OН.)
- Альдегиды: (СН_{4} + O_{2} → НСОН + Н_{2}O.)
- Карбоновые кислоты: (2СН_{4} + 3O_{2} → 2НСОOН + 2Н_{2}O.)
Нитрирование метана или реакция Коновалова с образованием нитросоединений:
(CH_{4} + НNО_{3} → СН_{3}NO_{2} + H_{2}O)
Дегидрирование, т. е. разложение метана с образованием ацетилена:
(2CН_{4} → C_{2}H_{2} + 3Н_{2})
Особенности хлорирования метана
Характерное свойство алканов — вступать в реакцию с таким представителем группы галогенов, как хлор. Метан не является исключением.
В хлорировании метана есть свои особенности:
- для распада хлорной молекулы на атомы используют ультрафиолет;
- в процессе хлорирования метана выделяется теплота в количестве 108,8 кДж/моль;
- хлорирование алканов происходит при рассеянном свете, потому что при прямом освещении возможен взрыв;
- хлорирование метана происходит либо с подогревом до 200 градусов Цельсия, либо при ультрафиолетовом свете.
В ходе реакции хлорирования происходит замещение в формуле алканов атомов водорода атомами хлора. В результате получаются хлорпроизводные насыщенные углеводороды. В зависимости от мольного соотношения хлора и метана получают:
- при реакции 2 молей хлора с 1 молем метана — в основном хлористый метил, хлористый метилен и хлороформ;
- при соотношении хлор/метан два к четырем главными продуктами являются хлороформ и четыреххлористый углерод.
Где используется процесс
Хлорпроизводные насыщенные углероды, получаемые в процессе хлорирования метана, используются в различных сферах человеческой деятельности.
Прежде всего продукты хлорирования метана являются хорошими растворителями. Пример такого растворителя — (CH_{2}Cl_{2}), дихлорметан.
Хлористый метил применяют при производстве метилцеллюлозы, в качестве хладагента для холодильных установок. Также он используется как производное для получения пластмасс и каучуков.
Тетрахлорметан (CСl_{4}) применяется для тушения пожаров. Хлороформ (CHCl_{3}) — в медицине в качестве анестетика.
Радикальный механизм хлорирования метана
Механизм радикально-цепного типа (S_{R}) способствует осуществлению реакции хлорирования метана с участием в ней инициаторов, способствующих образованию радикалов, при нагреве и облучении светом.
Процесс состоит из трех этапов:
- инициирование цепи — под воздействием света или тепла молекула хлора возбуждается и распадается на два атома (радикала);
- рост цепи — радикал хлора при столкновении с молекулой метана замещает один атом водорода;
- обрыв цепи — атом водорода соединяется с атомом хлора, отщепляя его от молекулы хлора.
Потом цикл повторяется.
Процесс наглядно показан на нижеприведенной схеме:

Источник: ппт-онлайн.орг
Закономерности радикального хлорирования метана
Процесс радикального хлорирования метана имеет характерные закономерности:
- взаимодействие атомов хлора и водорода будет происходить, только если их свободная энергия равна энергии активации;
- возникновение дополнительной активационной энергии происходит из-за нагревания или светового облучения;
- хлорирование метана при температуре 200 градусов Цельсия — это плохо управляемый химический процесс, который идет и после образования хлористого метила (СН_{3}Сl).
Ионный механизм хлорирования метана
Если хлорирование метана будет протекать в кислой среде в присутствии катализаторов (кислот Льюиса (SbF_{5}, AlCl_{3})), то хлорирование пойдет по ионному механизму. Без катализаторов такой механизм практически не осуществляется, потому что для процесса необходимо много энергии.
Катализатор запускает гетеролитический распад молекул хлора, что сопровождается образованием ионной комплексной пары ([AlCl_{4}]^{-} Cl^{+}), так как алюминий нуждается в электронах из-за соединения с отрицательно заряженными атомами хлора.
Из-за этого же атом алюминия отрывает от атома хлора два электрона, что приводит к образованию катиона хлора, который впоследствии гетеролитично разрывает связь (С—Н). В результате получается метильный карбокатион. При взаимодействии с хлорной молекулой он образует хлористый метил и катион хлора, который начинает взаимодействие со следующей молекулой.
Поскольку для распада хлорных молекул необходима энергия, то реакция хлорирования метана в присутствии катализатора сопровождается нагревом смеси.
Источник
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^circ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Итак, если смесь метана с хлором нагреть до $200^circ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
Рисунок 1. Хлорирование метана
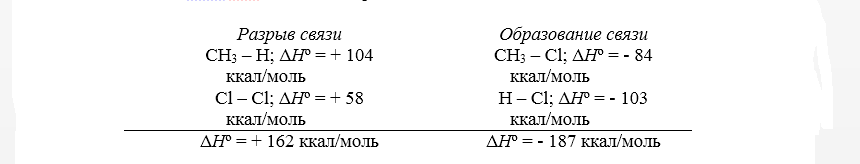
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.

Рисунок 2. Хлорирование метана
Замечание 1
Суммарный тепловой эффект $Delta underline{H}^circ = – 25$ ккал/моль. Эти данные показывают, что хлорирование метана представляет собой вполне вероятный процесс, хотя тепловой эффект никоим образом не связан со скоростью реакции, которая определяется свободной энергией активации.
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
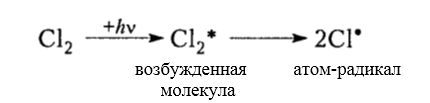
Рисунок 3. Хлорирование метана
рост цепи
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
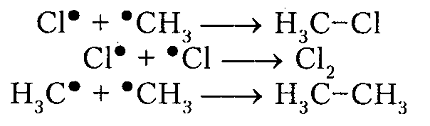
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 000$ и более.
На рис. 6 показана энергетическая диаграмма хлорирования метана.
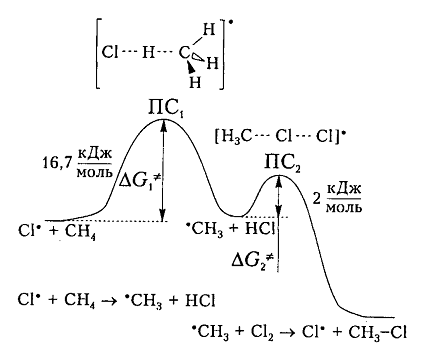
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи – связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой ${rm H}-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах – плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов (кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
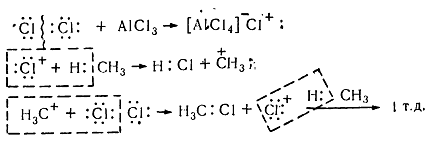
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Источник
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp3:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:

Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода

Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
CH4 + HNO3 = CH3NO2 + H2O
2. Реакции разложения метана (дегидрирование, пиролиз)
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
3. Окисление метана
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя.
2. Водный или кислотный гидролиз карбида алюминия
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Al4C3 + 12HCl = 4AlCl3 + 3CH4
Этот способ получения используется в лаборатории для получения метана.
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить метан:
CO + 4H2 = CH4 + 2H2O
5. Получение метана в промышленности
В промышленности метан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Источник
