Какие продукты образуются при расщеплении белков
 «Расщепление белков в желудочно-кишечном тракте» — это первая из четырёх статья из цикла «Обмен белков в организме человека»
«Расщепление белков в желудочно-кишечном тракте» — это первая из четырёх статья из цикла «Обмен белков в организме человека»
В течение всей жизни в организме происходят одновременно разрушения и биосинтез клеток и тканей. Эти противоположные, но тесно связанные между собой процессы — ассимиляция и диссимиляция — составляют основу жизни. Итак, в организм должны постоянно поступать вещества, необходимые для построения новых клеток. Главная роль в этом принадлежит белкам, так как ни углеводы, ни жиры не могут их заменить в образовании основных структурных элементов органов и тканей. Среди различных преобразований, присущих живой материи, основное место занимает белковый обмен.
В связи с тем, что белки являются азотсодержащими веществами, одним из методов, характеризующим состояние белкового обмена в организме, может быть определение баланса азота. У здорового человека при нормальном питании отмечается состояние белкового равновесия, когда поступление азота компенсирует его затраты. При отрицательном азотистом балансе количество выведенного азота превышает его количество, поступающее в составе белков. Такое состояние может наблюдаться при нарушении деятельности пищеварительной системы, белковом голодании и т п.
Положительный азотистый баланс бывает в тех случаях, когда количество выведенного азота меньше того, что поступает в составе белков. Это характерно для растущего организма, при беременности, при повышении активности процессов биосинтеза белка (например, при физических нагрузках).
Для синтеза белков в организме необходимы различные аминокислоты. Некоторые из них, образующиеся в самом организме, называются заменимыми. Аминокислоты, не синтезирующиеся в организме человека, называются незаменимыми. Они должны регулярно поступать с пищей. Белки, в состав которых входят заменимые и незаменимые аминокислоты в соотношениях, приближающихся к таковым в организме, называют полноценными.
Среди пищевых продуктов практически нет белков, которые полностью соответствуют этим требованиям. Наиболее близки к полноценному белки материнского молока, куриного яйца. Итак, для полного обеспечения здорового организма полноценными белками в суточный рацион должны быть включены различные пищевые продукты как животного, так и растительного происхождения.
Для нормальной жизнедеятельности человека необходимо поступление такого количества полноценного белка, которое будет покрывать все потребности организма. Оно зависит от пола, возраста, интенсивности труда и т.д. С учетом этих факторов разработаны нормы белкового питания. Недостаточное потребление белков приводит к нарушению процессов жизнедеятельности, ухудшению здоровья, а длительное белковое голодание неизбежно заканчивается гибелью.
Белки необходимы для организма, прежде всего, как пластический материал, из которого строятся клетки всех тканей, органов и систем. Однако пищевые белки не могут быть использованы без предварительного расщепления в организме, так как они имеют сложную структуру и видовую специфичность.
Расщепление (гидролиз) белков на аминокислоты, которые лишены видовой и тканевой специфичности, происходит в желудочно-кишечном тракте.
Переваривание питательных веществ (белков, углеводов, липидов) — это процесс гидролиза соответствующих соединений, входящих в состав продуктов питания, который происходит в пищеварительном тракте и приводит к образованию простых биомолекул. Последние за счет действия специфических механизмов мембранного транспорта всасываются в кровь или лимфу.
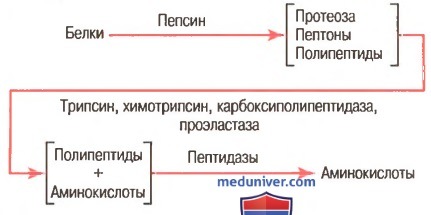
Переваривание белков начинается в желудке под действием желудочного сока. В состав желудочного сока входит соляная кислота, которая вырабатывается обкладочными клетками слизистой оболочки желудка. Она денатурирует белок, облегчает его последующее расщепление. В состав желудочного сока входят кислые фосфаты и некоторые органические кислоты. Соляная кислота способствует превращению профермента пепсиногена, который секретируется главными клетками слизистой оболочки желудка, в активный протеолитический фермент пепсин.
Оптимальная концентрация водородных ионов для пепсина составляет 1,5 — 2,5, что соответствует кислотности желудочного сока в процессе пищеварения. При увеличении рН среды до 6,0 (в кишечнике) пепсин теряет свою активность. Пепсин относится к однокомпонентным ферментам, то есть к ферментам-протеинам. За сутки в желудке вырабатывается около 2 г пепсина.
Каталитическая активность пепсина желудка очень высока. Он катализирует расщепление пептидных связей в молекуле белка, образованных аминогруппами ароматических и дикарбоновых аминокислот. В результате действия пепсина образуются полипептиды различной величины и отдельные свободные аминокислоты.
Кроме пепсина, в желудочном соке содержится протеолитический фермент гастриксин, оптимальное значение рН которого находятся в пределах 3,5 — 4,5. Гастриксин вступает в действие на последних этапах переваривания пищи в желудке.
В желудке грудных детей обнаружен сычужный фермент — химозин. Оптимум действия этого фермента рН 3,5 — 4,0. Под влиянием химозина в присутствии солей кальция казеиноген молока в ходе гидролиза превращается в казеин и молоко свёртывается.
Легче других в желудке перевариваются альбумины и глобулины животного и растительного происхождения; плохо расщепляются белки соединительной ткани (коллаген и эластин) и совсем не расщепляются кератин и протамины.
Частично переваренная полужидкая масса питательных соединений, которая образуется в желудке (химус) периодически поступает через пилорический клапан в двенадцатиперстную кишку. В эту часть пищеварительного канала поступают из поджелудочной железы протеолитические ферменты и пептидазы, которые действуют на пептиды, поступающие из желудка. Каталитическое действие этих ферментов происходит в слабощелочной среде (рН 7,5 — 8,0), которая образуется имеющимися в кишечном соке бикарбонатами.
Большинство ферментов протеолитического действия, функционирующих в тонкой кишке, синтезируются в экзокринных клетках поджелудочной железы в виде проферментов, которые активируются после их поступления в двенадцатиперстную кишку (трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и Б). Гидролиз белков и пептидов, поступающих из желудка, происходит как в полости тонкой кишки, так и на поверхности энтероцитов — пристеночное или мембранное пищеварение.
Сок поджелудочной железы поступает в двенадцатиперстную кишку и смешивается с кишечным соком. Эта смесь содержит протеолитические ферменты, расщепляющие белки, альбумозы и пептоны до небольших пептидов, а затем до аминокислот. К протеолитическим ферментам относятся трипсин, химотрипсин, карбоксипептидазы, аминопептидазы и большая группа три- и дипептидаз.
Трипсин находится в соке поджелудочной железы в неактивной форме, в виде профермента трипсиногена. Его активация происходит под действием фермента кишечного сока — энтерокиназы. Для процесса активации необходимы ионы Са2+. Процесс преобразования трипсиногена в трипсин осуществляется путем отщепления небольшого пептида с N-конца пептидной цепи фермента.
Трипсин гидролизует как нерасщепленные в желудке белки, так и высокомолекулярные пептиды, действуя главным образом на пептидные связи между аргинином и лизином. Оптимум рН для трипсина составляет 7,0 — 8,0. Трипсин делает сравнительно неглубокий гидролиз белка, образует полипептиды и небольшое количество свободных аминокислот.
Активность трипсина может снижаться под влиянием ряда ингибиторов. К ним относятся основные пептиды с молекулярной массой 9000 ед. Они обнаружены в поджелудочной железе, крови, легких, в бобах сои. Снижает активность трипсина и мукопротеин, содержащийся в сырых яйцах — авидин.
Химотрипсин — второй протеолитический фермент поджелудочной железы. Он также секретируется в неактивной форме, в виде химотрипсиногена. Под действием трипсина химотрипсиноген переходит в активный фермент — химотрипсин. Действие химотрипсина подобно действию трипсина. Оптимум рН для обоих ферментов примерно одинаковый, химотрипсин действует на белки и полипептиды, содержащие ароматические аминокислоты (тирозин, фенилаланин, триптофан), а также на пептидные связи, которые не подвергаются воздействию трипсина (метионин, лейцин).
Пептиды, которые образуютсяся в результате воздействия на белки пепсина, трипсина и химотрипсина в нижних отделах тонкой кишки, подвергаются дальнейшему расщеплению. Этот процесс осуществляют карбоксипептидазы, аминопептидазы. Эти ферменты относятся к металлоферментам. Они активируются двухвалентными ионами: Mg2+, Mn2+, Со2+, которые играют важную роль в формировании фермент-субстратного комплекса.
Механизм действия амино- и карбоксипептидаз заключается в отщеплении от пептидов конечных аминокислот, имеющих свободную аминную или карбоксильную группу. Небольшие пептиды, которые остались нерасщепленными и состоят из трех-четырех аминокислотных остатков, подвергаются гидролизу специфическими ди- и триаминопептидазами. В соке поджелудочной железы присутствует фермент эластаза. Эластаза — эндопептидаза, которая также имеет широкую субстратную специфичность, расщепляя пептидные связи, образующиеся остатками аминокислот малого размера — глицина, аланина, серина.
Таким образом, в результате последовательного действия на белки протеолитических ферментов в кишечнике образуются свободные аминокислоты, которые всасываются в кровь через стенку кишечника.
Следующая вторая статья из цикла «Обмен белков в организме человека» — «Обезвреживание продуктов гниения белков в кишечнике». Третья статья «Обмен аминокислот в тканях»
Источник
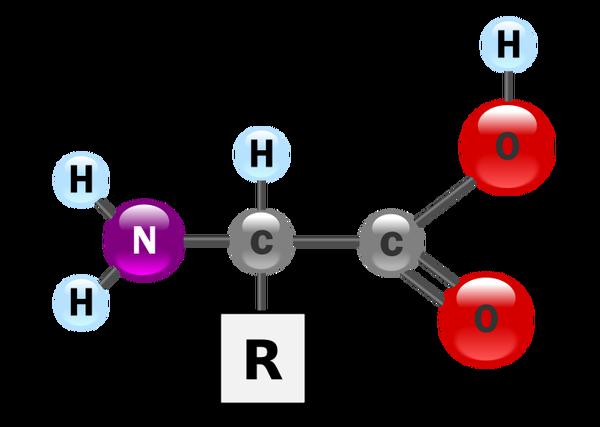
Как происходит процесс распада белков в нашем организме? Эти органические вещества являются основным биологическим материалом для формирования и роста живых клеток. Многочисленные функции, которые выполняют белковые молекулы в живом организме, невозможно компенсировать иными элементами и веществами, так как именно в полипептидах находятся незаменимые аминокислоты. Основным предназначением белков является их участие в репликации молекул РНК и ДНК.

Значимость процесса распада белковых молекул
Невозможно представить себе полноценную жизнь без белковых соединений. Они являются основным материалом для построения новых клеток, органов, различных тканей. Продукты распада белков – аминокислоты. Они необходимы живому существу для синтеза новых белковых молекул, специфичных для данного организма. Аминокислоты, получаемые при распаде белковых молекул, требуются для образования многих гормонов, ферментов, гемоглобина, иных веществ, которые в организме выполняют важные функции.
Незаменимые аминокислоты, которые поступают в организм только с пищей, образуются при гидролизе белковых молекул. Процесс образования нового белка из аминокислотных остатков позволяет организму получать энергию и строительный материал для синтеза новых клеток.
Механизм процесса распада белков
Рассмотрим это явление более подробно. Процесс распада белков связан с биохимическими реакциями, происходящими в полости тонкой кишки. Заболевания тонкой кишки и поджелудочной железы негативно влияют на данный процесс. Распад одного килограмма белка должен сопровождаться выделением 17,6 кДж энергии. После того как полипептид распадется на аминокислоты, процесс не останавливается. Далее идет образование неорганических продуктов: углекислого газа, аммиака, сероводорода, воды.
Особенности
Распад белков в организме – это процесс, который обеспечивает организм необходимым количеством энергии. В составе этих органических соединений находится более двадцати аминокислот, но только восемь из них могут синтезироваться внутри организма. Недостающие аминокислоты называют незаменимыми, они могут попадать в организм только с пищей. Для полного усвоения пищевого белка, аминокислоты должны в нем содержаться в строго определенном соотношении. Оно является индивидуальным для каждого живого организма. При недостатке одной из аминокислот, при распаде белковых молекул нарушается участие остальных аминокислот в синтезе, специфичного для живого организма белка.
Особенности продуктов распада
Организм систематически испытывает недостаток либо дефицит белка. Конечные продукты распада белка – материал для жизнедеятельности живого организма. Экспертами Всемирной организации здравоохранения доказано, что белковая недостаточность – это явление, характерное для слаборазвитых стран. При понижении количества белка в крови уменьшается осмотическое давление крови, она хуже забирает у тканей воду, появляются голодные отеки.
Сущность процесса

Гидролиз белка происходит под воздействием протеолитических ферментов (биологических катализаторов). Он протекает при несущественных значениях температур. Все ферменты желудочно-кишечного тракта воздействуют на пептидную связь, но каждый подбирает «свои» связи, которые образуют определенные аминокислоты.
К примеру, пепсин быстро разрушает связи между остатками серина и аланина, а трипсин «распознает» группы лизина и аргинина.
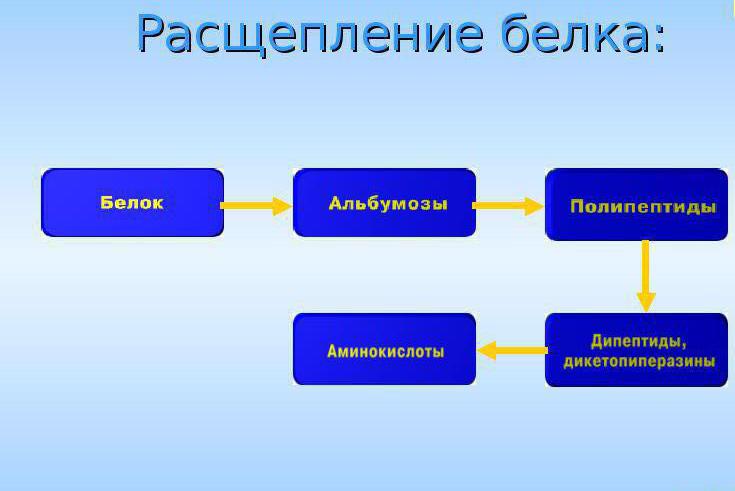
В желудке разрушение осуществляется под воздействием кислой среды желудочного сока, а также благодаря воздействию пепсина. Он разрывает в белковой молекуле внутренние связи, продуктом взаимодействия будут крупные обломки белкового полимера – пептоны. Они идут в двенадцатиперстную кишку, где идет их последующее превращение под воздействием ферментов: химоптрипсина, трипсина, пептидаз. Распад белка связан с разрушением пептидных связей, на которые воздействует фермент. После обработки химотрипсином больше половины пептидных связей оказываются гидролизованными.
Последующий распад белка осуществляется в тонком кишечнике под воздействием ферментов пептидаз.
Карбоксипептидазы способны отщеплять аминокислоты от остатков белковой структуры с карбоксильного конца, а аминопептидазы действуют с той стороны, где присутствует свободная аминогруппа, расщепляя дипептиды до свободных аминокислот.
Благодаря совместному действию группы ферментов в разных отделах желудочно-кишечного тракта происходит полный распад белка пищи на свободные аминокислоты.
Они всасываются через стенки мелких капилляров, оказываются в крови. Большая часть этих аминокислот разносится по всему живому организму, поступает к органам и тканям. В клетках из них происходит строительство новых белков, которые специфичны для данного организма. Это используется медиками при проведении процедуры переливании крови, чтобы не возникало отторжения донорского материала.
Качество белков
В живом организме постоянно, пусть и с разной скоростью, осуществляются процессы обновления и разрушения клеток, а также внеклеточного вещества, в составе которого есть белковые молекулы.
Процесс распада белков сопровождается выделением значительного количества энергии.

Безбелковое питание приводит к смерти, так как организм не получает необходимых аминокислот. Важно не только количество белков, которое потребляется с пищей, но и их качество. К примеру, чтобы компенсировать распавшийся в организме белок, нужно, чтобы с пищей пришел 1 г аминокислоты метионина. Белки волос, перьев, шерсти содержат полноценный аминокислотный состав. К 1915 году было выяснено, что белок зеин, который входит в состав кукурузы, не стимулирует рост клеток. При добавлении к нему аминокислоты триптофана живые организмы полноценно растут.
Белки разных органов, тканей, организмов имеют существенные отличия по молекулярной массе, заряду, аминокислотному составу, а также другим параметрам. Белок одного организма является чужим для другого. Распад белка приводит к образованию аминокислот, которые нужны для питания.
Источник
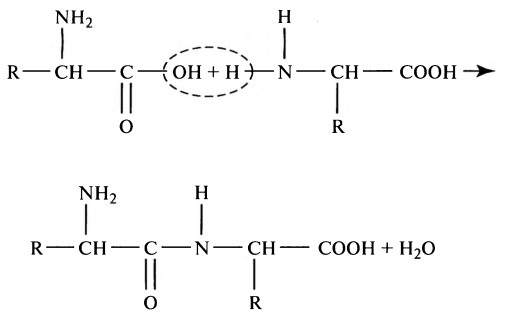
Переваривание белков. Этапы и последовательность переваривания белкова) Пищевые белки. Пищевые белки химически представляют собой длинные цепи аминокислот, соединенных друг с другом пептидными связями. Далее представлена типичная связь:
Характеристика каждого белка определяется типом аминокислот в молекуле белка и последовательностью расположения этих аминокислот. Физические и химические характеристики различных белков, важных для человека, изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше). б) Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Как объяснено в отдельной статье на сайте (просим вас пользоваться формой поиска выше), железы желудка секретируют большое количество соляной кислоты. Эта кислота секретируется париетальными (кислотопродуцирующими) клетками желез при рН, равным приблизительно 0,8. К моменту, когда кислота смешивается с желудочным содержимым и секретом из некислотопродуцирующих железистых клеток желудка, рН уже составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина. Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. В связи с этим у индивида, у которого отмечается недостаток пепсина в желудочном соке, съеденное мясо хуже подвергается обработке другими пищеварительными ферментами и, следовательно, может хуже перевариваться.
Как показано на рисунке выше, пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы, пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами. в) Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы (для облегчения понимания просим вас изучить рисунок выше). Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов. г) Переваривание белков пептидазами энтероцитов, встроенных в ворсинки тонкого кишечника. Заключительный этап переваривания белков в просвете кишечника обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью. Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дйпептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита. Наконец, внутри цитозоля энтероцитов находятся другие многочисленные пептидазы, которые специфичны для оставшихся связей между аминокислотами. В течение нескольких минут практически все оставшиеся дипептиды и трипептиды перевариваются до конечной стадии в форме отдельных аминокислот; далее они выходят через другую сторону энтероцита, а отсюда — в кровь. Более 99% конечных продуктов переваривания белков, которые всасываются, являются одиночными аминокислотами. Очень редко происходит всасывание пептидов и чрезвычайно редко всасывается целая молекула белка. Даже крайне малое число всосавшихся молекул цельного белка может иногда вызывать серьезные аллергические или иммунологические нарушения. – Также рекомендуем “Переваривание жиров. Этапы переваривания жиров в кишечнике” Оглавление темы “Пищеварительные соки. Переваривание углеводов, белков, жиров”: |
Источник