Какие продукты получаются при окислении метилового спирта

Окисление спиртов и фенолов
Для окисления гидроксисоединений используются соединения марганца(IV), марганца(VII), хрома(VI), оксиды металлов (Cu, Zn, Ag) и др.
Легкость окисления одноатомных спиртов уменьшается в ряду:
CH3OHМетанол CH3OH – сильный яд. Его высокая токсичность обусловлена лёгкой окисляемостью с образованием ядовитых продуктов (попадание в организм 5-10 г метанола приводит к слепоте, а 25-30 г – к смерти). > первичные ≥ вторичные >> третичные.
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот. В реакции участвует ближайшая к гидроксильной группе связь С–Н, по которой происходит внедрение атома кислорода. От образовавшегося при этом неустойчивого алкандиола-1,1Алкандиолы-1,1 – двухатомные спирты с ОН-группами при одном и том же атоме углерода R–CH(OH)2 и R2C(OH)2. Неустой-чивые соединения. Подобно угольной кислоте (O=C(OH)2 → CO2 + H2O) они легко отщепляют воду и превращаются в альдегиды R–CH=O или кетоны R2C=O. отщепляется вода с разрывом связей О–Н и С–ОH.
Окисления альдегида в карбоновую кислоту можно избежать, удаляя его из реакционной смеси путем отгонки
(альдегид кипит при более низкой температуре, так как его молекулы не ассоциированы за счет водородных связей).
При окислении вторичных спиртов получают кетоны.
Промышленное значение имеет реакция окисления вторичного алициклического спирта циклогексанола до кетона циклогексанона:

Это одна из стадий в многостадийном синтезе ε-капролактама, из которого получают поликапролактам (капрон).
Окисление первичных и вторичных спиртов происходит также в результате реакции дегидрирования (отщепления водорода) при пропускании паров спирта над нагретым катализатором (Cu, соединения Ag, Cr, или Zn). В этих условиях процесс идёт как внутримолекулярная окислительно-восстановительная реакция.

Данный метод позволяет превращать первичные спирты в альдегиды без их дальнейшего окисления до кислот.
Третичные спирты более устойчивы к действию окислителей. Если первичные и вторичные спирты окисляются в кислой, нейтральной и щелочной средах, то третичные спирты реагируют лишь в жестких условиях – кислая среда, повышенная температура. Это приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов – карбоновых кислот и кетонов с меньшим числом углеродных атомов.
- Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислением алкена. Например:
- Устойчивость третичных спиртов при окислении позволяет отличить их от первичных и вторичных спиртов по реакции с разбавленным щелочным раствором перманганата калия.
Многоатомные спирты при окислении образуют различные вещества, поскольку в реакцию могут вступать одна или несколько гидроксильных групп. Состав продуктов окисления зависит от взаимного положения ОН-групп в молекулах полигидроксильного соединения и природы окислителя.
Соединения с ОН-группами у соседних атомов углерода (1,2-диолы, 1,2,3-триолы и т.п.) окисляются наиболее легко. В зависимости от условий их окисление происходит с сохранением
C–C-связей
углеродного скелета (пример 1) или с их разрывом (пример 2) вплоть до полного разрушения С-скелета (пример 3).
Пример 1. Окисление этиленгликоля при действии CrO3 или HNO3

Пример 2. Окисление раствором перманганата калия в кислой среде при нагревании
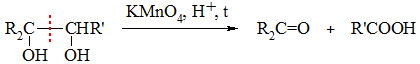
Кетон R2C=O образуется из фрагмента, содержащего третичную спиртовую группу, а карбоновая кислота R’COOH – из фрагмента с вторичной группой ОН.
При наличии фрагмента с первично-спиртовой группой –CH2OH образуется CO2:

Пример 3. Взаимодействие глицерина с кристаллическим перманганатом калия (видео)
Реакция глицерина HOCH2–CH(OH)–CH2OH с тонко измельчённым кристаллическим KMnO4 начинается самопроизвольно и идёт с высокой скоростью при выделении большого количества тепла. При этом глицерин окисляется полностью до углекислого газа и воды:
2С3Н8О3 + 7О2 → 6СО2 + 8Н2О + Q
Характерной реакцией многоатомных спиртов с соседними ОН-группами является окисление водным раствором иодной кислоты HIO4, которая не окисляет одноатомные спирты и многоатомные спирты других типов. Подробнее…
Реакция протекает через стадию образования циклического сложного эфира иодной кислоты (иодата), который расщепляется далее по связи С–С с выделением иодноватой кислоты:

В отличие от деструктивного окисления перманганатом калия, продуктами реакции с иодной кислотой являются альдегиды и (или) кетоны.
В случае трёх соседних C–ОН-групп средняя группа окисляется до муравьиной кислоты НСООН:

Данная реакция, называемая гликольным расщеплением, используется для установления числа и положения ОН-групп в полигидроксильных соединениях (главным образом, в углеводах) путём определения количества израсходованного окислителя и анализа продуктов окисления.
Кроме иодной кислоты для гликольного расщепления применяют также тетраацетат свинца (CH3COO)4Pb в органическом растворителе.
Фенолы окисляются легче спиртов. Эти реакции протекают многоступенчато с образованием довольно сложной смеси продуктов. Многие из фенолов, являясь бесцветными веществами, при стоянии на воздухе приобретают окраску за счёт примеси продуктов окисления.
Действие на фенол сильных окислителей (CrО3, хромовая смесь) приводит к образованию пара-бензохинона (наряду с другими продуктами окисления). Реакция идёт с отщеплением наиболее подвижного атома водорода в пара-положении бензольного кольца.

Значительно легче окисляются многоатомные фенолы.
Поэтому они являются более сильными восстановителями, чем одноатомные фенолы. Например, двухатомный фенол гидрохинон применяется как антиоксидант и ингибитор радикальной полимеризации, а также как проявитель в классической фотографии:

Наиболее сильными восстановителями являются трёхатомные фенолы, легко окисляющиеся даже кислородом воздуха. На этом основано применение в газовом анализе щелочного раствора пирогаллола , количественно поглощающего кислород.
, количественно поглощающего кислород.
Предельное окисление гидроксисоединений до CO2 и Н2О происходит при их горении, например:
2CH3OH + 3O2 2CO2 + 4H2O
Полное окисление метанола идет схеме:
При сгорании спиртов выделяется большое количество тепла.
C2H5OH + 3O2 2CO2 + 3H2O + 1370 кДж
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В лабораторной практике этанол применяется как горючее для “спиртовок”.
- Видеоопыт “Взаимодействие глицерина с кристаллическим перманганатом калия”.
Источник
1. Окисление спиртов
В лаборатории карбонильные соединения получают окислением спиртов в жестких условиях в присутствии сильных окислителей (дихромата калия К2Cr2O7 или перманганата калия КМnО4) в серной кислоте Н2SO4. В качестве окислителя можно использовать оксид меди (II) при нагревании.
При окислении первичных спиртов образуются альдегиды:
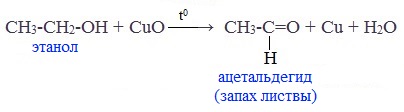
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
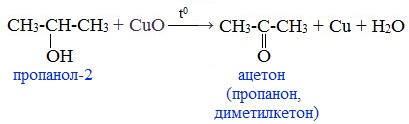
При окислении вторичных спиртов образуются кетоны:
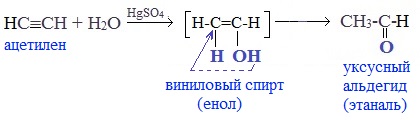
2. Гидратация алкинов (реакция Кучерова)
Присоединение воды к ацетилену происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
Кетоны получают при гидратации других гомологов ряда алкинов:
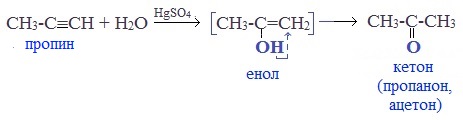
Раньше это был промышленный способ получения карбонильных соединений. В настоящее время этот способ находит ограниченное применение из-за загрязнения получаемых продуктов токсичными солями ртути и относительной дороговизны.
3. Каталитическое окисление алкенов кислородом воздуха
Этим способом в промышленности получают уксусный альдегид — окислением этилена кислородом воздуха (Вакер-процесс).
Эта реакция протекает в присутствии катализатора – смеси PdCl2 и CuCl2 и температуре 1000С:

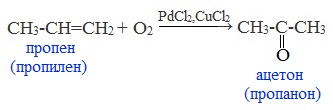
Этим экономичным способом получают низшие альдегиды и кетоны.
Этот промышленный способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
4. Каталитическое дегидрирование спиртов
В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.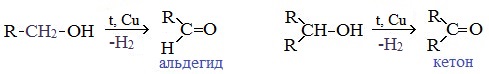
Например:
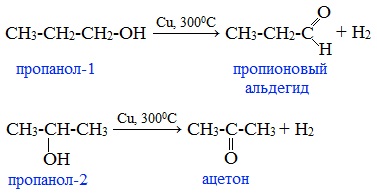
Этот способ получения объясняет суть названия «альдегид» (от лат. alconol dehydrogenatum – спирт, от которого «отняли» водород).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
Интересно знать
В 1835 г. немецкий химик Ю. Либих выделил индивидуальное вещество, молекула которого содержала на два атома водорода меньше, чем этанол. Ученый установил состав этого соединения – С2Н4О и назвал его альдегидом (от лат. alconol dehydrogenatum — т.е. дегидрированный спирт, «спирт, лишенный водорода»).
В 1867 г. немецкий химик-органик А. Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О, молекула которого отличается от открытого Либихом альдегида на группу -СН2— . Именно это соединение (муравьиный альдегид) открывает гомологический ряд альдегидов.
5. Щелочной гидролиз дигалогеналканов
Реакция протекает при действии водных растворов щелочей на дигалогензамещенные углеводороды, содержащие два атома галогена у одного и того же атома углерода.
При щелочном гидролизе дигалогеналканов образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и при отщеплении воды, превращаются в карбонильные соединения.
Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
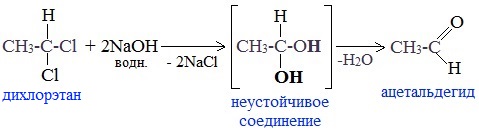
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
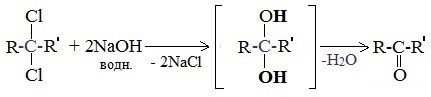
Это лабораторный способ получения карбонильных соединений.
6. Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны.
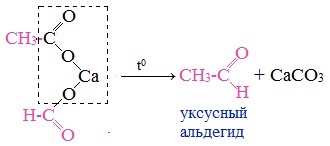


Это лабораторный способ получения карбонильных соединений.
7. Кумольный способ получения ацетона (наряду с фенолом)
Простейший кетон – ацетон – получают кумольным методом вместе с фенолом: 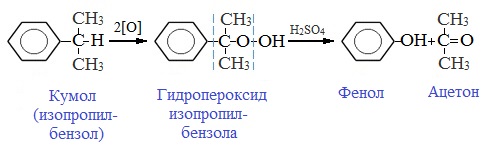
Это промышленный способ получения ацетона.
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
Получение формальдегида
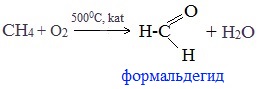
1. Окисление метана
Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких температурах с использованием катализатора:
2. Окисление метанола
Основной промышленный способ получения формальдегида – окисление метанола с использованием серебряного катализатора при температуре 6500С и атмосферном давлении:
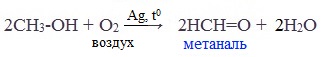
Реакция происходит на раскаленной серебряной сетке, через которую проходят пары ментола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе ее теплоты достаточно для того, чтобы поддерживать сетку в раскаленном состоянии.
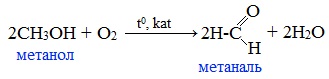
В настоящее время разработан перспективный способ высокотемпературного окисления метанола с использованием железомолибденовых катализаторов:
Альдегиды и кетоны
Источник
Здравствуйте дорогие подписчики и гости моего канала. Сегодня вас ждет статья, посвященная такому классу органических соединений, как спирты. Это весьма обширный класс веществ, часто встречающийся, как в окружающем мире, так и в тестах ЕГЭ. В этой статье я постараюсь обобщить различные элементы школьной программы относительно данной группы веществ, чтобы помочь тем, кто сдает экзамен или просто удовлетворить интерес тех, кто решил ознакомиться с современной школьной программой профильного уровня.
Начнем с определения!
Спирты – это органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (-OH), соединённых с углеводородным радикалом.
В зависимости от числа гидроксогрупп, в молекуле спирта, представителей данного класса органических соединений делят на:
Одноатомные спирты (алканолы) – это органические соединения в которых углеводородный радикал связан с одной группой –OH.
Общая формула предельных одноатомных спиртов:
CnH2n+1-OH
Двухатомные спирты (гликоли или диолы) – это органические соединения в которых две гидроксильные группы связаны с углеводородным радикалом.
Общая формула двухатомных спиртов:
CnH2n(OH)2
Гомологический ряд двухатомных спиртов (гликолей), может быть представлен так:
Трехатомный спирты (алкантриолы) – это органические вещества, содержащие в своем составе три гидроксильные группы, связанные с углеводородным радикалом.
К таким соединениям относится например глицерин:
Если в молекуле спирта содержится более трех гидроксильных групп, его относят к полиатомным спиртам, например шестиатомный спирт сорбит:
По характеру углеводородного радикала выделяют следующие спирты:
– Предельные спирты, содержащие в молекуле лишь насыщенный углеводородный радикал, например:
CH3-OH метанол
CH3-CH2-OH этанол
CH3-CH2-CH2-OH пропанол
– Непредельные спирты, содержащие в молекуле кратные (двойные или тройные) связи, между атомами углерода.
H2C=CH-OH виниловый спирт
CH2=CH-CH2-OH пропен-2-ол-1
– Ароматические спирты, содержащие в молекуле бензольное кольцо и гидроксогруппу, связанные друг с другом не на прямую, а через атомы углерода, например:
Так же не забываем, что по характеру углерода с которым соединена -OH группа, одноатомные спирты делят на:
Уже первые члены гомологического ряда предельных одноатомных спиртов, несмотря на небольшие значения относительных молекулярных масс, представляют собой жидкости. Это объясняется образованием между молекулами особой химической водородной связи.
Водородная связь – это межмолекулярная связь между атомом водорода одной молекулы и атомом сильного электроотрицательного элемента (например фтора, кислорода, азота) другой молекулы.
За счет водородной связи молекулы простейших спиртов ассоциированы в жидкости:
Поговорим подробнее о некоторых конкретных представителях класса спиртов:
Метанол (метиловый спирт или древесный спирт) – это бесцветная жидкость, со специфическим запахом, ядовит (при приеме внутрь вызывает слепоту и негативно воздействует на нервную и сердечно – сосудистую систему). Однако, несмотря на это метанол находит широкое применение:
- Он является отличным растворителем многих веществ.
- Применяется для синтеза формальдегида и формалина.
- Используется для синтеза некоторых эфиров.
- Применяется как добавка к моторному топливу.
- Используется при производстве красок.
Этанол (Этиловый спирт) – бесцветная прозрачная жидкость, со специфическим запахом, летучая и горючая. Является депрессантом – психоактивным веществом, угнетающим ЦНС человека. Применение:
- Широко применяется как растворитель.
- Входит в состав моющих средств, для стекол и сантехники.
- Служит сырьем для получения многих химических веществ, таких как: ацетальдегид, диэтиловый эфир, уксусная кислота, этилацетат, этилен и др..
- Используется для приготовления различных напитков в алкогольной промышленности.
- Является наполнителем в спиртовых термометрах.
- В медицине применяется как дезинфицирующее средство.
Этиленгликоль – это прозрачная, бесцветная жидкость, слегка маслянистой консистенции. Не имеет запаха. Токсичен! Попадание его в организм, может привести к необратимым последствиям и смерти. Применение:
- В качестве растворителя красящих веществ.
- При производстве автомобильных антифризов (низкозамерзающих жидкостей).
- При производстве целлофана.
- В производстве синтетических волокон.
- Может входить в состав средств, для мытья окон.
Глицерин – представляет собой густую и прозрачную жидкость, маслянистой консистенции. Не ядовит. Неограниченно растворим в воде, более того, очень гигроскопичен (если оставить глицерин в открытом сосуде, его масса может увеличиться до 40%, за счет поглощённой влаги из воздуха). Применение:
- Широко используется в косметической промышленности, в составе кремов, гелей, помад и т.д.
- В кожевенной промышленности (используется для защиты кожи от высыхания).
- Используется как пищевая добавка (E422) в пищевой промышленности.
- В пиротехники, глицерин используется для производства взрывчатого вещества – нитроглицерина.
- В медицине, как сосудорасширяющее средство.
Теперь поговорим о способах получения спиртов:
1. Гидратация алкенов.
2. Щелочной гидролиз галагеналканов.
Например:
Или:
Однако, не путайте взаимодействие хлоралканов с водным и спиртовым раствором щелочи, так как во втором случае произойдет дегидрогалогенирование, то есть отщепление атомов водорода и галогена, от галогеналкана:
3. Восстановление карбонильных соединений (альдегидов).
Альдегиды – это класс органических веществ, чье название происходит от латинских слов «alcohol dehydrogenatus», что означает «спирт лишенный водорода» или «алкоголь дегидрированый». Таким образом, при гидрирование или восстановление альдегидов, мы получаем спирты.
При гидрирование родственных альдегидам соединений, кетонов, можно получить двухатомные спирты:
4. Метанол можно получить из синтез – газа (смеси угарного газа и водорода).
5. Этанол можно получить ферментативным брожением углеводов.
Это очень древняя химическая реакция, которая известна людям с незапамятных времен.
Химические свойства спиртов:
1. Взаимодействие со щелочными и щелочноземельными металлами.
Водород гидроксильной группы спиртов способен восстанавливаться щелочными и щелочноземельными металлами (такими как Li, Na, K, Ca, Sr, Ba).
В результате подобных химических реакций получаются соли – алкоголяты. При этом соли метанола, носят название – метилаты, этанола – этилаты и т.д.
Важно не забывать, что алкоголяты, как соли очень слабой кислоты и сильного основания могут быть полностью гидролизованы водой.
С водными растворами щелочей спирты не взаимодействуют.
2. Взаимодействие спиртов с кислотами (этерификация).
– Возможно взаимодействие спиртов с органическими кислотами, приводящие к образованию сложных эфиров.
– Так же возможно взаимодействие спиртов с неорганическими кислотами.
Реакция с азотной кислотой будет протекать по схеме:
3. Взаимодействие с галогенводородами.
При этом происходит замещение гидроксильной группы на галоген, что ведет к образованию галогеналканов.
4. Взаимодействие с альдегидами.
В данном случае не обязательно запоминать то, как записывается данная реакция. Но о возможности протекания такой реакции, забывать, ни в коем случае, не стоит.
5. Дегидратация.
В зависимости от условий возможны два варианта протекания данной реакции.
6. Взаимодействие с аммиаком.
Эта реакция крайне важна, так лежит в основе промышленного способа получения некоторых аминов.
7. Окисление спиртов оксидом меди (II).
При этом первичные спирты окисляются до альдегидов, а вторичные до кетонов:
Третичные спирты оксидом меди (II) не окисляются.
8. Окисление перманганатом калия в кислой среде.
При этом, происходит полное окисление спирта до карбоновой кислоты:
5C2H5OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 11H2O + 2K2SO4 + 4MnSO
Вторичные спирты при такой реакции окисляются до кетонов:
5CH3- CH(OH)- CH3 +2KMnO4+3H2SO4=5 CH3-C(O)- CH3 +K2SO4+2MnSO4+8H20
Метанол окисляется до углекислого газа и воды:
CH3OH + KMnO4 + H2SO4 = CO2 + MnSO4 + K2SO4 + H2O.
9. Окисление бихроматом калия в кислой среде.
Так как бихромат калия более мягкий окислитель, чем перманганат калия, окисление первичных спиртов в нем идет до альдегидов.
3 C2H5OH + K2Cr2O7 + 4 H2SO4 → Cr2(SO4)3 + 3 CH3CHO + K2SO4 + 7 H2O
10. Окисление многоатомных спиртов свежеполученным осадком гидроксида меди (II).
Это качественная реакция сопровождающаяся образованием ярко – синего растворимого в воде комплекса.
11. Взаимодействие с кислородом (горение).
Как и при горение большинства органических веществ, в результате реакции выделяется углекислый газ и вода:
C2H5OH + 3O2 → 2CO2 + 3H2O
Вот собственно и все, что необходимо знать о спиртах, для удачной сдачи экзаменов! Конечно во второй части теста ЕГЭ возможно встретится и с более экзотическими реакциями, но такой шанс не велик.
До новых встреч!
Источник
